ГОСТ Р 58396-2019
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МАСКИ МЕДИЦИНСКИЕ
Требования и методы испытаний
Medical face masks. Requirements and test methods
ОКС 11.140
Дата введения 2019-10-01
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "Медтехстандарт" (ООО "Медтехстандарт") на основе собственного перевода на русский язык немецкоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 "Медицинские приборы, аппараты и оборудование"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 28 марта 2019 г. N 115-ст
4 Настоящий стандарт идентичен национальному немецкому стандарту ДИН ЕН 14683:2014* "Маски медицинские. Требования и методы испытаний" (DIN EN 14683:2014 "Medizinische Gesichtsmasken - Anforderungen und ![]() ; Deutsche Fassung", IDT)
; Deutsche Fassung", IDT)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международного и европейских стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
ЕН 14683:2014 подготовлен Техническим комитетом CEN/TC 205 "Неактивные медицинские изделия", секретариат которого ведет Немецкий институт по стандартизации (DIN).
ЕН 14683:2014 заменяет ЕН 14683:2005.
По отношению к ЕН 14683:2005 внесены следующие изменения:
a) изменение/расширение наименования и области распространения для более универсального и широкого использования медицинских масок;
b) корректировка согласно ИСО 22609 в отношении устойчивости к брызгам жидкости;
c) добавление требований к микробиологической чистоте и общей биосовместимости;
d) корректировка таблицы 1 для требований, предъявляемых к функциональным характеристикам медицинских масок;
e) обновление информации для пользователя в приложении А;
f) полный пересмотр приложения B относительно метода определения in vitro основных функциональных характеристик бактериального фильтра, в частности условий испытаний и конструкции испытательного оборудования;
g) редакторская правка, включая обновление всех нормативных ссылок, библиографии и приложения ZA в отношении Директивы ЕС 93/42/ЕЕС.
Информация о связи с директивами ЕС представлена в приложение ZA, которое является неотъемлемой частью настоящего стандарта.
1 Область применения
Настоящий стандарт определяет конструкцию, дизайн, требования к функциональным характеристикам и методы испытаний медицинских масок, предназначенных для ограничения передачи инфекционных агентов от персонала пациентам во время хирургических операций и в других медицинских помещениях с аналогичными требованиями. Медицинская маска с соответствующим микробным барьером также может эффективно способствовать сокращению выхода инфекционных агентов из носовой и ротовой полости бессимптомного носителя или пациента с клиническими симптомами.
Настоящий стандарт не применим к маскам, предназначенным исключительно для индивидуальной защиты персонала.
Примечание 1 - Доступны стандарты для масок, применяемых в качестве средства индивидуальной защиты.
Примечание 2 - В приложении А предоставлена информация для пользователей медицинских масок.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на стандарты, которые необходимо учитывать при его применении. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок - последние издания (включая любые изменения).
EN ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process (ISO 10993-1) (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента рисков)
EN ISO 10993-5, Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity (ISO 10993-5) (Биологическая оценка медицинских изделий. Часть 5. Испытания на цитотоксичность in vitro)
EN ISO 10993-10, Biological evaluation of medical devices - Part 10: Tests for irritation and skin sensitization (ISO 10993-10) (Оценка биологическая медицинских изделий. Часть 10. Пробы на раздражение и аллергическую реакцию кожи)
EN ISO 11737-1, Sterilization of medical devices - Microbiological methods - Part 1: Determination of a population of microorganisms on products (ISO 11737-1) (Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции)
ISO 22609, Clothing for protection against infectious agents - Medical face masks - Test method for resistance against penetration by synthetic blood (fixed volume, horizontally projected) [Одежда для защиты от инфекционных агентов. Медицинские маски. Метод испытания на сопротивление проникновению синтетической крови (установленный объем, горизонтально направленный)]
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 медицинская маска (medical face mask): Медицинское изделие, закрывающее нос и рот и обеспечивающее барьер для минимизации прямой передачи инфекционных агентов между персоналом и пациентом.
Примечание 1 - Передача возбудителей, передающихся через кровь, от пациентов персоналу может происходить через брызги.
3.2 эффективность бактериальной фильтрации; BFE (bacterial filtration efficiency, BFE): Эффективность материалов медицинской маски как барьера для проникновения бактерий.
Примечание 1 - Для измерения эффективности бактериальной фильтрации материалом медицинской маски используют метод испытания на эффективность бактериальной фильтрации.
3.3 дифференциальное давление (differential pressure): Воздухопроницаемость маски, измеренная путем определения разницы в давлении воздуха на внутренней и внешней стороне маски при определенных параметрах воздушного потока, температуры и влажности.
Примечание 1 - Дифференциальное давление является показателем воздухопроницаемости маски.
3.4 колониеобразующая единица; КОЕ (colony forming unit, cfu): Единица измерения количества культивируемых микроорганизмов.
Примечание 1 - Количество культивируемых микроорганизмов - это количество микроорганизмов, отдельных клеток или агрегатов, способных образовывать колонии на твердой питательной среде.
3.5 чистота (cleanliness): Отсутствие нежелательных инородных веществ.
Примечание 1 - К этим веществам могут относиться микроорганизмы, органические остатки или твердые частицы.
3.5.1 микробиологическая чистота (cleanliness - microbial): Отсутствие популяций жизнеспособных микроорганизмов на продукте и/или упаковке.
Примечание 1 - На практике степень микробиологической чистоты часто называют бионагрузкой.
3.5.2 чистота по твердым частицам (cleanliness - particulate matter): Отсутствие частиц, которые загрязняют материал и могут высвобождаться, но не в результате механического воздействия.
3.6 инфекционный агент (infective agent): Микроорганизм, который вызывает инфицирование хирургических ран или является возбудителем инфекции у пациента, персонала или иных лиц.
3.7 хирургическая процедура (surgical procedure): Хирургическое вмешательство с проникновением через кожу или слизистые оболочки, выполняемое при контролируемых условиях хирургической бригадой.
3.8 аэрозоль (aerosol): Аэросуспензия твердых и/или жидких частиц, имеющих ничтожно малую скорость падения.
Примечание 1 - См. ЕН 132.
Примечание 2 - Как правило, считают, что скорость - менее 0,25 м/с.
3.9 фильтр (filter): Материал, используемый для механического и физического разделения или осаждения аэрозольных частиц (жидких или твердых) из вдыхаемого и выдыхаемого воздуха.
3.10 брызгоустойчивость (splash resistance): Способность медицинской маски противостоять проникновению подаваемой при заданном давлении синтетической крови.
4 Классификация
Медицинские маски, описанные в настоящем стандарте, подразделяют на два типа (тип I и тип II) в зависимости от эффективности бактериальной фильтрации, тогда как тип II можно далее разделить на два типа в зависимости от того, является ли маска устойчивой к брызгам.
5 Требования
5.1 Общие требования
5.1.1 Материалы и конструкция
Медицинская маска представляет собой медицинское изделие, как правило, состоящее из фильтрующего слоя, помещенного, связанного или спрессованного между слоями ткани. Медицинская маска не должна расслаиваться, распадаться или разрываться во время использования. При выборе материалов фильтра и слоев особое внимание должно быть уделено степени чистоты (отсутствие твердых частиц).
5.1.2 Дизайн
Медицинская маска должна иметь средства фиксации, с помощью которых она может плотно облегать нос, рот и подбородок пользователя и которые обеспечивают плотное прилегание маски к лицу по бокам.
Медицинские маски могут иметь различную форму и конструкцию, а также дополнительные функции, такие как экран для лица (для защиты пользователя от брызг и капель) с функцией или без функции защиты от запотевания либо носовой фиксатор (для улучшения прилегания за счет повторения формы носа).
5.2 Требования к функциональным характеристикам
5.2.1 Общие требования
Все испытания должны быть проведены с использованием готовых изделий или образцов, вырезанных из готовых изделий, если это применимо в их стерильном состоянии.
5.2.2 Эффективность бактериальной фильтрации
При испытании в соответствии с приложением В эффективность бактериальной фильтрации медицинской маской должна соответствовать минимальным значениям, приведенным для соответствующего типа в таблице 1.
5.2.3 Воздухопроницаемость
При испытании в соответствии с приложением С дифференциальное давление медицинской маски должно соответствовать значениям, приведенным для соответствующего типа в таблице 1.
5.2.4 Брызгоустойчивость
При испытании в соответствии с ИСО 22609 устойчивость медицинской маски к проникновению брызг жидкости должна соответствовать минимальному значению для типа IIR в таблице 1.
5.2.5 Микробиологическая чистота (бионагрузка)
При испытании в соответствии с ЕН ИСО 11737-1 бионагрузка медицинской маски должна составлять 30 КОЕ/г (см. таблицу 1).
Примечание - В ЕН ИСО 11737-1 представлены требования и руководства для определения и описания микробной популяции жизнеспособных микроорганизмов на поверхности или внутри медицинского изделия, компонентов, сырья или упаковки.
Для определения бионагрузки маски в соответствии с ЕН ИСО 11737-1 соблюдают следующую процедуру.
Количество масок, которые должны пройти испытания, - не менее пяти, но количество может быть больше при необходимости учитывать приемлемый уровень качества 4%.
Перед испытанием каждую маску взвешивают. Маску в сборе асептически извлекают из упаковки и помещают в стерильный флакон 500 мл с 300 мл экстракционной жидкости (1 г/л пептона, 5 г/л NaCI и 2 г/л ПАВ полисорбата 20 [например, Твин 20, Alkest TW 20]).
Помещают флакон в орбитальный шейкер и встряхивают в течение 5 мин со скоростью 250 об/мин. После этапа экстракции 100 мл экстрагированной жидкости фильтруют через фильтр 0,45 мкм и помещают в чашку, содержащую триптический соевый агар (ТСА), для подсчета общего количества жизнеспособных аэробных микроорганизмов. Другие 100 мл аликвоты той же экстрагированной жидкости фильтруют тем же способом и содержимое высевают на декстрозный агар Сабуро (ДАС) с хлорамфениколом для подсчета грибов. Чашки инкубируют в течение трех дней при температуре 30°С и семи дней при температуре от 20°С до 25°С для ТСА и ДАС соответственно.
Общая бионагрузка представляет собой сумму результатов для ТСА и ДАС.
В протоколе указывают общую бионагрузку на одну маску и в зависимости от веса маски общую бионагрузку на грамм испытуемого материала.
5.2.6 Биосовместимость
В соответствии с определением и классификацией ЕН ИСО 10993-1 медицинская маска представляет собой изделие кратковременного контакта. Изготовитель должен выполнить оценку медицинской маски и определить применимый метод токсикологических исследований в соответствии с ЕН ИСО 10993-1. Результаты исследований должны быть задокументированы в соответствии с действующими частями серии ЕН ИСО 10993. Результаты исследований должны быть доступны по запросу.
Как минимум, должны быть применены ЕН ИСО 10993-5 и ЕН ИСО 10993-10.
5.2.7 Сводка данных по основным функциональным характеристикам
Таблица 1 - Основные функциональные характеристики медицинских масок
Испытание | Тип I | Тип II | Тип IIR |
Эффективность бактериальной фильтрации, % |
|
|
|
Дифференциальное давление, Па/см | <29,4 | <29,4 | <49,0 |
Давление сопротивляемости брызгам, кПа | Не применимо | Не применимо |
|
Микробиологическая чистота, КОЕ/г |
|
|
|
| |||
6 Маркировка и предоставляемая информация
В разделе 13 приложения I Директивы по медицинским изделиям (93/42/ЕЕС) представлена информация, которая должна быть указана на упаковке, в которой медицинскую маску поставляют.
Дополнительно должна быть предоставлена следующая информация:
a) номер настоящего стандарта;
b) тип маски (согласно таблице 1).
Должны быть применены ЕН ИСО 15223-1 и ЕН 1041.
Приложение А
(справочное)
Информация для пользователей
При дыхании, разговоре, кашле, чихании и т.д. у человека выделяется то или иное количество капельных частиц из слизистых оболочек ротовой и носовой полости. Большинство частиц имеют размер от 0,5 до 12 мкм в диаметре, и особенно крупные капли могут содержать микроорганизмы источника. Частицы впоследствии могут распространяться воздушным путем и попадать на восприимчивые участки, такие как открытые операционные раны или стерильное оборудование.
Медицинские маски предназначены для использования в операционных и медицинских помещениях с аналогичными требованиями для полной защиты рабочей среды. В настоящем стандарте описаны два типа медицинских масок с соответствующими уровнями защиты. Как минимум, медицинские маски типа I используют для пациентов для снижения риска распространения инфекции, особенно при эпидемиях и пандемиях. Маски типа II преимущественно используют профессионалы в области здравоохранения в операционных или в иных медицинских помещениях с аналогичными требованиями.
Особыми условиями, также регулируемыми в отношении медицинских изделий, является потребность пользователя защитить себя от брызг потенциально загрязненных жидкостей и частиц, которые возникают в хирургической среде, например путем использования устройств для электрокаутеризации.
Если предусмотренным применением маски является защита пользователя от инфекционных агентов (бактерии, вирусы или грибы), следует рассмотреть использование респиратора. Функциональные характеристики респираторов представлены в ЕН 149.
Предполагаемый уровень эффективности маски зависит от ряда факторов, таких как эффективность фильтрации, качество материалов и степень прилегания маски к лицу пользователя. Различные конструкции подходят для различных применений, и поэтому тщательный выбор маски важен для достижения желаемого результата.
Фильтрующая способность материалов маски может варьироваться в зависимости от фильтрующего материала. Степень прилегания маски значительно различается для масок, которые крепятся с помощью петель за ушами пользователя, и масок, фиксирующихся вокруг головы и имеющих носовой фиксатор, который может повторять форму носа пользователя. Влияние степени прилегания может быть испытано in vivo, а эффективность фильтрации может быть протестирована в ходе воспроизводимых испытаний in vitro.
Значительные отклонения в результатах при испытаниях маски in vivo приводят к необходимости проведения испытаний широкой группы испытуемых объектов и наблюдений. Таким образом, функциональные характеристики маски определяют при испытаниях материалов маски in vitro. Тем не менее важно тщательно учитывать степень прилегания маски при выборе маски для определенного применения. Пользователи должны запрашивать такую информацию у поставщиков.
Еще одним учитываемым фактором является способность маски поглощать влагу из выдыхаемого воздуха и тем самым поддерживать свои функциональные характеристики в течение более длительного периода времени. Улучшенные конструкции легко сохраняют свои функциональные характеристики в течение даже очень длительных операций, в то время как менее усовершенствованные изделия предназначены только для коротких процедур.
Риск загрязнения, возникающий в результате контакта рук с использованной маской, является причиной обязательной утилизации маски после ее снятия. При дополнительной потребности в защите следует надеть новую маску. Контакт с использованной маской или надевание новой маски всегда должны сопровождаться процедурой дезинфекции рук в полном объеме, а использованная маска должна быть утилизирована после ее применения или между двумя процедурами.
Использование соответствующей маски является эффективным средством защиты рабочей среды от капельного загрязнения выделениями из носовой полости и горла во время проведения медицинских процедур. При этом доступны маски с широким диапазоном функциональных характеристик. Поэтому такие факторы, как риск инфицирования и степень прилегания маски, следует тщательно учитывать при выборе маски.
Приложение В
(обязательное)
Метод определения эффективности бактериальной фильтрации in vitro
ПРЕДУПРЕЖДЕНИЕ - Золотистый стафилококк является возбудителем инфекции. Должны быть соблюдены соответствующие положения национального законодательства и инструкции в области гигиены при обращении с патогенными микроорганизмами.
В.1 Принцип метода
Образец материала маски помещают в шестиступенчатый каскадный импактор и аэрозольную камеру. Аэрозоль золотистого стафилококка вводят в аэрозольную камеру и проводят через материал маски и импактор в условиях вакуума. Эффективность бактериальной фильтрации маски представляет собой число КОЕ, проходящих через материал медицинской маски, выраженное в процентах от числа КОЕ, присутствующих в аэрозоле провокационной пробы.
В.2 Реагенты и материалы
В.2.1 Общие положения
В В.2.2 и В.2.3 описаны имеющиеся в продаже растворы триптического соевого агара и триптического соевого бульона. Могут быть использованы другие варианты.
В.2.2 Триптический соевый агар
Формула/л | |
Ферментативный продукт переваривания казеина | 15 г |
Ферментативный продукт переваривания соевого шрота | 5 г |
Хлорид натрия | 5 г |
Агар | 15 г |
Конечное значение pH | (7,3±0,2) при температуре 25°С |
В.2.3 Триптический соевый бульон
Формула/л | |
Ферментативный продукт переваривания казеина | 17 г |
Ферментативный продукт переваривания соевого шрота | 3 г |
Хлорид натрия | 5 г |
Дигидрофосфат калия | 2,5 г |
Декстроза | 2,5 г |
Конечное значение pH | (7,3±0,2) при температуре 25°С |
В.2.4 Пептонная вода
Формула/л | |
Пептон | 10 г |
Хлорид натрия | 5 г |
Конечное значение pH | (7,2±0,2) при температуре 25°С |
В.2.5 Культура золотистого стафилококка АТСС 6538, растущая на скошенном триптическом соевом агаре
В.3 Оборудование
В.3.1 Шестиступенчатый каскадный импактор.
В.3.2 Распылитель, способный доставлять частицы среднего размера (3,0±0,3) мкм при контакте с импактором.
В.3.3 Аэрозольная камера, стекло, длина 600 мм, внешний диаметр 80 мм.
В.3.4 Расходомер, способный измерять расход 28,3 л/мин.
В.3.5 Датчик давления, способный измерять давление 35 кПа с точностью ±1 кПа.
В.3.6 Колбы Эрленмейера, объем 250 и 500 мл.
В.3.7 Перистальтический или шприцевой насос производительностью 0,01 мл/мин.
В.3.8 Вакуумный насос, способный поддерживать расход 57 л/мин.
В.4 Образцы
Испытуемые образцы должны быть вырезаны из готовой маски. Каждый образец должен быть размером не менее 100х100 мм и включать в себя все слои маски в том порядке, в котором они находятся в готовой маске. Количество образцов, которые должны пройти испытания, - не менее пяти, но количество может быть больше при необходимости учитывать приемлемый уровень качества 4%. Все испытуемые образцы должны быть взяты из репрезентативных участков для включения всех/любых вариантов конструкции. Если не указано иное, испытания должны быть проведены с внутренней стороны медицинской маски, находящейся в контакте с бактериальной провокационной пробой.
Каждый испытуемый образец выдерживают при температуре (21±5)°С и относительной влажности воздуха (85±5)% в течение времени, необходимого для приведения в равновесие с атмосферными условиями до начала испытаний.
В.5 Приготовление бактериальной провокационной пробы
Золотистый стафилококк (см. В.2.4) должен быть инокулирован в 30 мл триптического соевого бульона в колбе Эрленмейера и инкубирован при слабом встряхивании при температуре (37±2)°С в течение (24±2) ч. Затем культуру разводят в пептонной воде до концентрации примерно 5·10 КОЕ/мл.
Бактериальная проба должна поддерживать концентрацию (2200±500) КОЕ на тест. Бактериальную пробу определяют на основе опыта и предыдущих положительных результатов контрольных чашек (см. В.6.3) и разведение провокационной суспензии корректируют соответственно. Средний размер частиц в бактериальной пробе должен поддерживаться на уровне (3,0±0,3) мкм (см. В.6.9).
В.6 Процедура
В.6.1 Собирают прибор в соответствии со схемой, приведенной на рисунке В.1.
В.6.2 Помещают бактериальную провокационную пробу в распылитель с помощью перистальтического или шприцевого насоса.
В.6.3 Выполняют положительный контроль без испытуемого образца. Начинают моделирование бактериального заражения, включив вакуумный насос, регулируют расход через каскадный импактор до 28,3 л/мин. Добавляют бактериальную пробу на 1 мин. Поддерживают поток воздуха через импактор в течение 2 мин. Затем вынимают чашки из импактора. Убеждаются в том, что каждая чашка пронумерована с указанием положения в импакторе.
В.6.4 Помещают свежие чашки в импактор, фиксируют образец и повторяют описанную выше процедуру.
В.6.5 Повторяют эту процедуру для каждого испытуемого образца.
В.6.6 После испытания последнего образца выполняют дополнительный положительный контроль.
В.6.7 Выполняют отрицательный контроль с прохождением воздуха без добавления бактериальной пробы через каскадный импактор в течение 2 мин.
В.6.8 Инкубируют все чашки при температуре (37±2)°С в течение (48±4) ч.
В.6.9 Для каждого образца и контроля подсчитывают количество колоний в каждой чашке и суммируют результаты для получения общего числа КОЕ, собранных импактором с использованием таблицы преобразования "positive hole" в соответствии с инструкциями изготовителя каскадного импактора (три - шесть ступеней). Для двух положительных контролей принимают среднее значение двух сумм. Для чашек положительного контроля вычисляют средний размер частиц аэрозоля бактериальной пробы с помощью таблицы преобразования "positive hole" в соответствии с инструкциями изготовителя каскадного импактора.
______________
См. таблицу преобразования "positive hole" в руководстве пользователя пробоотборника Андерсена.
В.7 Расчет эффективности бактериальной фильтрации
Для каждого образца рассчитывают эффективность бактериальной фильтрации В, %, по следующей формуле:
В=(С-Т)/С·100,
где С - среднее значение количества бактерий для всех чашек для двух положительных контролей;
Т - общее количество бактерий для образца.
В.8 Протокол испытаний
В протоколе испытания должна быть представлена следующая информация:
a) номер и дата настоящего стандарта;
b) номер или код серии испытуемых масок;
c) размеры испытательных образцов и размер тестируемого участка;
d) сторона тестируемого образца, обращенная к провокационному аэрозолю;
e) расход во время испытания;
f) среднее значение общего количества бактерий для двух положительных контролей;
g) среднее число колоний в чашках отрицательного контроля;
h) эффективность бактериальной фильтрации для каждого испытанного образца.
|
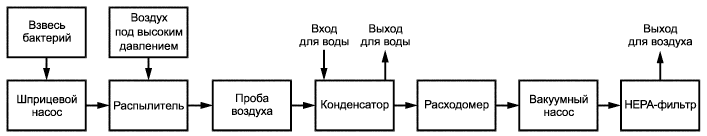
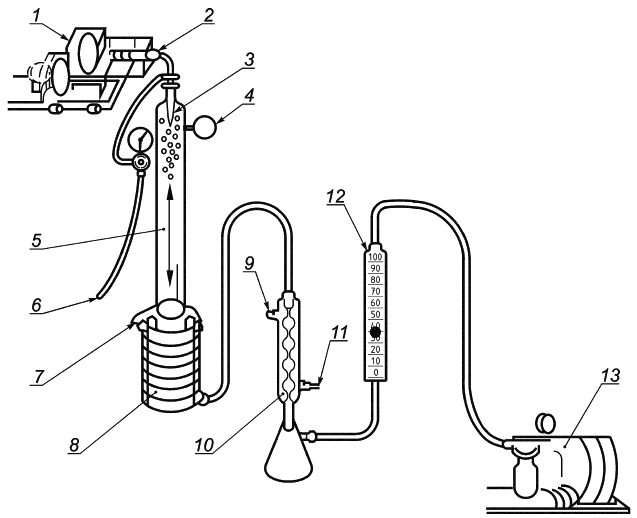
Рисунок B.1 - Принцип работы прибора для испытания эффективности бактериальной фильтрации
|
1 - приводной механизм; 2 - взвесь бактерий; 3 - распылитель; 4 - фильтр; 5 - аэрозольная камера; 6 - источник воздуха высокого давления; 7 - тестируемый материал; 8 - микробиологический пробоотборник; 9 - выход для раковины; 10 - конденсатор; 11 - вход для холодной воды; 12 - откалиброванный расходомер; 13 - компрессор (вакуумный насос)
Рисунок B.2 - Прибор для испытания эффективности бактериальной фильтрации
Приложение С
(обязательное)
Метод определения воздухопроницаемости (дифференциальное давление)
С.1 Принцип метода
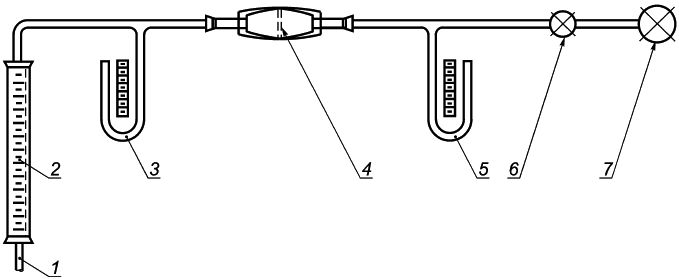
Прибор для измерения дифференциального давления для перемещения воздуха через измеренную площадь поверхности с постоянным расходом воздуха используют для измерения давления воздухообмена материала медицинской маски, как показано на рисунке С.1. Для измерения перепада давления используют водонаполненные манометры (М1 и М2). Расходомер используют для измерения расхода воздуха. Электрический вакуумный насос перемещает воздух через прибор, для регулировки расхода воздуха используют игольчатый клапан.
|
1 - воздухозаборник; 2 - расходомер; 3 - манометр М1; 4 - фильтрующий материал; 5 - манометр М2; 6 - клапан; 7 - вакуумный насос
Рисунок С.1 - Прибор для измерения сопротивления воздуха
С.2 Оборудование
С.2.1 Расходомер, способный измерять расход воздуха 8 л/мин.
С.2.2 Манометры М1 и М2 или дифференциальный манометр.
С.2.3 Электрический вакуумный насос.
С.2.4 Клапан.
С.3 Образцы
Испытуемые образцы представлены готовыми масками или частями, вырезанными из масок. Каждый образец должен представлять пять различных круглых тестируемых участков диаметром 2,5 см. Если один образец не может быть представлен пятью тестируемыми участками диаметром 2,5 см, количество полученных тестируемых участков должно быть репрезентативным для всей маски. Количество образцов, которые должны пройти испытания, - не менее пяти, но количество может быть больше при необходимости учитывать приемлемый уровень качества 4%. Все испытуемые образцы должны быть взяты из репрезентативных участков для включения всех/любых вариантов конструкции.
Каждый испытуемый образец выдерживают при температуре (21±5)°С и относительной влажности воздуха (85±5)% в течение времени, необходимого для приведения в равновесие с атмосферными условиями до начала испытаний.
С.4 Процедура
С.4.1 Испытуемый образец помещают поперек отверстия диаметром 2,5 см (общая площадь - 4,9 см) и фиксируют для минимизации утечки воздуха и обеспечения соответствия положения испытуемого участка образца на одной линии перпендикулярно потоку воздуха.
С.4.2 После запуска насоса расход воздуха регулируют до 8 л/мин.
С.4.3 Показания манометров М1 и М2 считывают и регистрируют.
С.4.4 Процедуру, описанную в С.4.1-С.4.3, проводят для пяти (или соответствующего количества) различных участков маски, результаты усредняют.
С.5 Расчет дифференциального давления
Для каждого испытуемого образца вычисляют перепад давления ![]() следующим образом:
следующим образом:
![]() ,
,
где ![]() - давление, Па, манометр М1, среднее значение пяти тестируемых участков, сторона материала с низким давлением;
- давление, Па, манометр М1, среднее значение пяти тестируемых участков, сторона материала с низким давлением;
![]() - давление, Па, манометр М2, среднее значение пяти тестируемых участков, сторона материала с высоким давлением;
- давление, Па, манометр М2, среднее значение пяти тестируемых участков, сторона материала с высоким давлением;
4,9 - площадь тестируемого материала, см;
![]() - разница давления на квадратный сантиметр исследуемого материала, выраженного в паскалях.
- разница давления на квадратный сантиметр исследуемого материала, выраженного в паскалях.
С.6 Протокол испытаний
В протоколе испытаний должна быть представлена следующая информация:
a) номер и дата настоящего стандарта;
b) номер или код серии испытуемых масок;
c) расход во время испытания;
d) дифференциальное давление для каждого тестируемого образца.
Приложение ZA
(справочное)
Взаимосвязь между ЕН 14683:2014 и общими требованиями Директивы ЕС 93/42/ЕЕС по медицинским изделиям
ЕН 14683:2014 подготовлен в соответствии с мандатом, выпущенным для CEN Европейской комиссией, для обеспечения средств подтверждения соответствия общим требованиям нового подхода Директивы ЕС 93/42/ЕЕС по медицинским изделиям.
После опубликования ссылки на ЕН 14683:2014 в официальном журнале Европейского союза в рамках данной директивы и после внедрения в качестве национального стандарта как минимум в одном государстве-участнике соблюдение положений ЕН 14683:2014 согласно таблице ZA.1 представляет в рамках ЕН 14683:2014 презумпцию соответствия общим требованиям данной директивы и связанным нормативным положениям Европейской ассоциации свободной торговли.
Таблица ZA.1 - Соответствие настоящего стандарта Директиве ЕС 93/42/ЕЕС по медицинским изделиям
Пункт/подпункт ЕН 14683:2014 | Соответствующее общее требование Директивы 93/42/ЕЕС | Комментарии |
5.1.1, 5.1.2, 5.2.1, 5.2.2, 5.2.3, 6 | 8.1 | - |
5.2.2 | 9.2 | - |
6 | 13 | - |
ПРЕДУПРЕЖДЕНИЕ - К продукту могут быть применены прочие требования и другие директивы ЕС в рамках сферы применения ЕН 14683:2014.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международного и европейских стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного, европейского стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
EN ISO 10993-1 | IDТ | ГОСТ ISO 10993-1-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования" |
EN ISO 10993-5 | IDТ | ГОСТ ISO 10993-5-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro" |
EN ISO 10993-10 | IDТ | ГОСТ ISO 10993-10-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия" |
EN ISO 11737-1 | IDТ | ГОСТ ISO 11737-1-2012 "Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции" |
ISO 22609 | - | * |
* Соответствующий национальный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Официальный перевод данного международного стандарта находится в Федеральном информационном фонде стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDТ - идентичные стандарты. | ||
Библиография
[1] | EN-132, Respiratory protective devices - Definitions of terms and pictograms |
[2] | EN 149, Respiratory protective devices - Filtering half-masks to protect against particles - Requirements, testing, marking |
[3] | EN 1041, Information supplied by the manufacturer of medical devices |
[4] | EN 1174 (all parts), Sterilisation of medical devices - Estimation of the population of microorganisms on product |
[5] | EN ISO 15223-1, Medical devices - Symbols to be used with medical device labels, labelling and information to be supplied - Part 1: General requirements (ISO 15223-1) |
[6] | 93/42/EEC, Council Directive 93/42/EEC of 14 June 1993 concerning medical devices as amended by DIRECTIVE 2007/47/EC of the European Parliament and of the Council of 5 September 2007 |
[7] | ISO 139, Textiles - Standard atmospheres for conditioning and testing |
УДК 614.894.3:006.354 | ОКС 11.140 |
Ключевые слова: маски медицинские, требования, испытания, медицинское изделие, функциональные характеристики, фильтрация, образец | |
Электронный текст документа
и сверен по:
, 2019