ГОСТ Р 57005-2016
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Диагностика в онкологии
СКРИНИНГ
Рак шейки матки
Diagnostics in oncology. Screening. Cervical cancer
ОКС 03.040,
11.040.01,
11.100.01
Дата введения 2017-02-01
Предисловие
1 РАЗРАБОТАН Автономной некоммерческой организацией "Центр Инновационных Технологий в Онкологии" (АНО "ЦИТО")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 216 "Диагностика в онкологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 1 июля 2016 г. N 796-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
В настоящем стандарте реализованы основные нормативные положения документа [1].
Стандарт разработан для внедрения в практику здравоохранения унифицированных алгоритмов и методов ранней диагностики опухолей человека с целью оптимизации и систематизации деятельности лечебно-профилактических учреждений и специалистов в области раннего выявления и ранней диагностики рака; для эффективной и своевременной диагностики и лечения, что повлечет за собой увеличение выживаемости, снижение смертности, будет способствовать масштабной борьбе против рака на глобальном, региональном и национальном уровнях, укреплению системы здравоохранения на всех уровнях; для улучшения доступности диагностики и лечения для пациентов, страдающих онкологическими заболеваниями.
Также стандарт может быть использован учреждениями здравоохранения и органами государственной власти при создании нормативных правовых актов.
Программа скрининга рака шейки матки широко признана как одна из самых успешных программ профилактики рака в мире. После внедрения в 1988 г. в Великобритании программы всеобщего скрининга рака шейки матки было отмечено прогрессирующее снижение смертности от этого заболевания. Характерное для рака шейки матки медленное прогрессирование от самых ранних его стадий до инвалидизирующего рака предоставляет широкие возможности для проведения его ранней диагностики и лечения.
Для адекватного выполнения диагностических и лечебных мероприятий, правильной интерпретации исследований, а также для эффективной синхронизации при взаимодействии медицинских работников любых уровней, лечебных учреждений, специализаций и стран необходимо знание и единое понимание целей, задач, возможностей скрининга, правил его организации и алгоритмов проведения на всех этапах, единое знание и понимание анатомических, топографических и других медицинских терминов и классификаций, строгая отчетность и систематический контроль качества.
1 Область применения
Настоящий стандарт разработан как руководство по организации цитологического скрининга рака шейки матки для специалистов в области организации здравоохранения, руководителей лечебно-профилактических учреждений и лабораторий, сотрудников цитологических, молекулярно-генетических, клинико-диагностических лабораторий и патологоанатомических отделений с целью своевременного выявления и постановки полноценного развернутого диагноза, снижения заболеваемости раком и смертности от него, а также для оптимизации и повышения экономической эффективности профилактических и лечебных мероприятий.
Настоящий стандарт распространяется на процедуры:
- организации цитологического скрининга рака шейки матки;
- получения материала для исследования в рамках цитологического скрининга;
- подготовки и доставки материала в лабораторию;
- документального оформления на всех этапах;
- дополнительные лабораторные исследования, осуществляемые с целью выявления патологии и установления диагноза.
Всемирная организация здравоохранения настоятельно рекомендует обратить особое внимание:
- на организацию материально-технического обеспечения и укомплектованность кадрами;
- обеспечение соответствующего профессионального уровня сотрудников путем организации регулярного повышения квалификации для них и контроля качества диагностических мероприятий;
- обеспечение тесного контакта в рамках служебных взаимоотношений между сотрудниками путем организации регулярных встреч для обсуждения профессиональных вопросов и совместного обучения членов команды вне зависимости от их специализации.
_______________
Необходимо отметить, что борьба против рака шейки матки может быть эффективной только в случае, если в стране:
- существует национальная политика борьбы с раком шейки матки, учитывающая природу этого заболевания, распространенность, зависимость от многих факторов, в том числе от возраста;
- выделено на государственном уровне финансирование этой национальной программы;
- на государственном уровне в рамках программы национального скрининга поддерживаются и реализуются программы санпросвещения, осуществляется поддержка профилактических мероприятий;
- эти мероприятия проводятся систематически;
- осуществляется контроль над деятельностью и контроль качества выполняемых исследований;
- службы, проводящие исследования, находятся в тесном контакте с учреждениями, в которых, при необходимости, может проводиться дальнейшее обследование и лечение пациенток.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт:
ГОСТ Р 57004 Диагностика в онкологии. Алгоритм диагностики. Шейка матки. Лабораторный этап
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины, определения и сокращения
3.1 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р 57004, а также следующие термины с соответствующими определениями:
3.1.1
виала: Контейнер с герметичной крышкой, содержащий транспортную жидкость, предназначенный для хранения и транспортирования клеточного материала. [ГОСТ Р 57004, статья 2.1.2] |
3.1.2 вирус папилломы человека; ВПЧ: Группа ДНК-содержащих вирусов, тропных к плоскому эпителию, часть из которых играет ключевую роль в развитии эпителиальных дисплазий и рака шейки матки.
3.1.3 дезоксирибонуклеиновая кислота вируса папилломы человека; ДНК ВПЧ: Дезоксирибонуклеиновая кислота, кодирующая белки вируса папилломы человека, несущая уникальные последовательности нуклеотидов (генетический код), характерные для определенного генотипа вируса папилломы человека.
3.1.4 жидкостная цитология: Способ пробоподготовки материала для цитологического исследования, имеющий определенные преимущества по сравнению с классическим методом и предоставляющий более широкие возможности для диагностики.
3.1.5
мазок: Препарат, приготавливаемый путем нанесения и равномерного распределения (размазывания) биологического материала. [ГОСТ Р 57004, статья 2.1.3] |
3.1.6 цитологический препарат: Клеточный материал, полученный любым способом, нанесенный на предметное стекло для микроскопического исследования.
3.1.7 рак шейки матки: Группа злокачественных новообразований эпителиальной природы, возникающих на влагалищной части шейки матки, в зоне трансформации, цервикальном канале.
3.1.8 диагностический скрининг: Комплекс мер в организации здравоохранения, направленных на раннюю диагностику и выявление заболеваний у клинически бессимптомных лиц в популяции.
3.1.9 скрининг рака шейки матки: Комплекс мер в организации здравоохранения, направленных на выявление патологических изменений на влагалищной части шейки матки, в зоне трансформации, цервикальном канале у здоровой популяции; на формирование групп риска.
3.1.10
транспортная жидкость: Специальная жидкость, использующаяся в жидкостной цитологии для сохранения и/или транспортирования материала. Как правило, представляет собой изотонический раствор с консервантами, фиксирующий и предохраняющий клетки от быстрого распада. [ГОСТ Р 57004, статья 2.1.5] |
3.1.11 лаборант цитологической лаборатории; фельдшер-лаборант; цитотехник; цитотехнолог: Специалист со средним специальным медицинским образованием, имеющий соответствующую квалификацию.
3.1.12 цитопатолог; цитолог: Специалист, работающий в системе здравоохранения, получивший высшее профессиональное образование, имеющий подготовку или переподготовку по специальности "клиническая лабораторная диагностика", прошедший подготовку по клинической цитологии. Главной функциональной обязанностью является проведение диагностического исследования цитологического материала, результатом которого является цитологическое заключение.
3.1.13
цитощетка: Щеточка для получения эндоцервикальных образцов. [ГОСТ Р 57004, статья 2.1.6] |
3.1.14
cervex-brush: Щеточка для получения биоматериала из Т-зоны (зоны трансформации шейки матки) и влагалищной части шейки матки. [ГОСТ Р 57004, статья 2.1.7] |
3.1.15
ID (identification): Уникальный идентификатор, который присваивается системой каждой отдельной записи или каждому пациенту. [ГОСТ Р 57004, статья 2.1.8] |
3.2 Сокращения
В настоящем стандарте использованы следующие сокращения:
ВОЗ - Всемирная организация здравоохранения;
ВПЧ-ВР - вирус папилломы человека высокого канцерогенного риска;
ДНК - дезоксирибонуклеиновая кислота
ЖЦ, LBC - жидкостная цитология
ИС - информационная система;
ИЦХ - иммуноцитохимия;
ЛИМС - лабораторная информационная менеджмент-система;
ЛИС - лабораторная информационная система;
ЛПУ - лечебно-профилактическое учреждение;
МКБ-10 - Международная классификация болезней 10-го пересмотра;
ПЦР, PCR - полимеразная цепная реакция;
РШМ - рак шейки матки;
СРШМ - скрининг рака шейки матки;
ФИО - фамилия, имя, отчество.
4 Получение цитологического материала для исследования в рамках реализации программы скрининга рака шейки матки
Для цитологического скрининга приглашаются женщины без выявленной патологии органов женской репродуктивной системы, находящиеся в возрастном диапазоне, утвержденном для этого исследования Министерством здравоохранения Российской Федерации.
_______________
В число обследуемых в рамках СРШМ ВОЗ считает необходимым включать всех женщин в возрасте 25-65 лет, которым никогда не проводилось цитологическое исследование мазков с шейки матки или проводилось более 3 лет назад, либо в соответствии с действующими национальными рекомендациями.
4.1 Для приготовления классического препарата клеточный материал с шейки матки забирают с помощью шпателя Эйра или цитощеток. Использовать для забора материала ватный тампон и другие приспособления недопустимо.
4.2 Материал должен быть получен с влагалищной части шейки матки и цервикального канала, включая всю зону трансформации (зона стыка, переходная зона) слизистой оболочки шейки матки.
_______________
Зона трансформации - гистологический термин, обозначающий участок слизистой оболочки шейки матки в месте, где многослойный плоский эпителий, характерный для влагалищной части шейки матки, переходит в цилиндрический эпителий, характерный для канала шейки матки.
4.3 Получение материала для цитологического скрининга должно быть отложено, если у женщины:
- менструация;
- острое воспалительное заболевание половых путей;
- беременность.
5 Подготовка и оформление материала
Метод получения материала и приготовления препаратов, который будет использоваться в каждом конкретном случае, следует заранее четко согласовать между лабораторией и всеми прикрепленными ЛПУ, что должно быть отражено в соответствующем документе (приказе по ЛПУ и на уровне регионального органа управления здравоохранением).
При подготовке и оформлении материала абсолютно недопустимым является:
- использование загрязненных, поврежденных предметных стекол;
- использование для маркировки препаратов стеклографов-карандашей старого образца, маркеров на водяной основе;
- отправка для исследования немаркированного материала;
- отправка материала без сопровождающих документов;
- отсутствие в ЛПУ документально оформленного "прикрепления" к конкретной лаборатории с указанием согласованных взаимных правил и требований, касающихся получения материала, приготовления препаратов, оформления, доставки материала для исследования, сроков доставки, повторных исследований, сроков проведения исследования и предоставления заключений и отчетов, порядка направления пациенток с выявленной патологией для обследования и лечения в другие ЛПУ и т.п.
5.1 Традиционный (классический) метод
5.1.1 Если лаборатория, в которую отправляется материал, использует методы окраски материала по-Паппенгейму, по-Лейшману, по-Романовскому, то материал необходимо нанести на предметное стекло, стараясь равномерно распределить его по препарату для получения максимально равномерного тонкого слоя (монослоя), воздерживаясь при этом от сильного давления на препарат, во избежание раздавливания и/или деформации клеток, затем оставить препарат "открытым" для подсушивания.
Если лаборатория окрашивает материал по-Папаниколау, то материал необходимо нанести на предметное стекло и еще "влажным" немедленно фиксировать. Фиксацию производить смесью Никифорова в течение 10 мин или специальными готовыми растворами-фиксаторами.
5.1.2 Немедленно маркировать (подписать) препарат, используя простой карандаш (если стекло имеет специально обработанный край), тушь или перманентный маркер.
При маркировке указывается ФИО пациентки и/или ее ID (в случае, если сотрудник, проводящий забор материала для исследования, и цитологическая лаборатория используют единую информационную систему). Возможно использование штрих-кодов и номеров, присваиваемых исследованию информационной системой, если используется штрихкодирование. В любом случае маркировка должна быть четкой, читаемой, надежно закрепленной на стекле, не смываемой водой.
5.1.3 Обязательно подсушивание, во избежание повреждения и/или склеивания при перевозке.
5.2 Метод жидкостной цитологии
_______________
Преимущества метода ЖЦ очень существенны. Метод LBC в значительной степени заменил традиционный мазок с шейки матки в Соединенных Штатах Америки и большинстве стран Европы. Данные, собранные Колледжем американских патологов с сотен американских лабораторий, документально подтверждают уровень обнаружения предраковых изменений эпителия способом ThinPrep. Он в два раза превышает показатели, представленные по традиционным мазкам.
Признана положительная прогностическая ценность и специфичность метода, что позволяет говорить об экономически эффективном обнаружении конкретных и клинически значимых признаков заболевания шейки матки.
5.2.1 Для получения материала используются одноразовые цитощетки различного типа (см. рисунки 1-2). Для получения более информативного материала рекомендуется использовать два вида щеток cervex-brush и цитощетки различных типов.
Рисунок 1 - Цитощетка или щетка цервикальная
Рисунок 2 - Комбинированная щеточка, cervex-brush
Цитощетка должна быть со щетинками, расположенными под углом 90°. При заборе материала ее следует поворачивать на 90° не менее двух раз.
Комбинированная щеточка используется для одномоментного получения материала из цервикального канала и влагалищной части ШМ. При заборе материала следует сделать пять оборотов по часовой стрелке.
5.2.2 Непосредственно после получения материала каждую щетку необходимо немедленно перенести в транспортную жидкость в емкость-виалу, отделив саму щетку от рукоятки (если производителем щетки не предусмотрено иное), и герметично закрыть виалу с целью исключения возможности проливания и испарения содержимого.
5.2.3 Маркировка виал производится в процедурном кабинете непосредственно после забора биоматериала. Для маркировки виал необходимо использовать простой карандаш, ручку (при наличии у виалы бумажной этикетки) или перманентный маркер.
При маркировке указывают ФИО пациентки и/или ее ID (в том случае, если сотрудник, получающий материал для исследования, и лаборатория используют единую информационную систему). Возможно применение штрих-кодов и номеров, присваиваемых исследованию информационной системой, если используется штрихкодирование. В любом случае маркировка должна быть четкой, читаемой, надежно закрепленной на виале, не смываемой водой.
6 Отправка и транспортирование материала в лабораторию
6.1 Материал, направляемый в лабораторию, сопровождается заполненным направлением на исследование. Возможно использовать форму направления, установленную в ГОСТ Р 57004 (приложение А).
6.2 В направлении, прилагаемом к материалу, должна содержаться, как минимум, следующая информация:
- фамилия, имя, отчество пациентки;
- дата рождения;
- номер истории болезни/амбулаторной карты/другой номер, идентифицирующий пациентку;
- наименование запрашиваемого исследования (например, "направляется на: цитологический СРШМ");
- причина обследования (например, "скрининг", "профилактический осмотр", "онкопоиск") или клинический диагноз;
- дата последней менструации или длительность постменопаузы;
- количество препаратов или виал с материалом и данные, какой материал в них содержится (например, эндоцервикс, эктоцервикс), в случае штрихкодирования препаратов/виал эта информация указывается в направлении напротив каждого штрих-кода;
- дата и время сбора материала;
- фамилия лица, направившего материал на исследование;
- контактные данные врача, направляющего материал для исследования.
При отсутствии информации в заполняемом поле необходимо поставить прочерк.
Наличие пустых полей в бланке направления недопустимо.
6.3 Направление может быть оформлено в электронном виде при наличии ЛИС и должно давать доступ к указанной информации в рамках прав доступа к информации каждого конкретного медицинского работника.
6.4 Порядок "накопления" (сбора) материала из ЛПУ для отправки в цитологическую лабораторию должен быть четко согласован между ЛПУ и лабораторией, утвержден соответствующим приказом по ЛПУ и на уровне регионального органа управления здравоохранением.
6.5 Материал из ЛПУ должен отправляться в лабораторию не реже одного раза в неделю, за исключением особых ситуаций, оговариваемых отдельно.
6.6 Прием материала должен осуществляться ответственным сотрудником лаборатории под роспись с указанием даты и времени доставки. Порядок доставки и приема также необходимо заранее согласовать между ЛПУ и лабораторией, что должно быть оформлено документально.
7 Лабораторный этап
7.1 Требования к медицинскому персоналу
7.1.1 Сотрудники ЛПУ, отправляющие материал для исследования в конкретную лабораторию, должны знать, какой метод пробоподготовки и окрашивания используется в лаборатории, так как это влияет на выбор способа забора, хранения и транспортирования материала. Это должно быть предварительно согласовано и оговорено в приказе о прикрепленности ЛПУ к конкретной лаборатории. Материал для исследования должен готовиться и транспортироваться в лабораторию с учетом требований метода, используемого лабораторией.
7.1.2 В рамках проведения цитологического СРШМ лаборатория осуществляет:
- прием материала;
- регистрацию;
- пробоподготовку;
- проведение исследования;
- оценку результатов исследования;
- формирование заключения или протокола исследования и рекомендаций;
_______________
Протокол исследования содержит описание макропрепарата, способа пробоподготовки, окраски, оценки информативности (с разъяснениями в случае малоинформативного или неинформативного материала); диагноз или описание цитологической картины (если невозможна постановка конкретного диагноза); время и дату проведенного исследования; должности, фамилии и подписи сотрудников лаборатории, участвовавших в проведении данного исследования.
- принятие решения о необходимости проведения анализа на наличие ДНК онкогенных типов ВПЧ;
- проведение анализа на наличие ДНК онкогенных типов ВПЧ;
- проведение систематического контроля качества исследований в установленном порядке.
В рамках проведения цитологического СРШМ лаборатория несет ответственность:
- за ведение документации, в том числе отчетной;
- своевременность и четкость исполнения протоколов исследований;
- соблюдение сроков проведения исследований и выдачи заключений;
- соблюдение сотрудниками норм медицинской этики и деонтологии
.
_______________
Международный кодекс медицинской этики* принят 3-ей Генеральной Ассамблеей Всемирной медицинской ассоциации, Лондон, Великобритания, октябрь 1949 г., дополнен 22-ой Всемирной медицинской ассамблеей, Сидней, Австралия, август 1968 г. и 35-ой Всемирной медицинской ассамблеей, Венеция, Италия, октябрь 1983 г.
Медицинской деонтологией называется учение о должном поведении медицинских работников, способствующем созданию наиболее благоприятной обстановки для выздоровления больного. Для замены понятия "врачебная этика" хирург Н.Н.Петров в 1944 г. ввел в русский язык термин "медицинская деонтология" (др.-греч.
![]() - должное, надлежащее;
- должное, надлежащее; ![]() - учение), распространив ее принципы на деятельность медицинских сестер.
- учение), распространив ее принципы на деятельность медицинских сестер.
Медицинская деонтология включает в себя:
- вопросы соблюдения врачебной тайны;
- меры ответственности за жизнь и здоровье больных;
- проблемы взаимоотношений в медицинском сообществе;
- проблемы взаимоотношений с больными и их родственниками;
- правила относительно интимных связей между врачом и пациентом, разработанные Комитетом по этическим и правовым вопросам при Американской медицинской ассоциации.
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
7.1.3 Руководитель лаборатории имеет право требовать от вышестоящих и курирующих организаций содействия в осуществлении действий и мероприятий, производимых и проводимых в рамках СРШМ.
7.2 Прием материала в лаборатории
7.2.1 Осуществляется непосредственно после его доставки.
7.2.2 Сотрудник, отвечающий за этот раздел работ, должен проверить соответствие представленного материала записи о нем в сопровождающем документе.
7.2.3 Лаборатория может отказаться от приема материала в случае, если:
- отсутствует или не оформлена надлежащим образом сопровождающая документация;
- не маркирован материал;
- констатируется нарушение сохранности [целостности, герметичности (в случае, если доставляется жидкость)] упаковки или предметного стекла;
- очевидно нарушение условий сбора, хранения и/или транспортирования.
7.2.4 Отказ в приеме материала с указанием причины фиксируется в отдельном журнале и заверяется подписями обеих сторон.
7.2.5 Регистрация осуществляется в ЛИМС или, при отсутствии ИС, в бумажном журнале регистрации материала.
7.3 Пробоподготовка
7.3.1 Традиционно приготовленные препараты окрашиваются аппаратом для автоматической окраски с четким соблюдением протокола окрашивания, прописанного для используемых реактивов.
Надлежит использовать один из следующих методов окрашивания:
- по-Паппенгейму;
- по-Лейшману;
- по-Романовскому;
- по-Папаниколау.
7.3.2 В случае использования метода ЖЦ препараты окрашиваются по протоколу, установленному производителем для используемого оборудования. Следует обратить внимание на перечень требований к используемому оборудованию и реагентам для ЖЦ в рамках СРШМ (см. приложение А).
7.3.3 Для цитологического скрининга рака шейки матки методом ЖЦ не могут быть использованы цитоцентрифуги, потому что:
- они не могут быть отнесены к оборудованию для автоматизированного скрининга РШМ;
- не обеспечивают необходимую при скрининге и ожидаемую от метода ЖЦ автоматизацию и стандартизацию на всех этапах пробоподготовки;
- при пробоподготовке с использованием цитоцентрифуг огромное значение на всех этапах имеет человеческий фактор;
- пропускная способность цитоцентрифуг крайне недостаточна.
Следовательно, использование цитоцентрифуг при массовых исследованиях на предмет ранней диагностики РШМ не оправдано и нецелесообразно.
7.4 Оценка результатов
Подготовленные соответствующим образом препараты с направлением на исследование передаются сотрудникам, осуществляющим просмотр и оценку материала.
Медицинской персонал, осуществляющий диагностику по цитологическим препаратам, должен быть предварительно подготовлен и обучен диагностированию по препаратам, окрашенным по используемой в лаборатории методике.
7.4.1 Цитологические препараты, приготовленные классическим способом, могут оценивать в рамках программы скрининга прошедшие специальную подготовку фельдшера-лаборанты, цитотехники или цитотехнологи (лабораторные техники или лабораторные технологи) под руководством цитопатолога, ответственного за результаты цитологических исследований. В случае отсутствия подготовленных надлежащим образом цитологов-лаборантов вся работа, связанная с микроскопией цитологических препаратов, выполняется цитопатологом.
7.4.2 Сотрудник (из числа среднего медицинского персонала) допускается к работе по оценке цитологических препаратов только по распоряжению руководителя лаборатории после того, как допуск его будет одобрен цитопатологом, ответственным за данную сферу работ.
7.4.3 Сотрудник (из числа среднего медицинского персонала) перед допуском к просмотру препаратов должен пройти подготовку (не менее 60 академических часов теоретических и практических занятий суммарно) и сдать соответствующий экзамен, включающий практическую часть.
7.4.4 Чтобы поддерживать квалификацию и избегать переутомления, сотрудник (из числа среднего медицинского персонала) должен проводить за микроскопом не более 5 ч в день и просматривать не менее 3000 препаратов в год.
7.4.5 Уровень знаний и навыков сотрудника цитологической лаборатории (из числа среднего медицинского персонала) должен позволять ему на основе полученной информации о пациентке, касающейся ее возраста, фазы менструального цикла и прочих предоставленных данных, уверенно предполагать:
- какую микроскопическую картину можно увидеть, если пациентка здорова;
- знать признаки неопухолевых патологических процессов;
- дифференцировать микрофлору;
- уверенно различать неопухолевую и опухолевую патологии;
- уверенно знать и узнавать в препарате признаки поражения ВПЧ и других часто встречающихся и имеющих характерные признаки поражений;
- знать и четко различать изменения в эпителии шейки матки и цервикального канала в зависимости от возраста пациентки.
7.4.6 Все препараты, которые "не укладываются" в понятие "без патологических изменений" или вызывают сомнения, должны быть переданы врачу-цитопатологу для оценки и диагностики. При этом на предметное стекло должны быть нанесены метки, акцентирующие внимание на вызвавших затруднения или подозрение участках препаратов.
Сроки хранения препаратов с выявленной онкопатологией (дисплазии II-III, рак) должны составлять не менее 10 лет (для лабораторий учреждений неонкологического профиля, не менее 25 лет для учреждений онкологического профиля. Сроки хранения препаратов без патологии (для контроля качества) - не менее 10 рабочих дней.
_______________
Для архивирования препаратов на предметных стеклах в цитологических лабораториях должны быть выделены запирающиеся помещения, обеспеченные достаточным количеством стеллажей (для хранения препаратов в ящиках) или специальных архивных шкафов. Сортировка препаратов в архиве - по датам регистрации материала в лаборатории. Порядок доступа в помещение архива, список сотрудников, которым этот доступ разрешен, а также порядок хранения, учета, выдачи (при наличии письменного запроса), уничтожения по истечении сроков хранения оговаривается в письменном распоряжении зав. лабораторией. При наличии в лаборатории надежно запирающихся металлических архивных шкафов возможно их размещение на территории лаборатории вне отдельно запирающихся помещений.
7.5 Качество исследования
7.5.1 Основные методы контроля качества
7.5.1.1 Периодический быстрый просмотр всех препаратов, в которых не найдено патологических изменений за выбранный период времени.
7.5.1.2 Тщательное изучение 10% случайно отобранных препаратов, в которых не было выявлено изменений.
7.5.2 Проверку периодически проводит другой лаборант цитологической лаборатории под контролем цитопатолога и, реже, но обязательно - цитопатолог.
7.5.3 При автоматизированном скрининге с использованием метода ЖЦ (LBC) нагрузка на сотрудников из числа среднего медицинского персонала сокращается, и, следовательно, требуется меньшее количество привлеченных к процессу специалистов из числа среднего медицинского персонала. Объем исследований, нуждающихся в контроле качества на доврачебном этапе, также существенно сокращается за счет автоматизации процесса доврачебной оценки препаратов.
_______________
В 2007 г. в British Medical Journal, было отмечено что использование ThinPrep с компьютерным анализом изображений приводит к значительному увеличению случаев выявления дисплазии ШМ по сравнению с традиционным методом. Вывод был сделан на основании результатов, полученных при большом, хорошо продуманном, независимом исследовании.
В 2007 г. д-р Гарриет Смит, старший онкогинеколог из Университета Нью-Мексико, представил данные эпидемиологов американского Национального института рака, показывающие, что с 1996 г. наблюдается ускоренное снижение показателей заболеваемости плоскоклеточным раком шейки матки. Снижение было обусловлено, скорее всего, широким использованием LBC в США.
Примечание - Оснащенность и укомплектованность цитологической лаборатории квалифицированными кадрами должна позволять исследовать не менее 15000 препаратов ежегодно.
7.5.4 Весь материал, вызывающий сомнения у специалиста среднего звена, осуществляющего исследование на первом (доврачебном) этапе, и/или не укладывающийся в понятие "цитологическая картина в пределах нормы" либо "цитологическая картина в пределах возрастной нормы", поступает к цитопатологу для оценки и диагностики с маркировкой вызвавших затруднения или подозрения участков препаратов.
7.5.5 Контроль качества должен проводиться во всех лабораториях.
7.5.6 В рамках программы скрининга должен быть организован Национальный центр обеспечения качества СРШМ, который представлен следующими структурами и специалистами:
1) руководитель Национального центра обеспечения качества СРШМ;
2) группа ведущих специалистов для контроля, координации, аудита на каждом этапе деятельности в рамках программы СРШМ; контроля над выполнением соответствующих стандартов в рамках программы СРШМ; участия в программах внешней оценки качества;
3) административная структура, обеспечивающая:
- координацию профессиональной деятельности,
- сбор и обработку статистических сведений,
- связь с вышестоящими и другими организациями,
- разработку учебных программ в области поддержки и подготовки специалистов по обсуждаемой тематике в каждой лаборатории и в соответствующих учреждениях, осуществляющих обучение и подготовку специалистов,
- взаимодействие с региональными онкологическими службами для выявления и аудита случаев инвазивного рака шейки матки с целью оценки эффективности программы скрининга,
- мониторинг и контроль исполнения стандартов обеспечения качества;
- определение уровня профессиональной подготовленности сотрудников, принимающих участие в проведении скрининга и определение потребностей в обучении и повышении их профессиональной подготовленности,
- координационные функции, для управления деятельностью координационных структур всех регионов,
4) координационные региональные группы, обеспечивающие координацию профессиональной деятельности, сбор и обработку статистических сведений, связь с вышестоящими и другими организациями, взаимодействие с региональными онкологическими службами для выявления и аудита случаев инвазивного рака шейки матки с целью оценки эффективности программы скрининга, мониторинга и контроля качества, определение уровня профессиональной подготовленности сотрудников, принимающих участие в проведении скрининга, и определение потребностей в обучении и повышении их профессиональной подготовленности.
7.6 Формирование заключения
7.6.1 После оценки препаратов сотрудник, осуществлявший исследование, должен сформулировать заключение, содержащее информацию:
- о качестве препарата, его информативности;
- количестве оцениваемых (описываемых) препаратов;
- причине, по которой препарат оценен исследователем как неинформативный или малоинформативный (если таковой имеется). При оценке материала, полученного из цервикального канала, необходимо учитывать наличие или отсутствие компонента зоны трансформации, а также любые другие показатели, такие, например, как количество элементов воспаления и т.д.;
Примечание - При указании причины неинформативности или малоинформативности материала, можно использовать формулировки: "материал неинформативен" или "материал малоинформативен"; "препарат(ы) непригоден для исследования" (указать причину); "препарат(ы) обработан и исследован, но непригоден для оценки из-за …." (указать причину).
- собственно диагноз с указанием кода по МКБ-10 или описание препарата при невозможности выставления однозначного диагноза с указанием причины, по которой исследователь счел невозможным указать точный диагноз;
- конкретизированные рекомендации по проведению дополнительных исследований или по повторному получению материала, если это необходимо для установления диагноза, с четкими указаниями и/или претензиями.
7.6.2 Заключение должно быть оформлено разборчиво, с заполнением всех граф и содержать информацию:
- о лаборатории, в которой проводилось исследование;
- о методе исследования;
- об использованных методиках пробоподготовки;
- о должности исследователя;
- ФИО исследователя;
- дате исследования и ФИО выдавшего заключение.
7.6.3 При наличии полноценно функционирующей ЛИМС в лаборатории формирование заполненного заключения проводится автоматически после "подписания" исследователем внесенной в ИС информации.
7.7 Исследование на наличие дезоксирибонуклеиновой кислоты онкогенных типов вируса папилломы человека
7.7.1 Если при цитологическом исследовании материала, полученного с шейки матки, выявлены патологические изменения, этот материал необходимо исследовать на наличие ДНК онкогенных типов ВПЧ.
ВОЗ рекомендует проведение исследования цитологического материала на наличие ДНК онкогенных типов ВПЧ, если в ходе цитологического исследования были выявлены патологические изменения в шейке матки.
7.7.2 Исследование ДНК онкогенных типов ВПЧ должен проводить обученный персонал в медицинских учреждениях при условии наличия соответствующим образом оснащенной (см. приложение А) и обеспеченной кадрами лаборатории и надежного транспортирования материала для исследования.
7.7.3 Целесообразно располагать лабораторию, проводящую выявление ДНК ВПЧ молекулярными методами (ПЦР, метод гибридного захвата), в составе цитологической (морфологической) лаборатории.
7.7.4 Лаборатория, работающая с выделением и анализом ДНК ВПЧ, должна придерживаться правил [2] с учетом специфики используемых методов, оборудования и реагентов.
7.7.5 Исследование на наличие ДНК онкогенных типов ВПЧ в самостоятельном виде в рамках скрининга не проводится.
7.7.6 Исследование на ДНК онкогенных типов ВПЧ надлежит использовать в комбинации с цитологическим исследованием материала с шейки матки для повышения чувствительности CРШМ с целью уточнения диагноза или для отбора пациенток со спорными результатами цитологического исследования и направления их на дополнительные методы обследования (например, на кольпоскопию).
7.7.7 Основным показанием к исследованию ДНК является выявление неклассифицируемых атипичных клеток плоского эпителия (ASCUS). При их выявлении кольпоскопия и биопсия шейки матки показаны только тем женщинам, у которых обнаружены онкогенные типы ВПЧ, что статистически значимо уменьшает число проводимых кольпоскопий.
7.7.8 Забор биоматериала для исследования на наличие ДНК онкогенных типов ВПЧ может проводиться одновременно с забором цитологического материала.
7.7.9 Если забор материала для цитологического исследования осуществляется с помощью цитощеток с последующим нанесением на предметное стекло, то после приготовления цитологического препарата головку цитощетки необходимо поместить в емкость с герметичной крышкой, содержащей 1 мл транспортного раствора (см. приложение Е), отломить (без применения ножниц), оставить в пробирке, которую герметично закрыть, промаркировать и отправить в лабораторию одновременно с материалом на предметном стекле.
7.7.10 При применении метода ЖЦ - использовать жидкость с клеточной взвесью из виалы, оставшуюся после приготовления цитологических препаратов.
7.7.11 В качестве источника материала для выявления ДНК онкогенных типов ВПЧ могут быть использованы цитологические препараты (материал на предметном стекле), фиксированные и окрашенные по любой из стандартных методик.
7.7.12 При наличии выбора (если имеется несколько идентичных препаратов) следует отдавать предпочтение препаратам, содержащим большее количество эпителиальных клеток.
7.7.13 Покровное стекло или пленку (при наличии таковых) перед передачей материала в ПЦР-лабораторию следует удалить. Каждое стекло должно быть промаркировано и помещено в отдельную одноразовую упаковку (фольга, крафт-бумага, полиэтиленовый пакет).
_______________
Для этого препарат замачивают в ксилоле до полного отделения пленки или покровного стекла (обычно это занимает до 48 ч). Затем на 5 мин стекла с препаратом погружают в свежий ксилол для удаления остатков клеящего вещества, после чего стекла погружают на 5 мин в 95%-ный этанол для удаления ксилола. Далее стекла следует высушить на воздухе. Работы с ксилолом должны проводиться под вытяжкой.
7.7.14 В лаборатории должен проводиться текущий контроль качества с использованием контрольных образцов и внутренний контроль тест-системами для выявления ДНК онкогенных типов ВПЧ. В дополнение к этому лаборатория должна ежегодно проходить внешний контроль качества, участвуя в одной из программ внешнего контроля качества, с выявлением в присланных в рамках данной программы образцах ДНК ВПЧ генотипов: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59.
7.7.15 Скорость отправки результатов в медицинское учреждение - важный элемент качества работы лабораторной службы и качества оказания медицинской помощи. Порядок отправки заключений из лаборатории в ЛПУ также прописывается в приказе о прикреплении ЛПУ к лаборатории.
Приложение А
(рекомендуемое)
Требования к оборудованию и реактивам, используемым для проведения скрининга рака шейки матки, в том числе автоматизированного
А.1 Общие требования
А.1.1 На все аппаратные средства, принадлежности, реагенты и расходные материалы комплекса для изготовления и окраски цитологических препаратов должны иметься регистрационные удостоверения Федеральной службы по надзору в сфере здравоохранения и социального развития.
А.1.2 К оборудованию в обязательном порядке должна прилагаться инструкция на русском языке и подробное руководство пользователя.
А.1.3 Все компоненты оборудования (системы) должны быть приобретены у одного производителя либо производитель/поставщик должен предоставить официальные сведения о совместимости с оборудованием других фирм.
А.2 Приготовление и окрашивание препаратов при проведении цитологических исследований
А.2.1 Технология взятия и доставки биологического материала должна предоставлять возможность переноса на предметное стекло без потерь всего биологического материала, взятого у пациентки.
А.2.2 Срок годности консервирующей жидкости для гинекологического материала при хранении при комнатной температуре (от 15°C до 30°C) должен составлять не менее 32 мес со дня изготовления.
А.2.3 Производитель должен гарантировать срок хранения флакона с клеточным материалом при комнатной температуре не менее двух недель.
А.2.4 Оборудование должно предоставлять возможность получить готовый препарат как без содержания эритроцитов и слизи, так и с сохранением исходного их количества в препарате.
А.2.5 Транспортная жидкость или консервант, используемый для сохранения материала при транспортировании, не должен препятствовать проведению других видов исследования (ИЦХ, ПЦР и прочих).
А.2.6 При наличии в составе консерванта (транспортной жидкости) веществ, влияющих на выбор тактики при проведении дополнительных исследований, производитель или поставщик должны в письменном виде предоставить информацию, касающуюся этого вопроса, самостоятельно или по запросу пользователя.
А.2.7 Технология приготовления и окраски клеточного материала должна быть управляемой и допускать изменения в случае необходимости для подготовки препаратов из различного материала, в том числе негинекологического, жидкостей и прочего.
А.2.8 Оборудование должно обеспечивать возможность:
- управления объемом клеточной суспензии;
- управления объемом переносимого на предметное стекло клеточного материала;
- одновременного приготовления серии идентичных препаратов из одного материала в количестве не менее чем 12 шт. (от 1 до 12);
- внесения изменения в ход работы и протоколы;
- обработки материала, не исключающей дальнейшее использования препарата как для традиционного цитологического скрининга, так и для автоматизированного;
- использования оставшегося после приготовления препаратов клеточного материала в других видах исследований;
- приготовления нативных (неокрашенных) монослойных препаратов не менее 90 шт. в час;
- приготовления окрашенных монослойных препаратов не менее 40 шт. в час.
А.3 Автоматизированная оценка изображения
А.3.1 Оборудование должно обеспечивать возможность:
- применения в скрининговом исследовании на РШМ препаратов, окрашенных по одной из стандартизованных методик, для обнаружения опухолевых и предшествующих им состояний с использованием не менее 100 критериев анализа объектов;
- анализа не менее 250 препаратов в течение рабочего дня непрерывного режима работы с возможностью загрузки новых препаратов без остановки прибора;
- не менее 6 ч непрерывной работы;
отмечать в препарате значимые для уточнения диагноза поля зрения и сортировать их по степени атипии;
- предоставления данных, получаемых в ходе обработки микропрепарата, которые включают в себя: идентификационные данные микропрепарата, показатели качества, показатели сортировки образца, данные системы отсчета микропрепарата, состояние процесса обработки для каждого препарата;
- передачи этих данных по локальной сети.
А.3.2 Производитель оборудования для автоматизированного анализа изображения должен обеспечить наличие блока хранения информации с программным обеспечением. Сервер для хранения информации должен включать:
- системный блок со встроенным программным обеспечением;
- базу данных для хранения результатов обработки микропрепаратов.
А.3.3 К работе на данном оборудовании должны допускаться сотрудники, назначенные руководителем лаборатории, или лицом его замещающим, или ответственным за проведения этих работ, прошедшие соответствующее обучение у производителя или его представителя.
А.4 Выявление ДНК ВПЧ онкогенного риска
А.4.1 Оборудование должно обеспечивать возможность:
- проводить количественную интерпретацию вирусной нагрузки в биоматериале (количество геномных эквивалентов вирусов ВПЧ) в пересчете на 100000 клеток;
- выводить информацию о количестве ДНК ВПЧ в биоматериале в виде чисел с целью последующей интерпретации результатов анализа специалистом лаборатории или выдавать готовое заключение, основанное на программной обработке полученных количественных данных по клинически обоснованному алгоритму (в случае "закрытых" систем).
А.4.2 Метод и используемые для выявления ВПЧ реагенты должны соответствовать следующим критериям:
- подходить для количественного выявления ДНК ВПЧ следующих генотипов: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59;
- информация по уровню ДНК ВПЧ генотипов 16 и 18 должна анализироваться отдельно (не в сумме с другими генотипами, отдельно 16 и отдельно 18);
- каждый набор реагентов должен включать положительный, отрицательный и внутренний контроль;
- внутренним контролем должен являться стабильный фрагмент человеческой ДНК (например, фрагмент гена b-глобина), что позволяет валидировать не только правильность анализа, но и пробоподготовки и правильности сбора биоматериала.
Приложение Б
(рекомендуемое)
Требования к расходным материалам для забора биоматериала на выявление дезоксирибонуклеиновой кислоты вируса папилломы человека и правила работы с ними
Б.1 Общие положения
Б.1.1 Осуществлять взятие клинического материала, строго следуя инструкции, только стерильными одноразовыми инструментами в стерильные одноразовые флаконы, пробирки, контейнеры. Работать в одноразовых перчатках.
Б.1.2 Взятие клинического материала должно производиться в пробирки с транспортной средой, предоставляемой фирмой - производителем наборов реагентов (в случаях, где использование транспортной среды является необходимым). Недопустимо использование транспортной среды других фирм-производителей.
Б.1.3 Сразу после взятия плотно закрывать пробирки и флаконы с клиническим материалом, не касаясь их внутренней поверхности и внутренней поверхности крышек.
Б.1.4 При переносе клинического материала из пробирок и флаконов в новые использовать только отдельные одноразовые стерильные наконечники с аэрозольными барьерами.
Б.1.5 При работе с клиническим материалом, открывая пробирки и флаконы, не производить резких движений и не допускать разбрызгивания и расплескивания, что может привести к контаминации проб и рабочих поверхностей.
Б.1.6 Строго соблюдать правила хранения и транспортирования клинических проб. Охлаждающие элементы перед транспортированием клинического материала замораживать до необходимой температуры.
Б.1.7 Использовать расходные материалы (пластиковые пробирки и наконечники) только с маркировкой "DNase-, RNase-free".
Б.1.8 Недопустимо использование многоразовых ножниц для обрезания рабочей части цитощетки - это может привести к перекрестной контаминации клиническим материалом и, как следствие, получению ложноположительных результатов.
Б.1.9 Перед проведением процедуры экстракции нуклеиновых кислот транспортную среду с биоматериалом тщательно перемешивают на вортексе для растворения слизи и осаждают капли материала со стенок пробирки и внутренней части крышки центрифугированием (1500-3000 об/мин в течение 5 с), после чего аккуратно перемешивают содержимое пробирки с помощью пипетирования.
Б.1.10 Допускается лишь однократное замораживание и оттаивание материала.
Б.2 Требования к транспортной среде, применяемой в процессе забора, транспортирования и хранения биоматериала, предназначенного для выявления ДНК ВПЧ
Б.2.1 Жидкая транспортная среда должна храниться в герметичных пробирках объемом 1,5-2 мл (в таком виде их может поставлять производитель или среда может быть разлита в стерильные пробирки в условиях ламинарного шкафа II класса биологической защиты с использованием стерильных инструментов и расходных материалов).
Б.2.2 Срок хранения и условия хранения транспортной среды определяются производителем.
Б.2.3 Транспортная среда не должна содержать примесей, ингибирующих ПЦР, примесей с ДНК-азной и РНК-азной активностью.
Б.2.4 Транспортная среда должна содержать муколитик для растворения слизи, которая может встречаться в забранном биоматериале.
Б.2.5 Транспортная среда должна обеспечивать хранение биоматериала при следующих условиях и сроках: при комнатной температуре 18°C-25°C - в течение не менее 20 сут; при температуре 2°C-8°C - не менее 2 мес; при температуре -20°C и ниже - до одного года.
Б.2.6 Транспортная среда может содержать нетоксичный и не влияющий на процедуру выделения ДНК индикатор кислотности (например, феноловый красный) с целью улучшения визуальной оценки состояния транспортной среды.
Б.3 Перечень расходных материалов, требующихся для получения и предварительной обработки биоматериала
Б.3.1 Одноразовые полипропиленовые микроцентрифужные пробирки с завинчивающимися или плотно закрывающимися крышками объемом 1,5 мл.
Б.3.2 Цитощетка цервикальная.
Б.3.3 Одноразовые наконечники для пипеток переменного объема с аэрозольным барьером до 100 и до 1000 мкл.
Б.3.4 Емкость с дезинфицирующим раствором.
Приложение В
(рекомендуемое)
Форма регистрационного журнала
В.1 Журнал регистрации материала, поступающего в цитологическую лабораторию, и проведенных исследований
В.1.1 Обязательные поля
Обязательными полями в регистрационном журнале являются:
- дата поступления материала;
- номер исследования.
Примечание - Указывают в диапазоне в зависимости от количества препаратов. Далее ставится знак "/" (например, для пяти препаратов, поступивших 1 января 2002 г. первыми, номер будет 1-5/02, следующие два препарата 6-7/02).
- первично/повторно;
- отделение (учреждение), приславшее материал;
- N истории болезни или ID;
- лечащий врач (ФИО, тел);
- ФИО больного (полностью);
- пол;
- дата рождения;
- диагноз (при направлении на цитологическое исследование), код по МКБ-10;
- важнейшие клинические данные;
- метод получения материала;
- откуда получен материал;
- характер материала;
- объем и макроскопическое описание биологического материала, маркировка препаратов;
- дата взятия биологического материала;
- ФИО врача, направившего материал;
- дата проведения исследования;
- результат цитологического исследования N;
- ФИО врача, проводившего исследование.
Журнал должен быть прошнурован, пронумерован и скреплен печатью.
Приложение Г
(рекомендуемое)
Оценка информативности материала
Г.1 Общая информация
Г.1.1 Информативность препаратов - это соответствие требованиям к необходимому количеству визуализируемых сохранных клеток для надежной оценки при цитологическом исследовании.
Г.1.2 От информативности зависит скорость выявления патологических изменений, чувствительность, специфичность и точность исследования.
_______________
В США, где практикующие цитологи имеют большой опыт LBC и используется система терминологии Bethesda, принято за минимум 5000 хорошо сохранившихся и хорошо визуализирущихся клеток плоского эпителия для приготовления препарата методом ЖЦ.
Г.1.3 Минимальные требования к количеству сохранных и хорошо визуализирущихся клеток плоского эпителия, при использовании метода ЖЦ, со временем могут быть изменены в сторону снижения.
Г.1.4 В некоторых случаях и скудного образца может быть достаточно для того, чтобы выявить и диагностировать патологию, но его может быть недостаточно для того, чтобы получить надежный результат ВПЧ-ВР.
Г.1.5 Скудные образцы, в которых цитологически не выявлена патология, не должны направляться на ВПЧ-исследование.
Г.2 Информативность материала
Г.2.1 Неинформативный материал (код результата 1)
Образец должен считаться неинформативным, если:
- материал был взят ненадлежащим образом;
- отсутствует маркировка или она не соответствует информации в сопровождающей документации;
- нарушены правила оформления, транспортирования и/или доставки материала (см. разделы 5, 6).
Материал не может быть представлен как неинформативный, если он содержит какие-либо доказательства наличия пограничных изменений или дисплазии.
Г.2.2 Малоинформативный материал (код результата 1')
Образец должен считаться малоинформативным, если:
- препарат содержит менее 200 четко визуализируемых эпителиальных клеток;
- содержит крайне малое количество клеток, однако в имеющемся материале присутствуют все же какие-либо доказательства наличия пограничных изменений или дисплазии либо, несмотря на малое количество материала, у исследователя возникает предположение о наличии опухоли.
Г.3 Отрицательный результат (код результата 2)
Г.3.1 Адекватные препараты без каких-либо аномальных клеток классифицируются как отрицательные.
Г.3.2 Образцы могут быть представлены в качестве отрицательных, если они классифицируются как "без дальнейшего рассмотрения" после сканирования (при автоматизированном скрининге).
Приложение Д
(рекомендуемое)
Порядок исследования препарата и основные принципы построения заключения
Д.1 Традиционная (классическая) цитология или ЖЦ (при отсутствии автоматизированного скрининга)
Перед просмотром препарата сотрудник из числа среднего медицинского персонала, допущенный к скринингу:
1 тщательно изучает направление на исследование, сопровождающее этот препарат;
2 сопоставляет ожидаемую (при отсутствии патологии у пациентки указанного возраста, с указанной фазой менструального цикла или продолжительностью менопаузы) цитологическую картину с реально существующей.
Д.2 При отсутствии данных о наличии онкопатологии, предопухолевого процесса или изменений, вызывающих затруднения в их трактовке, сотрудник, производивший исследование, должен сформировать заключение.
Д.2.1 Все информативные препараты, которые не укладываются в понятие "в пределах нормы" (или "возрастная норма"), после тщательного изучения уполномоченным сотрудником (из числа среднего медицинского персонала) и определения наличия изменений эпителия передаются для изучения и формирования заключения цитологу (цитопатологу). При этом на препараты должны быть нанесены метки, акцентирующие внимание на вызвавших затруднения или подозрение участках препаратов.
_______________
Метки на препараты наносятся на тыльную сторону предметного стекла (противоположную поверхности, на которой находится сам биоматериал).
Приложение Е
(рекомендуемое)
Порядок получения материала для цитологического исследования при использовании различных методов и подготовка материала к отправке
Е.1 Метод жидкостной цитологии
Для получения материала используются одноразовые цитощетки. Порядок и описание процесса получения материала описан в таблице Е.1.
Таблица Е.1 - Порядок получения материала для цитологического исследования при использовании метода ЖЦ и подготовка материала к отправке
N этапа | Описание процесса | Графическое отображение процесса |
1 | Вставить центральную часть щеточки в канал шейки матки достаточно глубоко, чтобы обеспечить более коротким щетинкам полный контакт со слизистой эндоцервикса. |
|
2 | Промыть тщательно щетки (шпатель) в виале и оставить в емкости, отломив у основания. |
|
3 | Затянуть крышку до упора. |
|
4 | Записать идентификационные данные пациентки на виале, информацию о направлении материала на исследование в медицинской карте, заполнить бланк направления на цитологическое направление. |
|
Е.2 Традиционный (классический) метод
При использовании метода классической цитологии материал после получения помещается на предметное стекло путем нанесения и равномерного распределения (размазывания) биологического материала вдоль стекла, избегая чрезмерного механического воздействия, чтобы не раздавить клетки (см. рисунки Е.1-Е.3). Одновременно с этим необходимо стремиться к получению тонкого монослоя.
Материал с шейки матки и материал из цервикального канала помещаются на разные стекла, маркируемые соответственно нанесенному материалу.
Препараты подсушиваются в течение нескольких минут на открытом воздухе (при использовании методов окраски по-Паппенгейму, по-Лейшману и подобных) и могут транспортироваться в лабораторию.
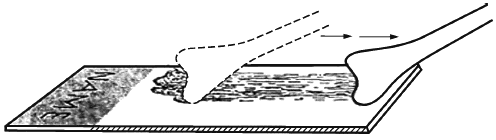
Рисунок Е.1 - Нанесение материала на предметное стекло шпателем Эйра при приготовлении препарата традиционным способом
Примечание - Для переноса материала наносите препарат аналогично движению кисти при рисовании, используя обе стороны метелки.
Рисунок Е.2 - Нанесение материала из цервикального канала на предметное стекло цитощеткой при приготовлении препарата традиционным способом
Рисунок Е.3 - Нанесение материала из цервикального канала на предметное стекло комбинированной щеткой при приготовлении препарата традиционным способом
При использовании метода окраски по-Папаниколау препараты требуют немедленной фиксации (см. рисунок Е.4).
Рисунок Е.4 - Фиксация
Для адекватной оценки препарата необходимо системно произвести просмотр всего клеточного материала (см. рисунок Е.5).
Рисунок Е.5 - Маршрут движения препарата под объективом микроскопа исследователя
Приложение Ж
(справочное)
Сравнение различных классификаций поражений эпителия шейки матки
Таблица Ж.1 - Сравнение различных классификаций поражений эпителия шейки матки
Морфологическая классификация | Цитологическая классификация | ||
Морфологическая оценка | Система CIN | Папаниколау | Бетесда (1991) |
Норма. Изменения отсутствуют | Норма | Класс I | Негатив |
Незначительные клеточные изменения | Незначительные клеточные изменения | Класс II | Доброкачественные клеточные изменения, воспаление, признаки различных инфекций, радиационные изменения, реактивные, репаративные |
Плоскоклеточная атипия + полиморфные изменения (воспаления, инфекции и т.п.) | Плоскоклеточная атипия + полиморфные изменения (воспаления, инфекции и т.п.) | Класс II | ASCUS (АПНЗ) + полиморфные изменения |
Папилломавирусные изменения (койлоцитоз) | Папилломавирусные изменения (койлоцитоз) | Класс II | LSIL (Н-ПИП) |
Слабая дисплазия | CIN I | Класс III | LSIL (Н-ПИП) |
Дисплазия средней степени | CIN II | Класс III | HSIL (Н-ПИП) |
Дисплазия высокой степени | CIN III | Класс III | HSIL (Н-ПИП) |
Карцинома in situ (CIS) | CIN III | Класс IV | HSIL (Н-ПИП) |
Инвазивный РШМ | Инвазивный РШМ | Класс V | Инвазивный РШМ |
Атипия клеток железистого эндоцервикального эпителия | Атипия клеток железистого эпителия | - | Атипия клеток железистого эпителия эндоцервикального эпителия (AGUS) |
Аденокарцинома | Аденокарцинома | Аденокарцинома | Аденокарцинома |
Примечание - CIN (cervical intraepithelial neoplasia) - цервикальная интраэпителиальная неоплазия; ASCUS (atypical squamous cell of undetermined significance) - АПНЗ (атипия плоскоклеточная неопределенной значимости); LSIL (low-grade squamous intraepithelial lesions) - Н-ПИП (плоскоклеточное интраэпителиальное поражение низкой степени выраженности); HSIL (high-grade squamous intraepithelial lesions) - В-ПИП (плоскоклеточное интраэпителиальное поражение высокой степени выраженности). | |||
Библиография
[1] | ВОЗ: Комплексная борьба с раком шейки матки. Краткое практическое руководство | |
[2] | МУ 1.3.2569-09 | "Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности" |
УДК 616-006-072/-079:618.146(083.74) | ОКС 03.040, | |
11.040.01, | ||
11.100.01 | ||
Ключевые слова: диагностика в онкологии, скрининг рака шейки матки, шейка матки, цервикальный канал, жидкостная цитология | ||
Электронный текст документа
и сверен по:
, 2016