ГОСТ ISO 17593-2011
Группа Р20
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КЛИНИЧЕСКИЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ И ИЗДЕЛИЯ МЕДИЦИНСКИЕ ![]()
Требования к системам мониторинга in vitro для самотестирования при пероральной терапии антикоагулянтами
Clinical laboratory testing and in vitro medical devices. Requirements for ![]() monitoring systems for self-testing of oral anticoagulant therapy
monitoring systems for self-testing of oral anticoagulant therapy
МКС 11.100.20
Дата введения 2013-01-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении" (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 40-2011 от 29 ноября 2011 г.)
За принятие проголосовали:
Краткое наименование страны | Код страны | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Кыргызстан | KG | Кыргызстандарт |
Российская Федерация | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. N 1383-ст межгосударственный стандарт ГОСТ ISO 17593-2011 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2013 г.
5 Настоящий стандарт идентичен международному стандарту ISO 17593:2007* Clinical laboratory testing and in vitro medical devices - Requirements for in vitro monitoring systems for self-testing of oral anticoagulant therapy (Клинические лабораторные исследования и изделия медицинские in vitro. Требования к системам мониторинга in vitro для самотестирования при пероральной терапии антикоагулянтами).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Степень соответствия - идентичная (IDT).
Стандарт подготовлен на основе применения ГОСТ Р ИСО 17593-2009.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом указателе "Национальные стандарты".
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе "Национальные стандарты"
Введение
Системы мониторинга пероральной терапии антикоагулянтами представляют собой медицинские изделия для диагностики in vitro, измеряющие протромбиновое время в пробах свежей, неизмененной крови человека. Протромбиновое время является индикатором способности крови свертываться. Медицинские изделия для диагностики in vitro дня самотестирования при пероральной терапии антикоагулянтами используются преимущественно людьми, у которых заменены сердечные клапаны, или пациентами, страдающими мерцанием предсердий или тромбозом глубоких вен. Пациенты должны поддерживать уровень антикоагулянта в крови достаточно высоким, чтобы снизить образование тромбина, и в то же время достаточно низким, чтобы избежать чрезмерного кровотечения. Система мониторинга перероральной терапии антикоагулянтами позволяет пользователю контролировать терапию антикоагулянтами и принимать меры, чтобы управлять уровнем антикоагулянта, присутствующего в крови.
Настоящий стандарт применяется к системам мониторинга пероральной терапии антикоагулянтами, которые используются непрофессионалами. Первичные цели состоят в том, чтобы установить требования к системам мониторинга пероральной терапии антикоагулянтами, которые позволят пользователям-непрофессионалам достичь приемлемого качества исследований, и определить процедуры для изготовителей и других заинтересованных сторон, которые позволят продемонстрировать соответствие таких систем требованиям настоящего стандарта.
Критерии качества работы для систем мониторинга пероральной терапии антикоагулянтами были установлены на основе достигнутого в настоящее время уровня, который предоставляет существенную пользу и удобства пациентам [68], [69]. Критерии представлены в терминах "точности системы", потому что метрологическая терминология, обычно применяемая в стандартах (например, правильность и неопределенность измерения), не была бы понятна пользователям-непрофессионалам. Точность системы, на которую влияют систематическое смещение и случайные эффекты (обратно пропорциональные неопределенности измерения), описывает степень близости индивидуальных результатов, полученных системой мониторинга пероральной терапии антикоагулянтами, точным значениям международного нормализованного отношения (MHO) при применении системы непрофессионалами.
При установлении критериев работы предполагается, что пользователи будут должным образом отобраны и получат необходимое обучение, что устройство будет должным образом обслуживаться и что методики исследования и контроля будут выполнены в соответствии с инструкциями по применению, разработанными изготовителем. Предполагается также, что изготовители будут предусматривать эффекты возможного неправильного применения, включая возможные отклонения пользователя от рекомендованного обслуживания, методик исследования и контроля.
Требования, которые являются уникальными для самотестирования с помощью систем мониторинга пероральной терапии антикоагулянтами, включая определенный объем информации, поставляемой изготовителем, представлены в настоящем стандарте. Общие требования, которые относятся ко всем медицинским изделиям для диагностики in vitro и содержатся в других стандартах (например, IEC 61010, ISO 13485, ISO 14971 и ISO 18113), указаны ссылками там, где это необходимо. Кроме того, могут применяться соответствующие национальные правила и инструкции.
1 Область применения
Настоящий стандарт устанавливает требования к измерительным системам in vitro для самоконтроля лечения антагонистами витамина К, включая рабочие характеристики, обеспечение качества и обучение пользователей и методики верификации и валидации качества выполнения предполагаемыми пользователями при фактических и моделируемых условиях использования.
Настоящий стандарт относится исключительно к системам измерения протромбинового времени, используемым людьми для контроля самостоятельного лечения антагонистами витамина К и представляющим результаты как международное нормализованное отношение (MHO).
Настоящий стандарт применим к изготовителям таких систем и к другим организациям (например, регулирующие органы и организации, оценивающие соответствие), ответственным за оценку работы данных систем.*
_______________
* В Российской Федерации - в соответствии со статьями 1 и 11 Федерального закона N 102-ФЗ "Об обеспечении единства измерений".
Действие настоящего стандарта не распространяется на:
- измерительные системы in vitro для характеристик свертывания крови, оценивающих терапию антагонистами витамина К, используемые врачами или другими работниками здравоохранения;
- всестороннюю оценку всех возможных факторов, которые могут повлиять на работу данных систем или
- медицинские аспекты пероральной терапии антикоагулянтами.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты и другие нормативные документы*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 13485:2003 Medical devices - Quality management systems - Requirements for regulatory purposes (Изделия медицинские. Системы менеджмента качества. Системные требования в целях регулирования)
ISO 14971:2000 Medical devices. Application of risk management to medical devices (Изделия медицинские. Применение менеджмента риска к медицинским изделиям)
ISO 15198:2004 Clinical laboratory medicine - In vitro diagnostic medical devices - Validation of user quality control procedures by the manufacturer (Клиническая лабораторная медицина. Изделия медицинские для диагностики in vitro. Подтверждение методик контроля качества, рекомендуемых изготовителями пользователям)
ISO 17511:2003 In vitro diagnostic medical devices - Measurement of quantities in biological samples - Metrological traceability of values assigned to calibrators and control materials (Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам)
ISO 18113-1 In vitro diagnostic medical devices - Information supplied by the manufacturer (labelling) - Part 1: Terms, definitions and general requirements (Клинические лабораторные исследования и диагностические медицинские системы in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 1. Термины, определения и общие требования)
ISO 18113-4 In vitro diagnostic medical devices - Information supplied by the manufacturer (labelling) - Part 4: in vitro diagnostic reagents for self-testing Клинические лабораторные исследования и диагностические медицинские системы in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 4. Диагностические реактивы in vitro дня самотестирования)
ISO 18113-5 In vitro diagnostic medical devices - Information supplied by the manufacturer (labelling) - Part 5: in vitro diagnostic instruments for self-testing (Клинические лабораторные исследования и диагностические медицинские системы in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 5. Диагностические инструменты in vitro дня самотестирования)
IEC 61000-4-2 Electromagnetic compatibility (EMC) - Part 4: Testing and measurement techniques - Section 2: Electrostatic discharge immunity test (Электромагнитная совместимость. Часть 4. Методики испытаний и измерений. Раздел 2. Испытание на невосприимчивость к электростатическому разряду)
IEC 61000-4-3 Electromagnetic compatibility (EMC) - Part 4: Testing and measurement techniques - Section 3: Radiated, radio-frequency, electromagnetic field immunity test (Электромагнитная совместимость. Часть 4-3. Методики испытаний и измерений. Испытание на устойчивость к воздействию электромагнитного поля с излучением на радиочастотах)
IEC 61010-1:2001 Safety requirements for electrical equipment for measurement, control, and laboratory use. Part 1. General requirements (Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 1. Общие требования)
IEC 61010-2-101:2002 Safety requirements for electrical equipment for measurement, control and laboratory use. Part 2-101. Particular requirements for in vitro diagnostic (IVD) medical equipment (Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 2-101. Частные требования к медицинской аппаратуре для диагностики in vitro (IVD))
IEC 61326 Electrical equipment for measurement, control and laboratory use. EMC requirements (Электрооборудование для измерения, управления и лабораторного использования. Требования к электромагнитной совместимости)
EN 13532:2002 General requirements for in vitro diagnostic medical devices for self-testing (Общие требования к медицинским изделиям для диагностики in vitro для самоконтроля)
EN 13612 Performance evaluation of in vitro diagnostic medical devices (Оценка эксплуатационных характеристик медицинских диагностических устройств in vitro)
EN 13640 Stability testing of in vitro diagnostic reagent (Оценка стабильности реактивов для диагностики in vitro)
Технические отчеты ВОЗ, номер 889, 1999, Приложение 3 - Руководящие принципы для тромбопластинов и плазмы, используемых для контроля пероральной терапии антикоагулянтами
3 Термины и определения
В настоящем стандарте применены термины по ISO 18113-1, а также следующие термины с соответствующими определениями:
3.1 точность измерения (accuracy of measurement): Степень близости между результатом измерения и принятым опорным значением.
Примечания
1 Термин "точность измерения", когда он относится к ряду результатов исследований, охватывает комбинацию случайных компонентов и общую систематическую ошибку или компонент смещения [1].
2 Для систем мониторинга пероральной терапии антикоагулянтами точность измеряется степенью соответствия результатов измерений образцов крови от различных пациентов значениям MHO, прослеживаемым до Международного референтного препарата тромбопластина.
3 Адаптировано из [2, пункт 3.11].
3.2 смещение измерения (bias of measurement): Различие между ожиданием результатов теста и принятым опорным значением.
[3, пункт 3.8]
Примечание - Смещение - мера правильности [1].
3.3 кровь (blood): Циркулирующая внутри сосудов ткань организма, состоящая из жидкой плазмы и взвешенных форменных элементов.
Примечание - В настоящем стандарте термин относится к свежей крови без антикоагулянтов.
3.4 проба капиллярной крови (capillary blood sample): Кровь, собранная после прокола мелких сосудов, которые соединяют артериолы и венулы.
Примечание - Капиллярная кровь, полученная путем прокола кончика пальца, обычно собирается без добавок типа антикоагулянтов или консервантов. Поэтому проба нестабильна.
3.5 контрольный материал (control material): Вещество, материал или изделие, предназначенные изготовителем для проверки рабочих характеристик медицинского изделия для диагностики in vitro.
Примечания
1 Адаптировано из [4, пункт 3.5].
2 Контрольные материалы для мониторирования действия антикоагулянтов могут быть реактивными или нереактивными. Реактивный контрольный материал участвует в реакции с компонентами реактивов. Нереактивный контроль не реагирует с компонентами реактивов, но способен обеспечить контроль функциональных возможностей через другие средства, например моделирование реакции (см. физический контроль).
3.6 контрольный интервал (control interval): Статистически оправданные значения, определенные как приемлемые значения измерения, полученные с использованием данного контрольного материала.
3.7 медицинский работник (healthcare provider): Человек, уполномоченный оказывать медицинскую помощь пациенту.
Примечание - В настоящем стандарте работник здравоохранения - человек (доктор, медсестра, техник, технический специалист или соответствующий помощник), который инструктирует пациента относительно самотестирования.
3.8 интегрированный функциональный контроль (integrated functional control): Контрольный материал, который является составным компонентом реактива измерительной системы, предназначенным изготовителем для верификации рабочих характеристик измерительной системы.
Примечание - Интегрированный функциональный контроль исследуют одновременно с измерением пробы пациента, он включает в себя реактивный компонент и обеспечивает функциональную проверку методики измерения. Результаты интегрированного контроля должны быть в пределах предопределенного интервала измерения для измеренного значения.
3.9 международное нормализованное отношение; MHO (international normalized ratio, INR): Результат измерения протромбинового времени пациента, который был стандартизирован по свойствам тромбопластина, используемого в методике измерения, выражен относительно нормального популяционного среднего значения.
Примечание - Для обсуждения использования MHO - см. [5].
3.10 международный референтный препарат (international reference preparation, IRP): Референтный калибратор, поддержанный Всемирной организацией здравоохранения.
Примечание - Международный референтный препарат тромбопластина непосредственно калиброван по своей активности против оригинальных британских сравнительных препаратов тромбопластина, используемых при установлении системы MHO.
3.11 промежуточная прецизионность измерения (intermediate precision of measurement): Прецизионность измерения при промежуточных условиях между условиями воспроизводимости и условиями повторяемости.
Примечания
1 Концепция промежуточных уровней прецизионности описана в [6].
2 Количественные меры промежуточной прецизионности зависят от предусмотренных условий.
3 Промежуточная прецизионность указывает на вариабельность, которая будет испытана пользователем в условиях типичного использования.
3.12 условия промежуточной прецизионности (intermediate precision conditions): Условия, при которых независимые результаты измерения получены одним и тем же методом измерения на идентичных образцах в одном и том же месте, но где другие переменные - операторы, оборудование, калибровка, условия внешней среды и/или временные интервалы отличаются.
3.13 международный индекс чувствительности, МИЧ (international sensitivity index, ISI): Фактор, который позволяет преобразование результата измерения протромбинового времени пациента в значения международного нормализованного отношения.
Примечание - Для обсуждения использования МИЧ и MHO см. [5].
3.14 непрофессионал (lay person): Человек без формального обучения в соответствующей области или дисциплине.
Примечания
1 Адаптировано из определения в [7].
2 В настоящем стандарте непрофессионал - это пользователь устройства для мониторинга пероральной терапии антикоагулянтами, который не имеет специальных медицинских, научных или технических знаний, связанных с мониторингом пероральной терапии антикоагулянтами.
3.15 рабочий калибратор изготовителя (manufacturer's working calibrator, working measurement standard): Стандартный образец, который используется обычно в лаборатории изготовителя для калибровки или проверки материальных мер, измерительных приборов или референтных материалов.
Примечания
1 Адаптировано из ISO 17511.
2 Это применимо к препарату тромбопластина, используемому изготовителем при подготовке смеси реактивов для определения протромбинового времени.
3 Приписанное значение рабочего калибратора изготовителя, метрологически прослеживаемое до международного референтного препарата.
3.16 выбранная изготовителем методика измерения (manufacturer's selected measurement procedure): Методика измерения, которая откалибрована одним или несколькими первичными или вторичными калибраторами и подтверждена для предполагаемого применения.
Примечание - ISO 17511, 4.2.2, перечисление f), указывает выбранную изготовителем методику измерения в цепи прослеживаемости.
3.17 постоянная процедура измерения изготовителя (manufacturer's standing measurement procedure): Методика измерения, которая откалибрована одним или несколькими рабочими калибраторами изготовителя или калибратором более высокого уровня и подтверждена для ее предполагаемого применения.
Примечание - ISO 17511, 4.2.2, перечисление f), указывает постоянную методику измерения изготовителем в цепи прослеживаемости.
3.18 методика измерения (measurement procedure): Совокупность операций, определенно описанных и охарактеризованных, используемых при выполнении специфических измерений в соответствии с данным методом.
[1, определение 2.5]
3.19 интервал измерения (measuring interval): Совокупность значений измеряемой величины, для которой смещение и непрецизионность предполагаются находящимися в указанных пределах.
Примечания
1 Представляет интервал результатов исследования, в котором рабочие характеристики были подтверждены изготовителем.
2 Адаптировано из [1, определение 5.4].
3.20 метрологическая прослеживаемость (metrological traceability): Свойство результата измерения или значения эталона, заключающееся в возможности установления его связи с соответствующими эталонами, обычно международными или национальными, посредством непрерывной цепи сличений, имеющих установленные неопределенности.
[1, определение 6.10]
3.21 физический контроль системы (physical control system): Контрольное устройство, которое не содержит химически реактивные компоненты и предназначено изготовителем для проверки работы инструмента.
Примечания
1 Физический контроль системы может быть в форме электронного устройства, которое обеспечивает моделируемую реакцию.
2 Результат физического контроля должен быть в предопределенных пределах, чтобы система измерения рассматривалась как функционирующая должным образом.
3.22 прецизионность измерения (precision of measurement): Степень близости между независимыми результатами измерений, полученными в оговоренных условиях.
Примечания
1 Адаптировано из [2].
2 Степень прецизионности выражена в цифровой форме статистическими мерами непрецизионности измерения среднеквадратичным отклонением и коэффициентом вариации, которые обратно пропорционально связаны с прецизионностью. Количественные меры прецизионности зависят от предусмотренных условий.
3 Прецизионность данной методики измерения подразделяется согласно указанным условиям прецизионности. Специфические совокупности крайних условий называют "повторяемостью" (3.26) и "воспроизводимостью" (3.28).
3.23 протромбиновое время (prothrombin time): Время, требуемое для образования сгустка в образце крови после контакта с материалом тромбопластинового реактива.
3.24 система для измерения протромбинового времени (prothrombin time measuring system): Измерительная система, которая регистрирует время, необходимое для образования сгустка в образце крови при воздействии тромбопластина или реагента тканевого фактора.
Примечание - Система включает в себя реактив и инструмент, используемые для регистрации времени образования сгустка.
3.25 реагент (reagent): Часть медицинского изделия для диагностики in vitro, которая, осуществляя химическую или электрохимическую реакцию, вызывает сигнал, который позволяет обнаружить величину и измерить ее значение в образце.
3.26 повторяемость измерения (repeatability of measurement): Прецизионность измерения при условиях повторяемости.
Примечание - Адаптировано из [2].
3.27 условия повторяемости (repeatability conditions): Условия, при которых независимые результаты измерения получены одним и тем же методом измерения на идентичных образцах, в одной и той же лаборатории, тем же оператором, использующим то же оборудование в пределах коротких интервалов времени.
Примечания
1 Адаптировано из [2].
2 Практически неизменные условия, приводящие к минимальной вариабельности результатов измерения.
3 В настоящем стандарте, "лаборатории" должны интерпретироваться как "местоположения".
3.28 воспроизводимость измерения (reproducibility of measurement): Прецизионность измерения при условиях воспроизводимости.
Примечание - Адаптировано из [2].
3.29 условия воспроизводимости (reproducibility conditions): Условия, при которых результаты измерения получены одним и тем же методом измерения на идентичных образцах, в разных лабораториях, разными операторами, использующими различное оборудование.
Примечания
1 Полностью измененное условие предназначено, чтобы представить условия, приводящие к максимальной вариабельности результатов теста.
2 В целях настоящего стандарта, "лаборатории" должны интерпретироваться как "местоположения".
3 Адаптировано из [2].
3.30 вторичная референтная методика измерения (secondary reference measurement procedure): Методика измерения, которая откалибрована одним или несколькими первичными калибраторами.
Примечание - Методику для измерения протромбинового времени иногда называют "вторичная стандартная методика".
3.31 точность системы (system accuracy): Степень близости репрезентативных результатов измерения, полученных измерительной системой, к принятым опорным значениям.
Примечания
1 Термин "точность измерения" по отношению к ряду результатов измерения охватывает комбинацию компонентов случайной погрешности и общей систематической ошибки или компонент смещения.
2 Референтные значения приписаны в соответствии с методикой измерения, прослеживаемой до референтной методики измерения более высокого порядка.
3 Точность системы может быть выражена как интервал, который охватывает 95% наблюдаемых различий между результатами оцениваемой системы и их референтными значениями. Этот интервал также включает в себя неопределенность измерения методики измерения, использованной для приписывания референтных значений.
4 Адаптировано из [8, пункт 3.24].
3.32 правильность измерения (trueness of measurement): Степень близости среднего значения, полученного из большой серии результатов измерений, к принятому опорному значению.
Примечания
1 Мера правильности - смещение (3.2).
2 Адаптировано из [2].
3.33 типовое испытание (type test): Испытание одного или нескольких образцов оборудования (или частей оборудования), изготовленных по одному проекту, чтобы показать соответствие проекта и производства одному или нескольким требованиям примененного стандарта.
Примечания
1 Статистическая выборка не требуется для типового испытания.
2 Адаптировано из IEC 61326.
3.34 согласие пользователя (user compliance): Способность и готовность пользователя измерительной системы придерживаться и работать в пределах определенных спецификаций методики измерения.
3.35 образец венозной крови (venous blood sample): Кровь, собранная после прямого прокалывания вены, обычно с помощью иглы и шприца или другого устройства для сбора крови.
Примечание - Венозная кровь может быть собрана без добавок типа антикоагулянтов или консервантов, и в этом случае она будет нестабильной; венозная кровь может также быть собрана в контейнеры, содержащие добавки или консерванты для стабилизации определенных компонентов.
3.36 объемная доля эритроцитов в крови (volume fraction of erythrocytes in blood): Пропорция клеток в образце крови.
Примечания
1 Выраженная как доля, часто обозначается и как процент (обычный) из единицы СИ.
2 Иногда называют "гематокритом", по наименованию инструмента, первоначально использованного для определения объемной доли эритроцитов в крови.
4 Проектирование и развитие
4.1 Общие требования
Применяются требования, определенные в ISO 13485.
Требования, определенные в EN 13532, применяют при оценке эксплуатационных характеристик системы мониторинга in vitro пероральной терапии антикоагулянтами.
Примечание - Разделы 6 и 8 описывают действия при верификации проекта, которые предназначены для обеспечения гарантии способности продукта соответствовать характеристикам прецизионности, правильности, безопасности и надежности. Раздел 9 описывает действия при верификации проекта, которые предназначены для обеспечения гарантии соответствия устройства требованиям пользователя.
4.2 Интервал измерения
Интервал измерения системы должен быть, по крайней мере, от 1,0 до 6,0 MHO.
4.3 Безопасность
Применяют требования, определенные в IEC 61010-1 и IEC 61010-2-101.
4.4 Менеджмент риска
4.4.1 Приемлемость рисков
Изготовитель должен определить приемлемость потенциальных рисков, основываясь на знании, по меньшей мере, следующих факторов:
a) предполагаемого использования продукта;
b) навыках и ограничения пользователей;
c) защиты против неумышленного изменения параметров настройки (например, сообщаемые единицы);
d) вероятных отклонений от рекомендованного обслуживания, методик работы и контроля;
e) влияния интерферирующих веществ.
Примечание - Руководящие принципы для оценки потенциально интерферирующих веществ см. [9].
4.4.2 Оценка риска
Применяют требования, определенные в ISO 14971.
Выполняя оценку риска, изготовитель должен принять во внимание следующее:
a) серьезность последствий необнаруженного отказа (например, потенциальный вред пациенту);
b) вероятность возникновения ошибки (например, недостаточный объем пробы или неправильное размещение единицы реактива) и
c) вероятность неспособности системы обнаружить ошибку (например, дефектные внутренние датчики инструмента).
Примечания
1 Настоящий стандарт не определяет уровни приемлемости риска.
2 Руководящие принципы для того, чтобы идентифицировать потенциальные опасности от использования "единицы использования устройств", см. [10].
3 Менеджмент риска включает в себя анализ, оценку, уменьшение и контроль риска.
4.5 Аспекты эргономического и человеческого факторов
При проектировании системы мониторинга in vitro пероральной терапии антикоагулянтами должны быть учтены относящиеся к делу эргономический и человеческий факторы, включая, по меньшей мере, следующее:
a) аспекты пользователя:
- выбор,
- обучение,
- согласие;
b) окружающую среду использования:
- температуру,
- влажность;
c) свойства системы:
- устойчивость к ударам,
- стабильность реактивов;
d) интерфейс пользователя:
- удобство применения,
- удобство обслуживания,
- защиту от типичного "износа", с которым можно столкнуться в окружающей среде использования,
- удобочитаемость результатов,
- неправильные условия и ошибочные сообщения,
- однозначные сообщения пользователю (например, "низкий заряд батареи" или "низкий результат", а не только "низко"),
- проверка пользователем надлежащего функционирования системы.
4.6 Обеспечение качества и средства контроля риска
4.6.1 Общие положения
Обеспечение качества системы мониторинга пероральной терапии антикоагулянтами состоит из множества элементов. См. приложение Е для описания различных элементов обеспечения качества, которые могут быть применены.
Изготовитель должен обеспечить специфичные для устройства меры контроля риска, как этого требует план менеджмента риска. Применяют требования, определенные в ISO 14971.
Меры контроля риска, включая любые ограничения, должны быть описаны в инструкциях по применению и в программе соответствующего обучения.
Меры контроля риска должны быть учтены при образовании и обучении пользователей и работников здравоохранения (см. раздел 7), также, как следующие элементы.
4.6.2 Проверка измерения
Каждое измерение, о котором сообщает система мониторинга in vitro пероральной терапии антикоагулянтами, должно быть проверено внутри самой измерительной системы.
Характер и степень внутренней проверки, которая будет выполнена измерительной системой, должны быть определены результатами анализа риска.
Примечание - Необходимо, чтобы использование реактивов с просроченным сроком годности было предотвращено.
4.6.3 Контроль работы системы
Изготовитель должен предоставить методику контроля и инструкции по применению контрольных материалов.
Процедура контроля должна быть подтверждена. Применяют требования, определенные в ISO 15198.
Контрольный материал может состоять из жидкого контроля, интегрированного контроля или комбинации обеих форм.
Если будет использоваться физический контроль (например, контрольная полоса), то изготовитель должен предоставить инструкции по применению физического контроля на инструменте.
Перед каждым измерением образца крови проверка измерения должна быть проведена собственным контролем монитора с использованием внутреннего или внешнего физического контроля системы.
Контрольные измерения с применением жидких контрольных материалов должны быть выполнены каждый раз, когда используется новый пакет реактивов, когда получен неожиданный результат и когда этого требуют местные инструкции. Жидкие контрольные средства могут быть заменены интегрированным функциональным контролем.
Действия, которые должны быть предприняты, когда контрольные результаты находятся вне установленного диапазона, должны быть приведены в инструкциях по применению.
4.6.4 Проверка эксплуатационных характеристик при самотестировании
Изготовитель должен рекомендовать пользователям методику проверки приемлемости результатов самотестирования.
Проверка должна быть основана на сравнении результатов, полученных пользователем и работником здравоохранения в указанные интервалы. Рекомендуется интервал шесть месяцев или меньше. Для пользователей, вновь применяющих самотестирование, могут быть необходимы более частые проверки техники выполнения исследований, например ежемесячно.
4.6.5 Оценка выполнения пользователем инструкций изготовителя и врача
Изготовитель должен рекомендовать в инструкциях по применению для медицинских работников подходящие методики контроля и оценки выполнения пользователем инструкций изготовителя и врача.
4.7 Метрологическая прослеживаемость
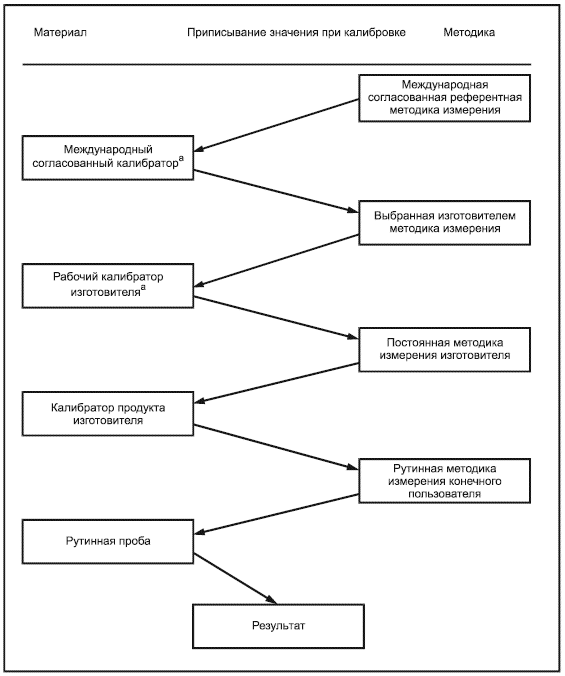
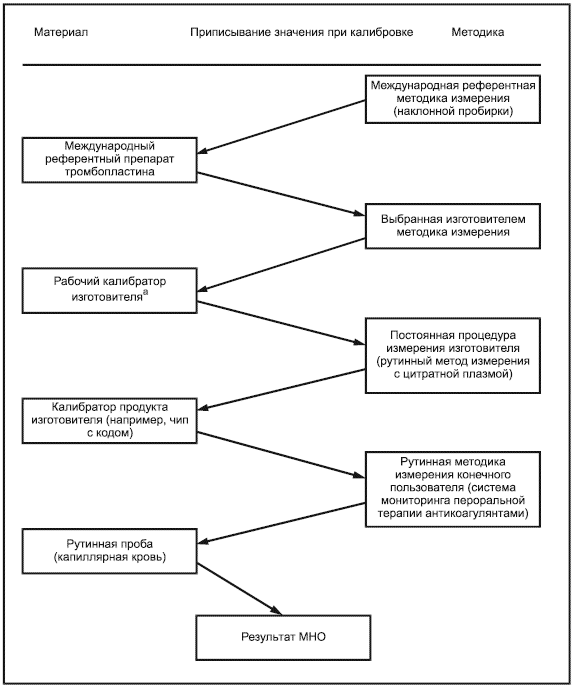
К процессу калибровки изготовителем устройств мониторинга in vitro пероральной терапии антикоагулянтами должны быть применены требования, определенные в ISO 17511.
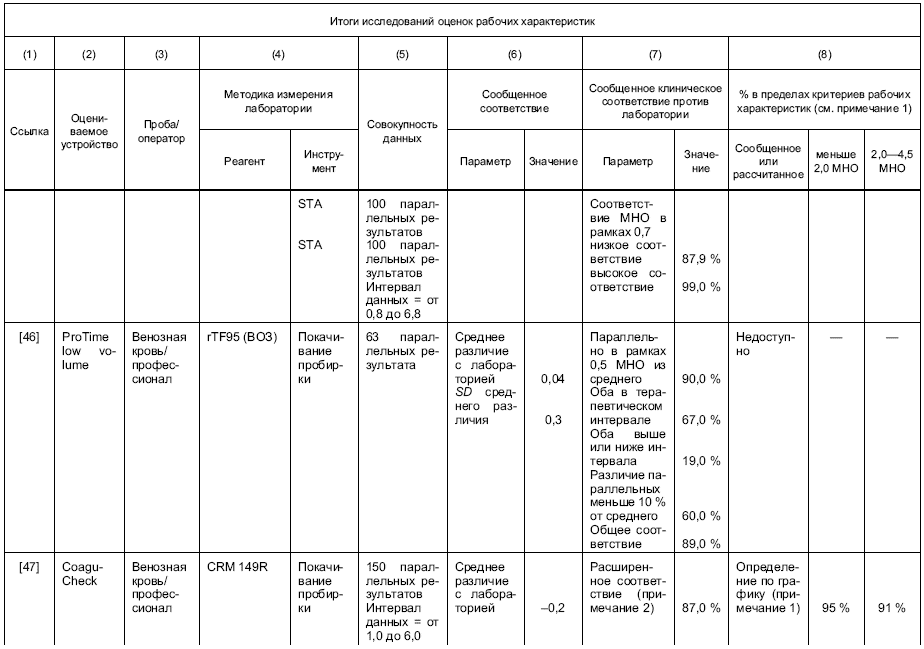
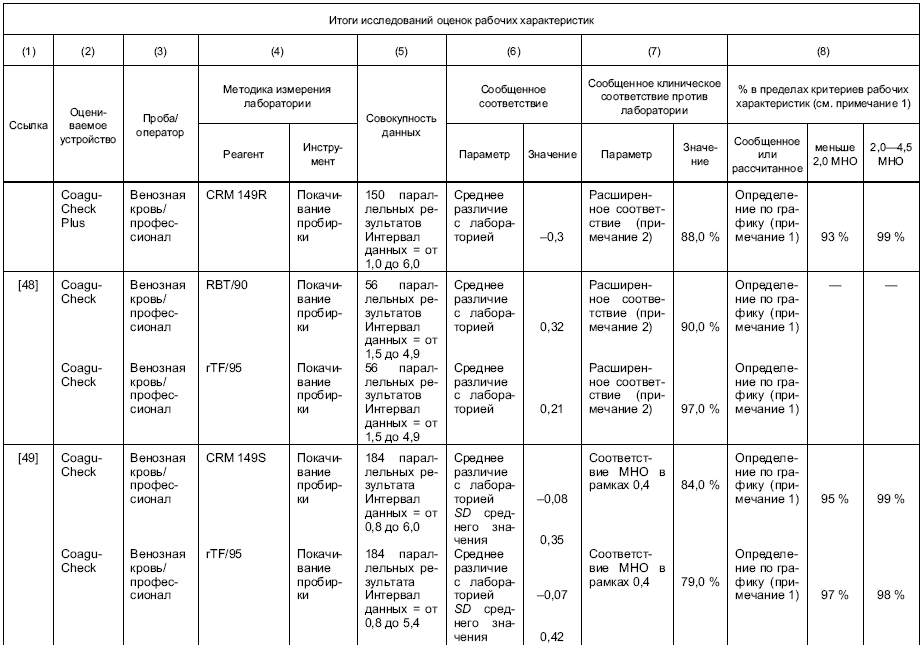
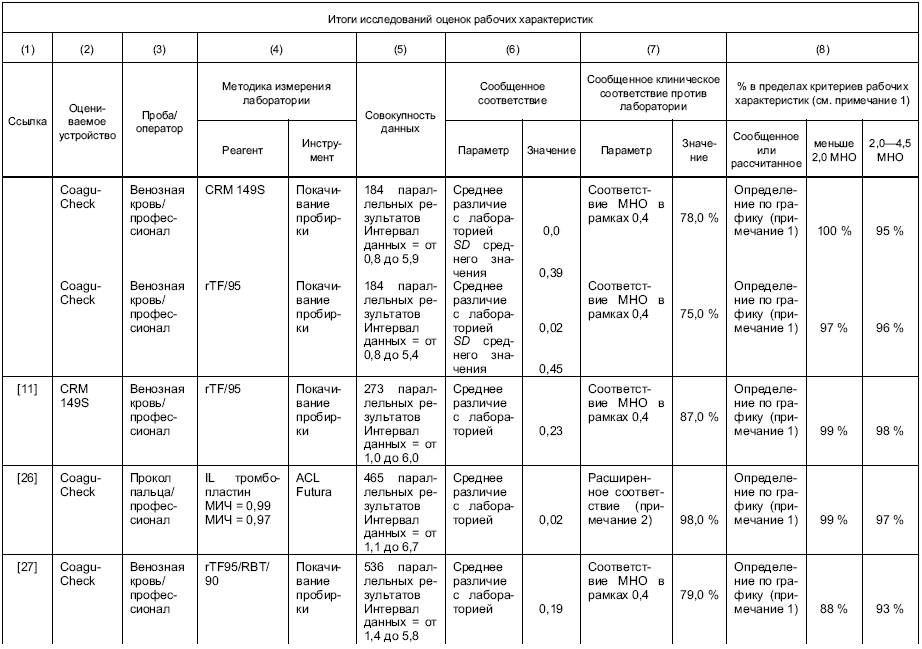
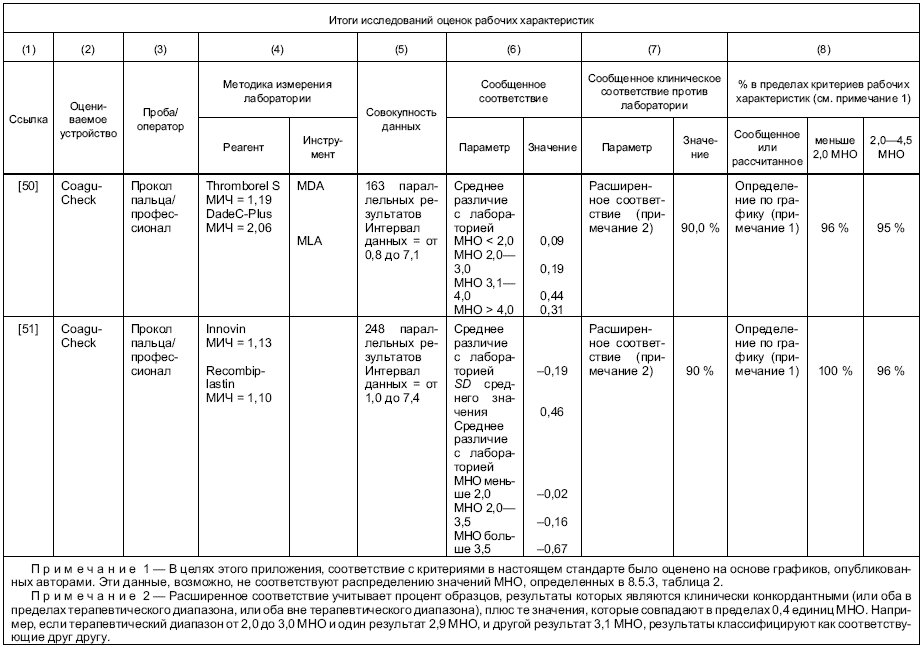
Результаты измерения отобранной и/или постоянной методики измерения изготовителя должны быть прослеживаемыми к таковым рекомендованной ВОЗ ручной методики измерения покачиванием пробирки, с использованием международного референтного препарата тромбопластина [11].
Примечание - В рекомендуемой ВОЗ ручной методике измерения покачиванием пробирки используют свежую цитратную плазму, тогда как в устройствах для самотестирования используют свежую, необработанную кровь. При калибровке устройств применяют параллельное измерение свежей плазмы и крови от одного и того же пациента. В этом случае образцы крови служат калибратором.
Если в постоянной методике измерения изготовителя используется кровь, то калибровка методики по международному референтному препарату ВОЗ и методике покачивания пробирки должна быть проведена путем параллельного измерения крови и плазмы. При калибровке рутинной методики измерения конечного пользователя должна быть использована кровь.
Если постоянная методика измерения изготовителя использует плазму, в этом случае плазма должна использоваться при калибровке методики по международному референтному препарату ВОЗ и методике покачивания пробирки. При калибровке рутинной методики измерения конечного пользователя должно проводиться параллельное измерение плазмы и крови (например, используя одну и ту же партию реактивов).
Цепь прослеживаемости должна включать в себя настолько мало шагов, насколько это практически возможно, чтобы минимизировать комбинированную стандартную неопределенность измерения.
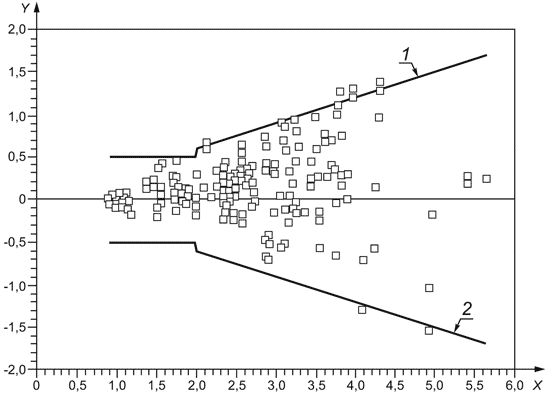
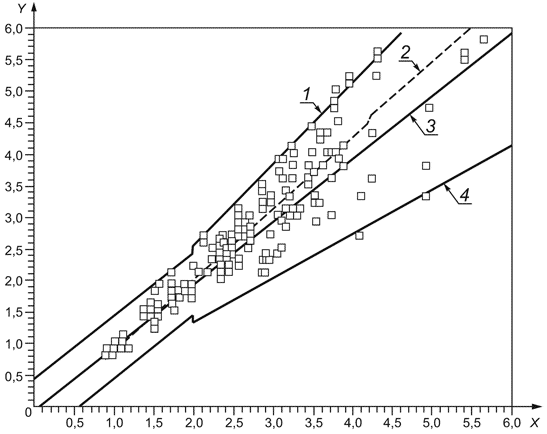
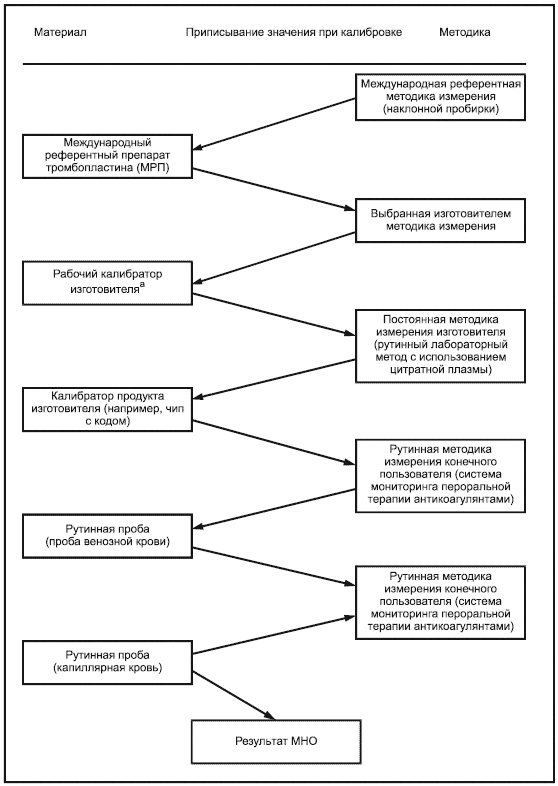
Примечание - Пример цепи прослеживаемости для типичной откалиброванной изготовителем системы мониторинга in vitro пероральной терапии антикоагулянтами показан в приложении В, рисунок В.1. Изображение полной цепи прослеживаемости взято из ISO 17511, рисунок 5. Этот пример не предназначен для представления единственно возможной подходящей цепи прослеживаемости.
Меры контроля должны быть осуществлены в пределах каждого шага процесса калибровки для отслеживания, оценки и контроля дрейфа и изменчивости.
Примечание - Индекс способности процесса (Cpk) может быть использован для определения и обнаружения недопустимого дрейфа. См. [12].
Калибровка постоянной методики измерения изготовителя должна быть проверена в предопределенных интервалах по выбранным методикам измерения изготовителя. В качестве руководства могут быть использованы [13] и [14].
Рабочий калибратор изготовителя может быть представительной панелью образцов свежей капиллярной или венозной крови, которые охватывают интервал измерения, чтобы гарантировать коммутабельность калибратора с референтной методикой измерения. Изготовители должны определить методику и период времени, в течение которого могут использоваться свежие образцы.
5 Информация, поставляемая изготовителем
5.1 Общие требования
Информация, поставляемая пользователям изготовителем, должна быть ясной и краткой, с применением простых терминов, которые понятны непрофессионалам.
Информация должна быть хорошо представленной и легко читаемой.
Там, где это целесообразно, следует применять символы и иллюстрации. Символы должны соответствовать международным стандартам. Если будут применены символы, для которых не существует стандарта, они должны быть описаны в тексте.
Должен использоваться язык(и) страны, в которой распространяется система мониторинга in vitro пероральной терапии антикоагулянтами; другие языки являются дополнительными.
Содержание инструкций по применению должно быть понятно для людей без научного или технического образования.
Инструкции по применению должны содержать номер пересмотра или год и месяц издания.
5.2 Маркировка инструмента для мониторинга in vitro* пероральной терапии антикоагулянтами
_______________
* В бумажном оригинале слова "in vitro" в наименовании пункта 5.2 выделены курсивом. - .
Инструмент для мониторинга in vitro пероральной терапии антикоагулянтами должен быть идентифицирован маркировкой, включающей, как минимум, следующую информацию:
a) наименование или торговую марку изготовителя и адрес изготовителя;
b) наименование продукта или его обозначение (эта информация должна непосредственно находиться на ярлыке, прикрепленном на устройстве);
c) предполагаемое применение, включая утверждение, что инструмент представляет собой медицинское изделие для диагностики in vitro для самотестирования, и информацию относительно реактивов, которые используются с инструментом;
d) номер партии или серии, находящийся непосредственно на ярлыке, прикрепленном на устройство;
e) условия для хранения и обработки, если предусмотрены;
f) ссылку на руководство для пользователя или инструкции по применению.
Там, где это целесообразно и разрешено правилами, информация на этикетке должна быть приведена в форме символов. Символы должны соответствовать правилам и стандартам. Все символы должны быть описаны в информации, поставляемой вместе с инструментом для мониторинга in vitro пероральной терапии антикоагулянтами.
5.3 Инструкции по применению системы для мониторинга in vitro* пероральной терапии антикоагулянтами
_______________
* В бумажном оригинале слова "in vitro" в наименовании пункта 5.3 выделены курсивом. - .
Применяют требования, определенные в ISO 18113-5.
К системе должна быть приложена инструкция по применению, включающая в себя следующую информацию:
a) наименование или торговую марку и адрес изготовителя, наименование и адрес дистрибьютора, если применимо, и способ получения помощи.
Примечание - Для медицинских устройств для диагностики in vitro, продаваемых в Европейском союзе, Директива 98/79/ЕС [15] требует наименования и адреса "авторизованного представителя", если изготовитель не расположен в Европейском союзе;
b) наименование продукта или его обозначение;
c) предполагаемое использование устройства;
d) принцип методики измерения;
e) постоянную методику измерения изготовителя и/или референтный материал, предназначенный изготовителем для оценки рабочих характеристик;
f) тип образцов, используемых изготовителем для калибровки (например, кровь или плазма);
g) определенные реактивы, которые должны использоваться;
h) методику измерения, которой должны следовать, используя устройство, включая следующее:
- последовательность подготовки инструмента к измерению, выполнения измерения (включая объем и рекомендованный вид образца) и обслуживания устройства;
- последовательность регулировки (например, использование числа, кодовой полосы, кодового чипа), измерения и проверки и допускаемые временные интервалы между ними;
- единицы измерения, о которых сообщает устройство для значения MHO (например, процент);
- совет относительно того, что делать, когда инструмент выдал ошибочные сообщения, неожиданные результаты или результаты вне указанного интервала измерений;
i) условия внешней среды (например, температуру и относительную влажность), в которых может использоваться система;
j) детальную процедуру, которой должен следовать пользователь при наладке устройства, если применимо;
k) детальные методики контроля пользователя, включая идентификацию контрольного материала, который используется для подтверждения того, что система мониторинга in vitro пероральной терапии антикоагулянтами работает должным образом, важность выполнения методики контроля, и совет относительно действий в случае, если результаты контроля неприемлемы;
I) тип образца, который используется так же, как любые специальные условия сбора и предварительной обработки;
m) меры предосторожности, которые должны быть предприняты, чтобы уменьшить риск инфекции (например, от предшествующего использования инструмента или неправильного удаления биологически опасных материалов исследований);
n) меры предосторожности, которые должны быть предприняты, чтобы предотвратить повреждение системы (например, от электростатического разряда, магнитных полей, высокой температуры, влажности, вибрации и других внешних влияний или других условий внешней среды, если применимо (см. раздел 5 в IEC 61010-2-101);
о) описание и объяснение любых символов, используемых в маркировке и в инструкциях по применению;
р) руководство относительно действий, которые должны быть предприняты пользователем как следствие результата, включая:
- ссылку на инструкции, данные медицинским работником, и предупреждение не отклоняться от этих инструкций на основе результата, без консультации с медицинским работником;
- совет относительно того, как поступать, если результат сомнителен для пользователя;
- указание того, как система мониторинга извещает пользователя о выходе результата за пределы указанного интервала измерения (например, ошибочные сообщения, уведомления об ошибке);
q) информацию относительно безопасного удаления системы и ее компонентов, при необходимости.
Инструкции для использования должны содержать рекомендации относительно действий, которые следует предпринимать, если проверка укажет неприемлемый результат.
5.4 Маркировка реактивов и контрольного материала
Реактивы и контрольный материал должны быть идентифицированы этикеткой или этикетками.
Применяют требования, определенные в ISO 18113-4.
Кроме того, на этикетку должна быть нанесена следующая информация:
a) указание периода времени, выраженного как месяцы и/или дни, в течение которого реактив должен использоваться после даты первого открытия непосредственной упаковки реактива;
b) ссылка на инструкции по применению;
c) инструмент, предназначенный для использования с реактивами.
На этикетку должно быть нанесено предупреждение о следующем:
d) использование реактивов со специфицированным устройством для мониторинга in vitro пероральной терапии антикоагулянтами для получения надежных результатов измерения;
e) безопасное удаление реактивов после их использования.
Должен использоваться язык(и) страны, в которой применяют реактивы и контрольный материал; другие языки являются дополнительными.
5.5 Инструкции по применению реактивов и контрольного материала
Реактивы и контрольный материал, использование которых предусмотрено с системой мониторинга in vitro пероральной терапии антикоагулянтами, должны сопровождаться инструкциями по применению.
Применяют требования, определенные в ISO 18113-4.
Кроме того, инструкция по применению должна включать в себя следующую информацию:
a) указание способа получения помощи от изготовителя и/или дистрибьютора;
b) инструмент, определенный для использования с реактивами и контрольным материалом;
c) международный индекс чувствительности реактива;
d) условия хранения (например, температура, влажность, воздействие света);
e) оповещение предупреждения (для реактивов) относительно необходимости плотно закрывать крышку непосредственного контейнера для защиты реактивных полосок или сенсоров от воздействия воздуха;
f) интервал измерения с указанием верхнего и нижнего пределов, в которых сообщают о результатах MHO;
g) рабочие характеристики на языке, который понятен предполагаемому пользователю; процент соответствия значений MHO, которые получают, с процедурой референтного измерения должен базироваться на исследованиях, указанных в разделах 8 и 9;
h) любые интерферирующие вещества, условия проб (например, гемолиз, желтуха, липемия) или физиологические условия (например, изменения в периферическом кровообращении), влияющие на точность результатов;
i) методику измерения, используемую для оценки рабочих характеристик системы, и описание метрологической прослеживаемости результатов измерения до референтной методики измерения или стандартного образца более высокого уровня;
j) методику измерения, которой нужно следовать, включая:
- последовательность шагов подготовки реактивов и выполнения измерения;
- выбор времени между индивидуальными шагами, если применимо;
k) детальную методику контроля и контрольный материал, которые используют для проверки того, что система мониторинга in vitro пероральной терапии антикоагулянтами работает в пределах ее установленных рабочих характеристик.
Необходимая информация относительно реактивов и/или контрольных материалов может быть включена в инструкции по применению устройства или системы, если изготовитель устройства или системы - то же самое лицо, что и изготовитель реактивов. При внесении изменений в эту информацию, измененная информация должна быть помещена в инструкцию по применению реактивов.
6 Испытание безопасности и надежности
6.1 Общие требования
6.1.1 Программа
Испытание безопасности и надежности должно быть выполнено изготовителем согласно письменной программе. В программе, по меньшей мере, должны быть определены испытания проекта, включая число инструментов, единиц реактива и повторных измерений на инструмент, и методики анализа данных, и критерии приемлемости. Результаты испытаний безопасности и надежности должны быть зарегистрированы в отчете.
Указанные требования к испытаниям являются минимальными требованиями.
Для испытаний эксплуатационных характеристик программа должна включать в себя статистическое объяснение для испытания проекта.
Примечания
1 Тесты, описанные в 6.2-6.8, являются типовыми испытаниями.
2 Тесты, описанные в 6.9-6.12, являются испытаниями рабочих характеристик.
6.1.2 Инструменты и реактивы
Инструменты и реактивы, отобранные для испытания, должны представлять собой единицы изделий массового производства.
Для типовых тестов в каждом тесте должны использоваться, по крайней мере, три инструмента.
Для тестов рабочих характеристик в каждом тесте должны использоваться, по крайней мере, десять инструментов.
6.1.3 Критерии приемлемости
Критерии приемлемости для смещения и повторяемости для испытаний рабочих характеристик в 6.10-6.13 должны быть выведены из критерия точности системы в 8.6.1. Объяснение для критериев приемлемости должно быть зарегистрировано в протоколе.
Система мониторинга in vitro пероральной терапии антикоагулянтами должна или удовлетворять критериям приемлемости в каждой программе испытаний, или должна быть признана нефункционирующей и не должна показывать числовой результат MHO.
Отказы удовлетворять критериям приемлемости должны быть исследованы.
6.2 Защита от удара током
Применяют требования, определенные в IEC 61010-1, раздел 6.
6.3 Защита от механических опасностей
Применяют требования, определенные в IEC 61010-1, раздел 6.
6.4 Электромагнитная совместимость
Применяют требования, определенные в IEC 61326. Кроме того, применяют требования, определенные в приложении А.
6.5 Тепловая резистентность
Применяют требования, определенные в IEC 61010-1, раздел 10.
6.6 Сопротивление влажности и жидкостям
Применяют требования, определенные в IEC 61010-1, подразделы 11.1, 11.2 и 11.3.
6.7 Защита от выделившихся газов, взрыва и имплозии
Применяют требования, определенные в IEC 61010-1, пункты 13.1 и 13.2.2.
6.8 Компоненты устройства
Применяют требования, определенные в IEC 61010-1, подразделы 14.1, 14.4, 14.5 и 14.6.
6.9 Испытание рабочих характеристик
Испытание рабочих характеристик должно быть выполнено перед и после каждого определения механического сопротивления удару, вибрации и внедрению (см. 6.10) и защиты против воздействия температуры и влажности (см. 6.11 и 6.12). Решения о соответствии/несоответствии критериям должны быть основаны на влиянии факторов на смещение и повторяемость системы.
Вне каждого испытания рабочих характеристик инструмент для мониторинга in vitro пероральной терапии антикоагулянтами должен быть уравновешен при температуре (23±2) °С. Рекомендованный изготовителем контрольный материал или подходящая альтернатива должны быть использованы для испытания рабочих характеристик.
Может оказаться трудно отделить изменчивость, обусловленную свойствами образца и компонентов реактивов, от изменчивости, связанной со свойствами компонентов инструмента. Это должно быть учтено при проектировании теста и разработке критериев приемлемости.
Контрольная полоса, которая моделирует полосу реактива после реакции, или другой подходящий контрольный материал могут быть использованы для подтверждения того, что рабочие характеристики системы не изменены.
Примечание - Электронные системы контроля могут сообщать результаты в единицах (например, в милливольтах), отличающихся от тех, которые сообщают для образцов крови. В этом случае, могут использоваться среднее значение и повторяемость значений, о которых сообщает устройство.
Порядок измерения испытуемых образцов должен быть определен в программе.
Среднее значение MHO и среднеквадратичное отклонение воспроизводимости должны быть вычислены перед каждым испытанием и после него, и различия сравнены с критериями приемлемости.
a) Смещение: различие между средним значением MHO после испытания и средним значением MHO перед испытанием должно быть вычислено и сравнено с критериями приемлемости для смещения.
b) Повторяемость: квадратный корень различия между вариансой (степенью свободы) повторяемости после испытания и вариансой повторяемости перед испытанием должен быть вычислен и сравнен с критерием приемлемости для повторяемости.
6.10 Механическая устойчивость против удара, вибрации и сдавления
6.10.1 Программа теста вибрации
Выполняют тест рабочих характеристик, описанный в 6.9.
Выполняют тест вибрации, как определено в подразделе 8.3 IEC 60068-2-64.
После того, как испытание вибрации выполнено, повторить тест рабочих характеристик.
Применяют требования, определенные в подразделе 8.3 IEC 60068-2-64.
6.10.2 Программа теста падения
Для проверки устойчивости к повреждению от падения, выполняют испытание базовых рабочих характеристик, как это определено в 6.9.
Выполняют тест падения, как это определено в подразделе 8.2 IEC 61010-1.
После того, как испытание падения выполнено, повторяют испытание рабочих характеристик.
Применяют требования, определенные в подразделе 8.2 IEC 61010-1.
6.11 Пределы воздействия температуры
6.11.1 Программа высокотемпературного испытания
Выполняют тест рабочих характеристик, как это определено в 6.9.
Помещают инструмент в камеру, в которой может быть отслежена внутренняя температура.
Увеличивают температуру до (50±2) °С и оставляют инструмент при этой температуре на 8 ч в камере.
Удаляют инструмент из камеры, дают ему охладиться до температуры (23±2) °С и повторяют испытание рабочих характеристик.
Для тех систем, в которых реактивы являются составным компонентом устройства и не могут быть отделены от инструмента, условия высокотемпературного воздействия должны быть ограничены условиями применения, определенными изготовителем.
6.11.2 Программа низкотемпературного испытания
Выполняют тест рабочих характеристик, как это определено в 6.9.
Помещают инструмент в экологическую камеру, в которой может быть отслежена внутренняя температура.
Уменьшают температуру до (минус 20±2) °С и оставляют инструмент в камере при этой температуре на 8 ч.
Температура инструмента в экологической камере должна достичь (23±2) °С, чтобы избежать конденсации влаги из сырого внешнего воздуха, контактирующего с холодным инструментом. Удаляют инструмент из камеры и повторяют тест рабочих характеристик.
Для тех систем, в которых реактивы являются составным компонентом устройства и не могут быть отделены от инструмента, низкотемпературные условия воздействия должны быть ограничены условиями применения, определенными изготовителем.
6.12 Программа испытания воздействия влажностью
Выполняют испытание базовых рабочих характеристик, как это определено в 6.9.
Помещают инструменты в камеру с контролируемыми температурой и влажностью.
Стабилизируют относительную влажность (RH), не конденсируемую до (90±3)%, и температуру на уровне (32±2) °С.
Оставляют инструменты в камере на 48 ч при указанных температуре и влажности.
Перемещают инструменты из камеры в комнатные условия с относительной влажностью менее 60% и температурой (23±2) °С и оставляют на 15 мин.
Цель этого теста - оценка степени и эффектов поглощения влажности. Любая влага, поглощенная устройством во время пребывания в камере, сохраняется в нем. Температура должна достичь уровня окружающей среды в течение 15 мин, но полной балансировки не требуется.
Повторяют испытание рабочих характеристик.
6.13 Испытание хранения и использования реактивов
Условия для хранения, использования и транспортирования реактивов и контрольных материалов должны быть определены и проверены.
Стабильность реактивов и контрольных материалов в течение срока годности должна быть продемонстрирована. Применяют требования, определенные в EN 13640.
7 Программы обучения и образования
7.1 Обучение медицинских работников
Изготовитель должен разработать и подтвердить программу обучения для медицинских работников. Программа обучения должна научить медицинских работников надлежащему использованию системы, выбору пациентов и их обучению.
Программа обучения для медицинских работников должна включать в себя рекомендованные критерии выбора пациентов и описание характеристик пользователя, способных предсказать успех в использовании системы.
Прогностические характеристики должны включать в себя:
- способность понимать концепцию пероральной терапии антикоагулянтами и ее рисков;
- готовность выполнять самотестирование in vitro пероральной терапии антикоагулянтами и активно сотрудничать с медицинским работником в документации и информационном обмене для регулирования терапии;
- достаточную ловкость рук и остроту зрения и
- демонстрируемое согласие пациента.
В случаях, если пациент не отвечает критериям, программа обучения должна способствовать тому, что измерения могут быть выполнены обученными родственниками или другими третьими лицами, которые отвечают критериям выбора.
7.2 Обучение пациентов и других пользователей
Изготовитель должен разработать и предоставить программу обучения для пациентов и других пользователей устройства.
Программа должна включать в себя следующие элементы:
- основную информацию о свертывании крови и терапии антикоагулянтами;
- объяснение результатов определения протромбинового времени и MHO;
- объяснение определенного для пациента индивидуального терапевтического интервала;
- обучение проколу кожи и самотестированию in vitro протромбинового времени;
- задачи пользователей и медицинских работников в самотестировании in vitro при пероральной терапии антикоагулянтами;
- ведение записей пациентом и медицинским работником;
- описание методик контроля и внутренних контролей системы;
- акцент на надлежащей интерпретации результатов контроля;
- необходимые действия в случае, если результаты контроля вышли за целевые пределы;
- протокол для связи между пациентами и медицинскими работниками;
- необходимые действия в случае, если результаты вышли за пределы индивидуального терапевтического интервала;
- действие, необходимое в случае дополнительных болезней, критических ситуаций или несчастных случаев.
Программа образования должна обеспечить достаточные технические знания относительно общей концепции пероральной терапии антикоагулянтами и должна обучить практическим навыкам выполнения самотестирования in vitro протромбинового времени и методикам контроля.
Оценка способности пользователя должным образом выполнять самотестирование должна быть проведена по завершении программы обучения.
Оценка должна включить в себя практический тест технического мастерства и/или письменный тест понимания.
Примечание - Может быть желательной периодическая повторная оценка пользователей, чтобы оценить их соответствие требованиям и подтвердить сохранение ими компетентности.
Изготовитель должен предоставить метод документирования успешного завершения пользователем программы образования.
Примечание - Обучение может быть зарегистрировано изготовителем или медицинским работником.
8 Проверка рабочих характеристик системы
8.1 Общие положения
Исследования проверки рабочих характеристик системы должны проводиться как часть контроля проектирования системы изготовителя, чтобы продемонстрировать, что система мониторинга in vitro пероральной терапии антикоагулянтами соответствует требованиям правильности, прецизионности и точности системы.
Применяют требования, определенные в ISO 13485.
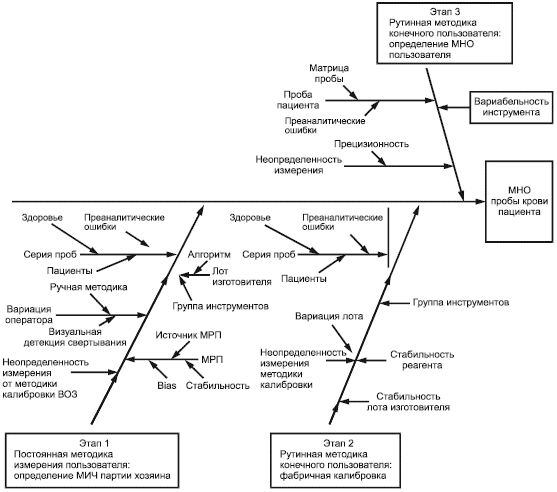
8.2 Вклады в неопределенность измерения
Факторы, которые влияют на точность (прецизионность и правильность) результатов MHO и вносят свой вклад в неопределенность измерения, должны быть идентифицированы и учтены при разработке программы проверки.
Эти факторы включают внутрииндивидуальную биологическую вариацию, неопределенность измерения приписанного значения калибратора (нехватка референтного материала более высокого уровня и ограничения референтной методики измерения, рекомендованной ВОЗ), различия фактора чувствительности, различия между партиями реактива, нестабильность реактива и непрецизионность измерения.
Примечания
1 Специфика интерферирующих веществ и эффекты изолированных дефицитов факторов коагуляции не изучаются при верификации рабочих характеристик системы.
2 Предписанная референтная методика измерения, метод ВОЗ наклонной пробирки, является трудно выполнимой, в высокой степени зависимой от навыков пользователя и действительна только для оценки MHO между 1,0 и 4,5. Попытки разработать истинный калибратор не были успешными. Референтная методика измерения и калибратор могут внести значительный вклад в увеличение неопределенности измерения протромбинового времени.
8.3 Проверка рабочих характеристик системы
Проверка рабочих характеристик системы должна быть выполнена согласно письменной программе. Программа должна, как минимум, определить детали эксперимента, методики анализа данных и критерии приемлемости. Статистические проекты, включая число инструментов, единиц реактива, параллельных проб и критерии приемлемости, должны быть обоснованы в программе. Результаты проверки рабочих характеристик должны быть зарегистрированы в отчете.
Все компоненты системы, отобранной для оценки, включая инструменты, реактивы и принадлежности, должны быть представительными для продукта, предназначенного для продажи.
Система мониторинга in vitro пероральной терапии антикоагулянтами должна быть отъюстирована до проверки, согласно инструкции изготовителя (например через кодирование, чипы). Никакое регулирование не должно проводиться между повторными измерениями, если инструкции изготовителя не определяют регулирование перед каждым измерением.
Рекомендованные изготовителем методики контроля должны быть выполнены до каждой проверки.
Уникальный характер измерения протромбинового времени, характеристики определенной системы самотестирования и нестабильность образцов должны быть приняты во внимание при разработке программы эксперимента для проверки рабочих характеристик системы.
Соответствующий образец для каждого проверочного исследования определен в 8.4 и 8.5. Альтернативный образец может быть использован, чтобы оценить определенные переменные (например, прецизионность от инструмента-к-инструменту), если нужно продемонстрировать эквивалентность свежей капиллярной крови.
Примечания
1 Хотя лица, принимающие антагонисты витамина К, являются предполагаемыми пользователями устройства, протокол требует, чтобы образцы от группы людей, не принимающих антагонисты витамина К, были включены в исследование для проверки приемлемой точности (прецизионности и правильности) по всему интервалу измерения, включая значения ниже терапевтического интервала.
2 Обучаемые операторы могут выполнить проверку рабочих характеристик системы. Непрофессионалы выполняют исследования рабочих характеристик системы, описанные в разделе 9.
8.4 Проверка прецизионности измерения
8.4.1 Общие положения
Прецизионность измерения системы мониторинга in vitro пероральной терапии антикоагулянтами, используемой для самотестирования, должна быть верифицирована в фактических или моделируемых условиях использования.
Повторяемость и промежуточная прецизионность измерения должны быть проверены по отношению к критериям рабочих характеристик, полученным из критериев точности системы по 8.5. Критерии приемлемости должны быть зарегистрированы в программе.
Дисперсионный анализ является предпочтительным статистическим методом для оценки множественных факторов. Выбор числа инструментов, партий реактива и повторных исследований для испытания прецизионности должен быть основан на источниках вариабельности, полученных из результатов дисперсионного анализа.
Примечание - Относительно общих принципов оценки прецизионности метода измерения см. [3]. Определения и понятия повторяемости, воспроизводимости и промежуточных уровней прецизионности описаны в [3], [6], [16].
Поскольку проверка прецизионности требует исходить из обычной процедуры измерения, выполнения многих измерений из одного или более образцов, данные должны быть проверены против объективных критериев валидности для выявления эффектов нестабильности проб.
Примечания
1 Только ограниченная проверка повторяемости измерения MHO может быть проведена непосредственно в течение долгого времени, для многих партий, и многими аналитиками вследствие нестабильности образцов крови. Проверка точности (см. 8.5) предназначена для включения неопределенности, вызванной этими переменными.
2 Суррогатные пробы (например, контрольные пробы), и альтернативные подходы к оценке могут быть необходимыми для оценки вклада определенных переменных. Такие оценки - существенная часть проверки проекта, но поскольку, начиная с исследования проекта, они имеют тенденцию быть специфичными для устройства, они - вне области применения настоящего стандарта.
8.4.2 Проверка повторяемости измерения
8.4.2.1 Общие положения
Повторяемость измерения должна быть оценена на основе параллельных образцов капиллярной крови. Чтобы приблизиться к условиям повторяемости, образцы должны быть взяты и измерены в пределах короткого промежутка времени.
Объяснение плана эксперимента должно быть зарегистрировано в программе.
Примечание - Руководящие принципы определения повторяемости методики измерения см. [16].
8.4.2.2 Образцы
Проверка повторяемости должна быть выполнена со свежими образцами капиллярной крови, по крайней мере, от 30 пациентов, получающих терапию антагонистами витамина К, и, по крайней мере, от 15 человек, не получающих лечения. Пациенты должны быть отобраны таким образом, чтобы значения MHO охватили весь интервал измерения системы при, по крайней мере, 15 пациентах в каждом из интервалов, определенных в таблице 1.
Таблица 1 - Интервалы MHO для проверки повторяемости измерения
Интервал | Значения MHO |
Нетерапевтический | Ниже 2,0 |
Низкий терапевтический | От 2,0 до 3,0 |
Высокий терапевтический | От 3,1 до 4,5 |
Два образца должны быть взяты от каждого пациента с помощью прокола кожи (например, из двух пальцев).
Значение MHO каждого образца должно быть определено, используя систему мониторинга in vitro пероральной терапии антикоагулянтами.
Объемная доля эритроцитов в крови (гематокрит) должна быть в пределах от 0,35 до 0,50 л/л (от 35% до 50%).
Примечание - Материалы суррогатного образца могут использоваться вместо фактических образцов пациентов, чтобы проверить высокий терапевтический интервал.
8.4.2.3 Инструменты и реактивы
Повторяемость измерения может быть проверена с использованием одного или более инструментов и одной или более партий реактива. Если используется больше, чем один инструмент или партия реактива, план эксперимента должен позволить провести анализ повторяемости в пределах единственного инструмента и/или в пределах единственной партии (например, методика дисперсионного анализа).
8.4.3 Проверка промежуточной прецизионности измерения
8.4.3.1 Общие положения
Проверка промежуточной прецизионности измерения должна проводиться в нормальных условиях использования (то есть индивидуальный пользователь в течение многих дней с одним и тем же инструментом).
Изготовители должны использовать дисперсионный анализ для определения существенных источников неопределенности измерения, чтобы включить их в испытание промежуточной прецизионности. Объяснение плана эксперимента должно быть зарегистрировано в программе. Как минимум, изготовители должны включать компоненты неопределенности "от партии к партии", "от инструмента к инструменту" и "ото дня ко дню".
Промежуточная прецизионность измерения должна быть проверена на протяжении всего интервала измерения инструмента.
Примечание - Руководящие принципы по определению промежуточной прецизионности измерения см. [6].
8.4.3.1.1 Образцы
Промежуточная прецизионность должна быть проверена с использованием контрольного материала в низком терапевтическом интервале (MHO от 2,0 до 3,0) и высоком терапевтическом интервале (МНО от 3,1 до 4,5).
Контрольные материалы должны быть подготовлены согласно инструкциям по применению изготовителя. Стабильность контрольных образцов за период проведения оценки должна быть подтверждена.
8.4.3.1.2 Инструменты и реактивы
По крайней мере, должны быть отобраны десять инструментов, чтобы проверить промежуточную прецизионность измерения системы мониторинга in vitro пероральной терапии антикоагулянтами.
Проверка может быть выполнена на единственной партии реактивов, если доступные данные демонстрируют, что промежуточная прецизионность (включая повторяемость) не зависит существенно от партии реактива. В других случаях должны использоваться множественные партии, и эксперимент должен быть разработан таким образом, чтобы включить изменчивость "от партии к партии". Число используемых партий должно быть оправдано (как минимум, быть равным трем).
Должна быть исследована партия или часть партии. Если полная партия недоступна, ее часть и статус материала должны быть зарегистрированы.
Единицы реактива должны быть взяты, по крайней мере, из десяти флаконов или пакетов. Программа проверки должна гарантировать, что данные о различных переменных (например, партии, инструмент) не перепутаны.
8.4.3.2 Процедура проверки
Минимальная схема проверки промежуточной прецизионности в течение многих дней требует одного измерения в день каждого образца в течение 10 дней для каждого из десяти инструментов.
Методика может быть изменена, чтобы использовать многие партии реактива. Единицы реактива должны быть взяты из одного и того же флакона или пакета для каждого образца.
8.4.4 Анализ данных
8.4.4.1 Валидность данных
До начала анализа данные должны быть оценены, чтобы идентифицировать ошибки и свидетельство нестабильности проб. Очевидные ошибки (например, ошибки транскрипции, недостаточный объем пробы) должны быть зарегистрированы и исправлены. Никакие данные не могут быть исключены без причины (например, по одним статистическим причинам). Нестабильность проб, выраженная в дрейфе результатов, может быть идентифицирована с помощью статистического анализа результатов параллельных проб из каждого образца. Применяют следующие руководящие принципы:
- Для данных повторяемости вычисляют предел диапазона параллельных измерений на основании всех данных. Если прецизионность связана с MHO, то предел диапазона параллельных измерений будет также зависеть от MHO, поскольку более выраженные различия между результатами параллельных измерений могут ожидаться при более высоких значениях MHO. Объяснение для этого предела основано на статистическом распределении диапазона и также зависит от прецизионности системы. Предел вычисляют следующим образом:
1) Вычисляют различие между параллельными измерениями для каждого образца.
2) Вычисляют среднее значение параллельных измерений для каждого образца.
3) Получают оценку прецизионности в пределах образца на основе различных исследований или спецификаций системы. Поскольку прецизионность обычно уменьшается с MHO, это должно быть выражено как коэффициент вариации ().
4) Для каждого образца пациента умножают среднее значение параллельных измерений на и затем на 4,2. Полученное число является пределом диапазона параллельных измерений для данного пациента.
5) Например, предполагают, что два результата для пациента - 2,4 и 2,6. Среднее значение - 2,5. Если 5% используется как оценка прецизионности в пределах пациента, тогда предел диапазона дубликатов 2,5
0,05
4,2 или 0,525. Так как фактическое различие - 0,2, стабильность проб была бы приемлемая. Если значения параллельных проб были 2,2 и 2,8, тогда среднее значение все еще будет 2,5, но это различие превысило бы предел диапазона параллельных измерений.
Примечание - Вероятность различия результатов параллельных измерений, превышающего предел диапазона параллельных измерений, составляет 99,7%, что указывает на недействительность данных из-за нестабильности проб или дрейфа [12];
- Для промежуточной прецизионности используют все данные, чтобы вычислить предел исключения данных. Этот предел основан на исследовании 10 образцов и разработан, чтобы обнаружить как высокие, так и низкие выпадающие результаты. Это значение может быть вычислено следующим образом:
1) Для каждого образца вычисляют среднее значение и стандартное отклонение () для серии из 10 образцов.
2) Также определяют минимальное и максимальное значение в серии из 10 образцов.
3) Вычисляют следующую статистику: (Максимум - Среднее значение)/Среднеквадратическое отклонение и (Среднее значение - Минимум)/Среднеквадратическое отклонение.
4) Берут большее из этих двух чисел. Это представляет возможный пункт подозреваемого результата.
5) Если результат шага 4 больше, чем 2,48, то подозреваемый результат превышает предел исключения данных.
Примечания
1 Вероятность значения данных, превышающих предел исключения данных, составляет 99% того, что их крайние значения не вызваны основной непрецизионностью системы. Их нужно рассматривать как выбросы. Они представляют случаи чрезвычайных условий работы, которые не ожидаются при нормальном использовании [17].
2 Руководящие принципы для идентификации выбросов - см. [16], [18].
При исключении данных применяют следующие требования:
- данные, определенные как статистические выбросы, не должны исключаться. Анализ данных должен быть выполнен, и результаты сообщены с включением и без включения выбросов;
- для повторяемости превышение приемлемого предела различия между параллельными измерениями указывает на нестабильность проб. Оба измерения будут считаться неверными и не должны использоваться при вычислении повторяемости;
- для промежуточной прецизионности, тенденция, превышающая приемлемый предел, указывает на нестабильность проб. Все измерения данной пробы будут считаться неверными и не должны применяться в вычислениях;
- если методическая ошибка или сбой инструмента произошли во время испытания, должно быть проведено исследование для определения причины. Исследование и его заключения должны быть зарегистрированы в отчете;
- если причина обнаружена, результат от затронутого образца будет считаться неверным и не должен быть применен в вычислениях;
- данные, отклоненные по определенной причине (например, подтвержденная ошибка аналитика), могут быть заменены новыми результатами измерения;
- если причина не может быть определена, анализ данных должен быть выполнен, и результаты сообщены с включением и без включения рассматриваемых данных.
8.4.4.2 Анализ повторяемости
Среднее арифметическое значение, среднеквадратическое отклонение и коэффициент вариации для повторяемости должны быть вычислены с применением зарегистрированных статистических процедур.
Для каждого набора образцов следует сообщать следующую информацию:
a) общее среднее арифметическое значение наблюдаемых значений MHO;
b) стандартное отклонение повторяемости с 95 % доверительным интервалом и интервалом значений (минимальное и максимальное значения) и коэффициент вариации () для каждого набора значений MHO;
c) резюме любых недействительных данных, идентифицированных и исключенных из статистического анализа, включая метод идентификации и результаты исследования;
d) ссылки на статистические методики анализа.
Примечание - Чтобы вычислить среднеквадратическое отклонение измерения или референтной системы (), необходим следующий ряд [19]:
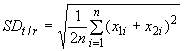 .
.
Чтобы получить доверительный интервал для или
, используют выводы из факта, что
![]() распределено как хи-квадрат со степенями свободы
распределено как хи-квадрат со степенями свободы ![]() .
.
Поэтому верхний ![]() предел доверительности (
предел доверительности () получают из следующего:
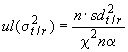 ;
;
![]() .
.
8.4.4.3 Анализ промежуточный прецизионности
Среднее значение, стандартное отклонение и коэффициент вариации для промежуточной прецизионности должны быть вычислены для каждого образца с использованием документированных статистических методик.
Дисперсионный анализ (ANOVA) - предпочтительный метод для анализа данных для промежуточной прецизионности.
Для каждого образца должна быть сообщена следующая информация:
a) общее среднее значение наблюдаемых значений MHO для каждого образца;
b) среднеквадратическое отклонение промежуточной прецизионности с 95%-ным доверительным интервалом и коэффициентом вариации () значений MHO каждого образца;
c) резюме любых недействительных данных, идентифицированных и исключенных из статистического анализа, включая метод идентификации и результаты исследования;
d) ссылки на методики статистического анализа.
8.5 Проверка точности системы
8.5.1 Общие требования
Точность системы должна быть проверена в фактических или моделируемых условиях использования.
Проверка точности системы должна включить систематические эффекты (смещение) и случайные эффекты (непрецизионность), которые были бы испытаны индивидуальным пользователем в ожидаемых условиях использования.
Примечание - Взаимоотношения между точностью, правильностью и прецизионностью рассмотрены в [3].
Методика измерения, используемая как основание для проверки точности системы, должна быть более высокого метрологического уровня, чем используемая для калибровки рутинной методики измерения конечных пользователей или, если она того же уровня, то должна быть связана с методикой ВОЗ покачивания пробирки через отдельную непрерывную цепочку.
Применяют требования, определенные в EN 13612.
8.5.2 Исследование популяции
Субъекты, зарегистрированные в исследовании, должны соответствовать критериям отбора, установленным в 7.1.
Сто восемьдесят пациентов, получающих пероральную терапию антикоагулянтами, должны быть зарегистрированы, как минимум, в трех местах исследования. В дополнение, 20 здоровых людей должны быть зарегистрированы во всех местах исследования.
Для каждого пациента должны быть зарегистрированы демографические данные, целевые MHO и показания для терапии антикоагулянтами, а для здоровых людей - демографические данные.
Значения MHO у обследованных лиц должны покрыть интервал измерения от 1,0 до 6,0 MHO при измерении постоянной методикой измерения изготовителя или альтернативной методикой измерения. Значения MHO выше 6,0 должны быть исключены.
По крайней мере, у 5% обследованных лиц (10) должны быть значения MHO между 4,6 и 6,0 (см. таблицу 2 в 8.5.3). Если необходимое число пациентов с MHO выше 4,5 не может быть получено на начальных местах исследования, может быть необходимо расширение исследования в дополнительных местах.
Должен быть зарегистрирован индивидуальный терапевтический интервал каждого пациента.
8.5.3 Образцы
Для проверки точности системы должны использоваться или образцы свежей капиллярной крови, или образцы свежей или стабилизированной венозной крови.
Для выбранной изготовителем методики измерения должна использоваться цитратная плазма.
Образцы свежей капиллярной крови должны быть собраны проколом кожи (например, кончика пальца). Каждый образец должен быть собран из отдельного прокола пальца. Должны использоваться типовые контейнеры, разработанные для сбора капиллярной крови, если это применимо.
Образцы должны быть подготовлены и обработаны согласно инструкциям по применению, включая предварительную обработку пробы, если требуется.
Каждый образец должен иметь достаточный объем для измерения и, по крайней мере, для параллельного измерения в соответствии с методикой измерения изготовителя.
Критерии исключения, типа объемной доли эритроцитов (гематокрит), должны быть основаны на инструкциях изготовителя по применению и определены в протоколе. Однако образцы с объемными долями эритроцитов от 35% до 50% должны быть включены.
Значения MHO должны быть распределены, как определено в таблице 2.
Таблица 2 - Значения MHO в образцах для проверки точности системы
Числовая доля проб | Значения MHO |
10-15 | Ниже 2,0 |
15-40 | От 2,0 до 2,8 |
15-40 | От 2,9 до 3,7 |
10-30 | От 3,8 до 4,5 |
5-10 | От 4,6 до 6,0 |
| |
Значения MHO должны быть определены системой для мониторинга in vitro пероральной терапии антикоагулянтами.
8.5.4 Инструменты и реактивы
Проверка точности системы в 8.5.7 предполагает, что для каждого обследуемого будет использован один инструмент. Использование больше, чем одного инструмента, для обследуемого может быть необходимым, чтобы минимизировать время между параллельными измерениями. Если предполагается использовать более одного инструмента, то инструменты следует ротировать в процессе выполнения программы таким образом, чтобы число образцов, измеренных каждым инструментом, было равным.
Примечание - Использование большего числа инструментов увеличивает промежуточную вариансу измерения, потому что вариация от инструмента к инструменту не наблюдалась бы при выполнении исследования для одного пациента на одном и том же инструменте. Это также усредняет определенные влияния индивидуальных инструментов (потенциально увеличивающееся или уменьшающееся смещение измерения).
Если разные обследуемые используют один и тот же инструмент, может быть необходимой очистка инструмента во избежание передачи с кровью болезнетворных микроорганизмов. Изготовители должны утвердить методику очистки и включить информацию по очистке в руководство для пользователей.
По крайней мере, две партии реактива должны быть включены в исследование по проверке точности системы.
8.5.5 Выбранная изготовителем методика измерения
Изготовитель должен установить выбранную и/или постоянную методику измерения, прослеживаемую до ручной методики референтного измерения покачивания пробирки, использующей международный референтный препарат тромбопластина.
Методика должна содержать описание процедуры сбора пробы относительно концентрации соли лимонной кислоты и марки устройства для сбора.
Применяют требования, определенные в ISO 17511.
Применяют требования, определенные в разделах 5 и 6 [49].
Примечание 1 - Для приписывания референтных значений может использоваться рутинная методика измерения свертывания (например, в больничной или амбулаторной лаборатории), которая прослеживается до ручной референтной методики измерения покачивания пробирки с использованием международного референтного препарата тромбопластина и подтверждена в отношении правильности и прецизионности путем сравнения с выбранной изготовителем или постоянной методикой измерения изготовителя.
Детальное описание методики измерения, обычно определяющей референтные значения, включая прослеживаемость до ручной референтной методики измерения покачивания пробирки с использованием международного референтного препарата тромбопластина или эквивалентность выбранной или постоянной методики измерения изготовителя, должно быть зарегистрировано в протоколе.
Примечание 2 - Примеры подходящих цепей прослеживаемости для выбранной процедуры измерения изготовителя представлены в приложении В, рисунки В.2 и В.3.
Если изготовитель заключит контракт с лабораторией референтных измерений, то должны быть предприняты соответствующие меры для подтверждения того, что лаборатория достаточно квалифицирована, чтобы выполнять процедуру измерения.
Примечание 3 - В качестве руководства может быть использован [20].
8.5.6 Проект исследования
Точность системы может быть проверена, используя или одно- или двухступенчатое сравнение.
При одноступенчатом сравнении капиллярную кровь сравнивают с венозной кровью без антикоагулянта (если требуется как приемлемый тип пробы) и цитратной плазмой.
При двухступенчатом сравнении капиллярную кровь сравнивают с венозной кровью без антикоагулянта, и венозную кровь без антикоагулянта сравнивают с цитратной плазмой. Этот подход может быть использован в случае, если отношения между венозной и капиллярной кровью установлены.
Примечание - Любая процедура позволяет выполнить несколько параллельных измерений из каждого образца венозной крови. Поэтому оценка различных источников вариации (например, партии реактива, инструменты, объемная доля эритроцитов) может быть проведена с увеличенной статистической силой.
Индивидуальные измерения системой мониторинга in vitro пероральной терапии антикоагулянтами должны быть сравнены с референтными значениями MHO, определенными в соответствии с процедурой измерения изготовителя (то есть выбранной или постоянной методикой измерения или в соответствии с другой утвержденной методикой измерения, которая дает эквивалентные результаты).
8.5.7 Методика
8.5.7.1 Общие положения
Изготовитель может предпочесть одноступенчатую или двухступенчатую методику. Преимущества и недостатки каждой методики описаны в 8.5.7.2 и 8.5.7.3.
Приведенные далее планы эксперимента представляют минимальные требования для проверки точности системы. Методики могут быть видоизменены, чтобы приспособиться к многим партиям реактивов или другим факторам.
8.5.7.2 Одноступенчатая методика
Два образца капиллярной крови должны быть собраны от каждого обследуемого согласно инструкциям изготовителя по применению для параллельных измерений системой мониторинга in vitro пероральной терапии антикоагулянтами.
Одновременно образец цитратной венозной крови должен быть собран у обследуемого опытным флеботомистом в соответствии с требованиями референтной методики измерения (см. 8.5.5). Если изготовитель предназначает использовать устройство для венозной крови, не содержащей антикоагулянты, должна быть собрана проба данного типа. Венозная кровь без антикоагулянта может использоваться для исследования плазмы после добавления цитратного антикоагулянта и отделения бедной тромбоцитами плазмы.
Образцы капиллярной и венозной крови (если применимо) должны быть измерены оцениваемым устройством согласно инструкциям изготовителя по применению, и результат должен быть зарегистрирован в листе данных сбора образцов.
После измерения системой мониторинга in vitro пероральной терапии антикоагулянтами (если применимо) образец венозной крови должен быть обработан и проанализирован в соответствии с постоянной методикой измерения изготовителя или альтернативной методикой измерения (см. 8.5.5), и результат MHO должен быть зарегистрирован в листе данных сбора.
Объемная доля эритроцитов (значение гематокрита) должна быть измерена в каждом образце, чтобы подтвердить, что значение - в пределах приемлемого интервала, определенного для устройства. Результаты должны быть зарегистрированы в листе данных сбора проб.
8.5.7.3 Двухступенчатая методика
В двухступенчатой методике:
a) в течение первого этапа должна быть показана эквивалентность венозной и капиллярной крови, и
b) в течение второго этапа будут использоваться венозная кровь без антикоагулянта как образец для устройства исследования крови и венозная цитратная плазма из того же венозного образца для соответствующего метода сравнения.
На первом этапе два образца капиллярной крови должны быть собраны у каждого обследуемого согласно инструкции изготовителя по применению для параллельных измерений системой мониторинга in vitro пероральной терапии антикоагулянтами.
Одновременно образец венозной крови должен быть собран у испытуемого лица опытным флеботомистом в соответствии с требованиями системы самотестирования in vitro.
Образцы должны быть измерены оцениваемым устройством согласно инструкциям изготовителя по применению, и результаты должны быть зарегистрированы в листе данных сбора.
После того, как продемонстрирована эквивалентность капиллярной и венозной крови без антикоагулянта, может быть проведено второе сравнение этапа (то есть между образцами венозной крови без антикоагулянта и цитратной плазмой). Это сравнение может быть проведено в местах, которые являются отдаленными по времени и месту от оригинального исследования эквивалентности капиллярной или венозной крови.
Примечание 1 - В настоящем стандарте "эквивалентный" означает не отличающийся значительно [угловой коэффициент линейной регрессии (slope) = от 0,95 до 1,05, отсекаемый отрезок на оси ординат (intercept) = ±0,1 MHO] в эксперименте с соответствующей статистической силой.
На втором этапе образец венозной крови без антикоагулянта должен быть измерен оцениваемым устройством согласно инструкциям изготовителя по применению, и результат зарегистрирован в листе сбора данных.
Образец венозной крови должен быть обработан немедленно и измерен референтной методикой измерения (см. 8.5.5), и результат MHO должен быть зарегистрирован в листе сбора данных.
Объемная доля эритроцитов (значение гематокрита) должна быть измерена в каждом образце, чтобы удостоверить, что значение - в пределах приемлемого интервала, определенного для устройства. Результаты должны быть зарегистрированы в листе сбора данных.
Двухступенчатая методика рекомендуется для участков, когда прокол пальцев не выполним (см. [21]).
Примечание 2 - Проколы пальцев могут оказаться не выполнимы из-за неудобств, добавляемых пациенту из-за двух параллельных проколов для получения капиллярной и венозной крови, а также:
- не приняты пациентами, которые не дадут согласие на основе информации, и/или
- не приняты исследователем, вследствие испытываемых трудностей из-за расхода времени на выполнение процедуры.
8.5.8 Анализ данных
8.5.8.1 Общие положения
До анализа листы данных должны быть оценены, чтобы идентифицировать очевидные ошибки (например, ошибки транскрипции, недостаточный объем образца крови). Должны быть внесены соответствующие исправления.
Никакие данные, принятые пользователем как действительные, не могут быть исключены из оценки точности системы. При проверке точности системы применяют следующие руководящие принципы:
a) Все процедурные ошибки, сбои инструмента и отказы контроля должны быть исследованы, чтобы определить причину. Исследование и его заключения должны быть зарегистрированы в отчете.
b) Если результат был принят пользователем как действительный, даже при том, что давалось ошибочное сообщение, если предел контроля был превышен или если произошла процедурная ошибка, такой результат не должен быть отклонен. Причина того, что пользователь игнорировал ошибочное сообщение, отказ контроля или процедурную ошибку, должна быть исследована.
c) Данные должны быть исследованы на статистические выбросы в соответствии с методикой, определенной в программе. Должен быть выполнен анализ регрессии и корреляции, и отчет представлен с включением выбросов и без них. Пункты данных выбросов должны быть включены в графики с применением различных символов. Руководящие принципы для идентификации выбросов приведены в [16] и [22].
Результаты должны быть сопоставлены на графике и проанализированы, и должна быть приведена следующая информация:
- общее число проанализированных образцов;
- интервал значений MHO, измеренных в соответствии с референтной методикой измерения;
- графическое представление данных с соответствующей статистикой (см. примеры в 8.5.8.2 и 8.5.8.3);
- результаты оценки точности системы (см. 8.6.2 и 8.6.3);
- резюме выбросов, идентифицированных и исключенных из статистического анализа, включая методику для идентификации выбросов и итоги исследования их причины, и
- библиографические ссылки на методики статистического анализа.
8.5.8.2 Графики различия
Различия между индивидуальными результатами, полученными с помощью системы мониторинга in vitro пероральной терапии антикоагулянтами, и референтными значениями должны быть представлены на графике как зависимые переменные. Референтные значения могут быть средними значениями параллельных измерений.
Графики различия - рекомендованный подход для того, чтобы изобразить точность системы, потому что статистические допущения минимальны, и процент точек данных, отвечающих критериям точности системы, так же, как и оценка смещения, могут быть легко вычислены. См. [22] или [23].
График различия процента с значениями MHO (при его низких значениях) вообще не подходит для графической оценки точности системы. Должны быть использованы фактические различия MHO. Рекомендованное отсечное значение 2,0 MHO.
Пример - График результатов исследования проверки системы мониторинга пероральной терапии антикоагулянтами представлен на рисунке 1. Верхняя и нижняя линии представляют критерии приемлемости из 8.6.1.
|
- референтные значения MHO;
- различие (наблюдаемые референтные значения MHO); 1 - верхний предел приемлемости; 2 - нижний предел приемлемости
Рисунок 1 - График различия MHO
Оценка точности системы должна быть основана на всех данных, принятых пользователем. Должны быть приведены следующие статистические данные для каждого интервала MHO в таблице 3:
a) Смещение (вычисленное как среднее значение различий между результатами системы мониторинга пероральной терапии антикоагулянтами и референтными значениями) так же, как стандартное отклонение различий и стандартная ошибка среднего различия.
b) Процент результатов в пределах критериев приемлемости для точности системы, описанных в 8.6.1.См.8.6.2.
c) Интервал, который охватывает 95% различий.
8.5.8.3 Анализ регрессии
Индивидуальные результаты системы мониторинга in vitro пероральной терапии антикоагулянтами должны быть представлены как зависимые переменные, а референтные значения как независимые переменные. Референтные значения могут быть средними значениями параллельных измерений. Идентичные шкалы и интервалы должны быть использованы для - и
-осей.
Угловой коэффициент наклона линии регрессии (slope) и - отсекаемый отрезок на оси ординат (intersept) должны быть вычислены в соответствии с подходящей методикой регрессионного анализа. Используемый метод должен быть задан в программе.
Примечания
1 Примеры включают в себя наименьшие квадраты линейной регрессии и регрессии Деминга, ортогональной регрессии (специальный случай регрессии Деминга) или регрессии Passing/Bablock. Соответствующий регрессионный анализ зависит от соответствия данных определенным статистическим допущениям. Рекомендации по оценке регрессионных методик для исследований сравнения методов и по выбору соответствующей методики регрессионного анализа, см. [24] или [25].
2 Смещение может быть вычислено из уравнения регрессии по отобранным значениям MHO (например, по концентрациям, принимаемым для обоснования медицинского решения). См. [22].
Пример - График регрессии по данным исследования проверки системы мониторинга пероральной терапии антикоагулянтами представлен на рисунке 2. Две внешних линии представляют критерии приемлемости из 8.6.1. Угловой коэффициент наклона линейной регрессии - 1,132±0,054; - точка пересечения оси ординат - минус 0,2±0,1; коэффициент корреляции - 0,943.
|
- референтные значения MHO;
- наблюдаемые значения MHO; 1 - верхний предел приемлемости; 2 - линия регрессии; 3 - линия идентичности; 4 - нижний предел приемлемости
Рисунок 2 - График регрессии
В отношении каждого места оценки должны быть приведены следующие сведения:
- график рассеяния данных с предполагаемой линией регрессии и линией ;
- наклон (slope) и точка пересечения (intercept) линии линейной регрессии с доверительными интервалами;
- коэффициент корреляции Пирсона .
Данные выбросов могут оказать нежелательное влияние на оценки центральной тенденции и дисперсии. Статистические параметры должны быть вычислены с включением выбросов и без них, и все данные должны быть представлены на графике регрессии с отметками данных выбросов, обозначенными различными символами.
8.6 Минимальная приемлемая точность системы
8.6.1 Требование точности системы
Минимальная приемлемая точность для результатов, полученных системой мониторинга in vitro пероральной терапии антикоагулянтами для самотестирования будет следующей:
- 90% различий между результатами, полученными системой мониторинга in vitro пероральной терапии антикоагулянтами, и результатами референтной методики измерения в комбинированных интервалах MHO ниже 2,0 и от 2,0 до 4,5, будет в пределах, указанных в таблице 3;
- смещение (среднее различие) между системой мониторинга in vitro пероральной терапии антикоагулянтами и референтной методикой измерения в терапевтическом интервале (MHO от 2,0 до 4,5) будет меньше или равно ±0,3 MHO;
- смещение результатов для супратерапевтического интервала (MHO от 4,6 до 6,0) должно быть сообщено.
Таблица 3 - Критерии качества выполнения
Интервал MHO | Допустимое различие (90% результатов) | Допустимое смещение (среднее различие) |
Ниже 2,0 | ±0,5 | Неприменимо |
От 2,0 до 4,5 | 30% | ±0,3 |
От 4,6 до 6,0 | Неприменимо | Неприменимо |
Примечание 1 - Критерии минимальной приемлемой точности основаны на рабочих характеристиках, представленных в настоящее время на рынке систем мониторинга in vitro пероральной терапии антикоагулянтами, которые характеризуют современное состояние качества работы. Эти системы предоставляют существенные выгоды пациентам. См. [26], [27]. См. приложение F для дополнительной информации.
Хотя никакие критерии эксплуатационных характеристик не указаны в интервале значений MHO от 4,6 до 6,0, различие и смещение должны быть вычислены и приведены в отчете.
Примечание 2 - Критерии применяют при проверке точности системы, работе на которой профессиональные операторы системы надлежащим образом обучены, которая должным образом обслуживается, и необходимые процедуры регулировки и контроля проводятся в соответствии с инструкциями изготовителя по применению.
8.6.2 Оценка точности системы
Приемлемость системы мониторинга in vitro пероральной терапии антикоагулянтами должна быть определена с использованием всех 400 результатов, полученных от 200 обследованных людей. Число приемлемых результатов в каждом интервале MHO должно быть сложено, чтобы определить общее число приемлемых результатов. Процент приемлемых результатов вычисляют как число приемлемых результатов, умноженное на 100 и разделенное на общее число результатов.
8.6.3 Представление данных
Результаты в интервалах MHO в таблице 3, должны быть представлены раздельно, потому что к каждому интервалу применимы различные критерии работы; см. 8.6.1.
Результаты должны быть представлены в таблице для каждого интервала MHO.
Рекомендованные форматы для медицинских работников и пользователей-непрофессионалов указаны в таблицах 4 и 5. Данные взяты из 8.6.2. Интервал представляет значения MHO, оцененные в 8.6.1. Верхний предел интервала измерения может быть выше; см. 4.2.
Таблица 4 - Пример представления результатов точности системы для профессиональной маркировки
Интервал MHO | В пределах 0,3 MHO | В пределах 0,5 MHO | Среднее различие MHO |
Ниже 2,0 | 100% | 100% | 0,1 |
Интервал MHO | В пределах 10% | В пределах 20% | В пределах 30% | Среднее различие MHO |
От 2,0 до 4,5 | 75% | 90% | 100% | 0,3 |
От 4,6 до 6,0 | 65% | 90% | 100% | 0,3 |
Таблица 5 - Пример представления результатов точности системы для маркировки для непрофессиональных пользователей
Интервал МНО | % приемлемых результатов |
От 1,2 до 4,5 | 97% |
| |
9 Оценка работы пользователя
9.1 Общие положения
Оценка работы пользователя должна быть выполнена изготовителем до размещения на рынке новой системы мониторинга in vitro пероральной терапии антикоагулянтами. Применяют требования, определенные в EN 13612.
Цель оценки работы пользователя состоит в том, чтобы продемонстрировать способность пользователей применять систему мониторинга in vitro пероральной терапии антикоагулянтами и получать приемлемые результаты на основе только инструкции по применению и обучению, обычно обеспечиваемого изготовителем.
Оценка работы пользователя должна быть выполнена согласно письменной программе. Программа должна, как минимум, определить обучение и образование, места оценки, сбор данных и методики анализа, и критерии приемлемости. Результаты оценки работы пользователя должны быть зарегистрированы в отчете.
Результаты, полученные пользователем-непрофессионалом, должны быть сравнены с результатами, полученными опытными техниками, с использованием той же системы мониторинга in vitro пероральной терапии антикоагулянтами, и могут быть сравнены с результатами, полученными изготовителем с применением постоянной/выбранной изготовителем методики измерения.
9.2 Места исследования
Исследования работы пользователей должны быть проведены в трех профессиональных участках. Настройка должна позволить пользователю-непрофессионалу выполнять измерения, используя только инструкции по применению и обучение, обычно обеспечиваемое пользователям изготовителем.
Объяснение для выбора участков оценки должно быть документировано.
Примечание - Изготовитель может выбрать места, которые представляют фактическое использование продукта (например, клиники, в которых проводят лечение антикоагулянтами).
9.3 Участники исследования
По крайней мере, 60 пользователей, по 20 на участок, должны быть включены в исследование, с учетом возраста, пола и уровня образования, репрезентативных для предполагаемой популяции пользователей. Участники исследования должны иметь целевой интервал MHO между 2,0 и 4,5 и должны соответствовать требованиям системы самотестирования in vitro пероральной терапии антикоагулянтами (например, значения объемной доли эритроцитов должны находиться в пределах интервала, определенного в инструкциях по применению).
Участники должны закончить программу образования изготовителя, но не должны получать дополнительного обучения, инструкции, помощи или учебных материалов кроме тех, которые обычно прилагают к системе для самотестирования in vitro пероральной терапии антикоагулянтами.
Как только участники закончили программу образования изготовителя и считаются достаточно квалифицированными, чтобы выполнять самотестирование, они могут участвовать в исследовании работы пользователей.
Если программа обучения требует, чтобы пользователи применяли системы самотестирования in vitro на дому, то участники должны быть проинструктированы о запрете использовать результаты для любой медицинской цели. Устройства должны быть помечены соответственно (например, "Только для оценки работы", "Для использования в исследовании").
9.4 Инструменты и материалы
Исследования по оценке работы пользователей должны быть проведены с использованием одной партии реактива.
9.5 Оценка умений пользователей
В месте оценки участники должны выполнить проколы собственных пальцев и измерить значения в крови с использованием системы самотестирования in vitro пероральной терапии антикоагулянтами. Каждый участник должен выполнить измерение дважды, получив два результата MHO.
Обученный медицинский работник данного участка должен также измерить значение в крови участника, используя ту же систему самотестирования in vitro пероральной терапии антикоагулянтами и ту же партию реактива. Медицинский работник должен измерить значение в крови участника дважды, получив два результата MHO.
Немедленно после этого медицинский работник может получить образец венозной крови участника для измерения в соответствии с референтной методикой измерения.
Чтобы не вводить в расчеты смещение, порядок измерения пользователями и медицинскими работниками должен быть рандомизированным или чередуемым.
Примечание 1 - Если имеются два инструмента и если допустимо системой самотестирования, два измерения могут быть сделаны в пробе, взятой из единственного прокола пальца, используя две последовательные капли крови.
Умения пользователя применять и обслуживать систему, наносить пробу и читать результат должны быть оценены обученным медицинским работником данного учреждения. Результаты оценки должны быть зарегистрированы.
Среди участников испытания может быть проведен анкетный опрос для оценки понимания ими системы.
После завершения программы пользователи должны быть проинструктированы относительно выполнения измерений на дому.
Каждый участник должен быть проинформирован о необходимости выполнять, по крайней мере, 10 измерений на протяжении 10 дней, но не больше, чем 30 дней, и не больше, чем одно измерение в день, следуя инструкции изготовителя по применению, включая измерение контрольных материалов.
Каждый участник должен быть проинструктирован о необходимости измерять два контрольных образца с каждым измерением крови, получая в общей сложности 10 значений для каждого уровня контрольного материала, если применимо.
Изготовители должны предоставить участникам формы данных для документации их результатов самотестирования и результатов контроля.
После домашнего периода измерений каждый участник должен возвратиться в учреждение (место проведения испытаний), чтобы завершить оценку работы пользователя медицинским работником. Здесь участники испытания должны выполнить проколы собственных пальцев и измерить образцы их крови, используя систему самотестирования in vitro пероральной терапии антикоагулянтами.
Немедленно после проведения самотестирования участниками обученный медицинский работник данного учреждения (участка испытания) должен измерить кровь участника испытания той же системой самотестирования in vitro пероральной терапии антикоагулянтами.
Немедленно после этого работник здравоохранения может получить образец венозной крови участника для измерения в соответствии с референтной методикой измерения.
Умения пользователя применять и обслуживать систему, наносить пробу и читать результат должны быть оценены обученным медицинским работником данного учреждения. Результаты оценки должны быть зарегистрированы в отчете.
Примечание 2 - Среди участников испытания может быть проведен анкетный опрос, чтобы оценить понимание ими системы.
Примечание 3 - Для расчета отношения результатов измерения пациентом и профессионалом может быть использована линейная регрессия и/или t-тесты.
9.6 Критерии приемлемости и оценка данных
Воспроизводимость параллельных измерений должна быть вычислена, как описано в 8.4.4.1, на основе двойных результатов пользователя и результатов параллельных измерений медицинского работника.
Среднеквадратическое отклонение промежуточной прецизионности должно быть вычислено на основе результатов контроля пользователя с использованием методики дисперсионного анализа для каждого уровня материала контроля, если применимо.
Используя первый результат каждого набора двойных результатов, соответствие результатов пользователя с результатами медицинского работника должно быть вычислено, как описано в 8.5.8.
Тот же самый анализ должен быть выполнен, используя первый результат пользователя и соответствующий результат референтного измерения, если применимо.
Для результатов пользователя и медицинского работника 95% всех результатов в интервале MHO от 2,0 до 4,5 будет в пределах ±0,5 MHO.
Среднее различие между результатами пользователя и результатами медицинского работника должно быть меньше или равно 10% результатов медицинского работника.
Точно также соответствие результатов пользователей с соответствующими результатами референтного измерения должно быть рассчитано, если это применимо.
Результаты исследования должны быть сообщены в формате, описанном в 8.6.3.
Примечание - Приложение F содержит обзор опубликованных оценок работы, к которым эти критерии работы были применены ретроспективно.
9.7 Оценка инструкций по применению
Инструкции по применению должны быть оценены участниками исследования. Пользователи-непрофессионалы и медицинские работники должны рассмотреть и предоставить комментарии относительно простоты понимания инструкций по применению.
Эта оценка может быть объединена с исследованием, описанным в 9.3, или может быть проведена отдельно.
Комментарии пользователей могут быть получены путем анкетного опроса, или как часть исследования человеческого фактора. Изготовитель должен установить критерии для результатов оценки инструкций по применению. Если результаты пользователей не отвечают критериям приемлемости, то изготовитель должен рассмотреть потребность пересмотра разделов инструкций и повторить оценку.
Приложение А
(обязательное)
Дополнительные требования для электромагнитной совместимости
А.1 Общие положения
Данное приложение определяет минимальные требования для устойчивости и эмиссии относительно электромагнитной совместимости (ЭМС) устройства для мониторинга in vitro пероральной терапии антикоагулянтами, предназначенного для самотестирования, в дополнение к требованиям 6.4.
Если анализ риска (см. 4.4) показывает, что воздействие более высокими уровнями лучевой энергии или электростатического разряда представляет недопустимый риск для пользователя, тогда устройство должно быть проверено на этих более высоких уровнях.
А.2 Требования теста устойчивости
А.2.1 Устойчивость к излучению
Применяют требования, определенные в IEC 61000-4-3.
Кроме того, устойчивость против излученных частот должна быть расширена на диапазон частот до 2,5 ГГц при уровне испытания 3 В/м.
А.2.2 Устойчивость к электростатическому разряду
Применяют требования, определенные в IEC 61000-4-2.
Для разряда в воздухе устойчивость к электростатическому разряду должна демонстрироваться на испытательных уровнях ±2, ±4 и ±8 кВ.
Для контактного разряда устойчивость к электростатическому разряду должна демонстрироваться на испытательных уровнях ±2, ±4 и ±6 кВ.
А.3 Требования теста системы
Если другое оборудование связано с инструментом или может быть связано с инструментом, образовавшаяся система также должна соответствовать требованиям ЭМС.
Определяя требования к системе тестирования, изготовитель должен рассмотреть, действительно ли возможно выполнять измерение в то время, как система связана. Конфигурация системы, определенная изготовителем, или обозримые конфигурации системы, идентифицированные анализом риска, должны быть проверены, как описано в А.2 если они позволяют пользователю выполнять измерение MHO.
Требования теста системы можно не применять, если проект устройства препятствует пользователю выполнять измерения MHO, когда инструмент связан с другим оборудованием.
А.4 Инструкции по применению
Инструкции по применению (см. 5.3) должны содержать следующую информацию:
a) утверждение, что оборудование выполняет применимые требования к ЭМС эмиссии, и что эмиссия используемой энергии низкая и вряд ли вызовет помехи у соседнего электронного оборудования;
b) утверждение, что оборудование проверено на устойчивость к электростатическому разряду, как определено IEC 61000-4-2;
c) рекомендованные меры ограничения применения, которые должны быть предприняты пользователем, чтобы избежать неправильной операции или повреждения устройства.
Пример 1 - "Не используйте этот инструмент в сухой окружающей среде, особенно если присутствуют синтетические материалы. Синтетическая одежда, ковры, и т.д., могут вызвать разрушительные статические разряды в сухой окружающей среде";
d) утверждение, что оборудование проверено на устойчивость к радиочастотной интерференции в частотном диапазоне и на испытательном уровне, определенном в настоящем стандарте;
e) рекомендованные меры уменьшения, которые должны быть предприняты пользователем, чтобы избежать помех радиочастот, с определенными примерами.
Пример 2 - "Не используйте этот инструмент вблизи сотовых или беспроводных телефонов, переговорных устройств, устройств для открытия дверей гаражей, радиопередатчиков или другого электрического или электронного оборудования, которые являются источниками электромагнитного излучения, поскольку они могут интерферировать с надлежащей работой инструмента".
Приложение В
(справочное)
Примеры цепи прослеживаемости
Диаграмма на рисунке В.1 адаптирована из ISO 17511, чтобы показать полную цепь прослеживаемости для калибровки изготовителем системы мониторинга in vitro пероральной терапии антикоагулянтами.
|
_______________
Международный согласованный калибратор и рабочий калибратор изготовителя могут быть соответствующими суррогатными референтными материалами или человеческими образцами.
Рисунок В.1 - Пример цепи прослеживаемости для результата измерения системы мониторинга пероральной терапии антикоагулянтами
Пример на рисунке В.2 демонстрирует цепь прослеживаемости для результатов MHO до референтной методики измерения ВОЗ покачивания пробирки и международного референтного препарата тромбопластинов с использованием одноступенчатой методики, описанной в 8.5.7.2.
|
_______________
Рабочий калибратор изготовителя может быть соответствующим суррогатным референтным материалом или человеческим образцом.
Рисунок В.2 - Пример цепи прослеживаемости для исследования верификации точности системы мониторинга in vitro пероральной терапии антикоагулянтами в соответствии с одноступенчатой методикой
Пример на рисунке В.3 показывает цепь прослеживаемости для результатов MHO до референтной методики измерения ВОЗ покачивания пробирки и международного референтного препарата тромбопластинов с использованием двухступенчатой методики, описанной в 8.5.7.3
|
_______________
Рабочий калибратор изготовителя может быть соответствующим суррогатным референтным материалом или человеческим образцом.
Рисунок В.3 - Пример цепи прослеживаемости для верификации точности системы мониторинга in vitro пероральной терапии антикоагулянтами в соответствии с двухступенчатой методикой
Приложение С
(справочное)
Вычисление размера пробы для оценки смещения [28]
В соответствии с таблицей 2 в 8.5.3, по крайней мере, 150 образцов должны быть исследованы в интервале MHO от 2,0 до 4,5.
Коэффициент вариации 5% будет постулирован для системы мониторинга пероральной терапии антикоагулянтами и для выбранной изготовителем методики измерения.
Для среднего MHO 3,0 следует среднеквадратическое отклонение ![]() 0,15.
0,15.
Поскольку выполнены параллельные измерения, эффективное среднеквадратическое отклонение уменьшено до
![]() .
.
Если допустимое смещение 0,3 MHO, 95% доверительный интервал, ![]() может быть вычислено следующим образом:
может быть вычислено следующим образом:
![]() ,
,
только длина интервала
![]() ;
;
![]() ;
;
![]()
или 0,3±0,025 MHO.
Поэтому результаты популяции проб из 150 образцов в интервале от 2,0 до 4,5 MHO в доверительном интервале ±0,025 MHO, который является достаточным, чтобы подтвердить, что работа системы соответствует допустимому смещению 0,3 MHO.
Приложение D
(справочное)
Пример вычисления неопределенности для определения MHO протромбина с применением системы мониторинга in vitro* пероральной терапии антикоагулянтами
_______________
* В бумажном оригинале слова "in vitro" в наименовании приложения D выделены курсивом. - .
Пример вычисления неопределенности для определения MHO протромбина с применением мониторинга in vitro пероральнной терапии антикоагулянтами приведен в таблице D.1.
Таблица D.1
Наименование влияния | Размер при MHO 3,0 | Тип | Распределение вероятности | Делитель | Частное | Квадрат | Комментарии |
Этап 1 - Постоянная методика измерения изготовителя: международный индекс чувствительности партии владельца | |||||||
Международный референтный препарат | Ноль (по определению) | - | - | - | - | - | - |
Аналитическая ошибка методики ВОЗ Вариация, зависящая от оператора Совокупность проб Вариация методики измерения, выбранной изготовителем |
| А | Нормальное | 1 | - | 0,0225 | Межлабораторный |
Вариабельность алгоритма | Интервал ±0,03 MHO | В | Прямоугольное | 1,73 | - | - | Влияние ничтожно [29] |
Этап 2 - Рутинная методика измерения конечного пользователя: фабричная калибровка | |||||||
Аналитическая ошибка калибровки методики Совокупность проб для калибровки Совокупность инструментов Стабильность партии изготовителя/ реагентов | 0,10 MHO (стандартное отклонение) | А | Нормальное | 1 | - | 0,01 | Всего было оценено 4 причины, используя 8 партий реактива, произведенных за период времени более 1 года, образец венозной крови [30] |
Стабильность реагентов | 0,10 MHO (стандартное отклонение) | А | Нормальное | 1 | - | 0,01 | Требования к продукту, которые рассматривают как стандартное отклонение. |
Этап 3 - Рутинная методика измерения конечного пользователя: Определение MHO пользователя | |||||||
Влияние матрицы пробы пациента Аналитическая ошибка определения пользовавателя |
| А | Нормальное | 1 | - | 0,0256 | Непрецизионность в руках пациента в пределах между 5,2% и 5,5% [31], [30], [33] |
Вариабельность инструмента |
| А | Нормальное | 1 | - | 0,002 |
|
Сумма квадратов 0,0701
Комбинированная стандартная неопределенность ±0,265 MHO (стандартное отклонение)
Источник: R.Leinberger, W.Plesch, В.Dcheffler, С.Berding и S.Arends, Roche Diagnostics GmbH, Мангейм (неопубликованная) ГЕРМАНИЯ. |
Постоянная методика измерения изготовителя могла быть калибрована не непосредственно против международного референтного препарата (МРП), как показано в диаграмме причины и эффекта, а против выбранной изготовителем методики измерения, как показано на рисунке В.1. Дополнительный этап в цепи неопределенности, калибровка выбранной изготовителем методики измерения против МРП, добавляет неопределенность. Размер добавленной неопределенности будет идентичен этапу 1 в таблицу D.1, что соответствует 0,15 стандартного отклонения MHO. Включение выбранной изготовителем методики измерения в цепь калибровки может оказаться необходимым, если доступно недостаточное количество реактива международного референтного препарата. Примечание 1 - Для использования диаграммы причины и эффекта для идентификации вкладов в неопределенность измерения, см. рисунок D.1. Примечание 2 - Для дополнительной информации, см. [34], [35], [36], [37], [38]. |
|
Рисунок D.1 - Диаграмма причины и эффекта цепи прослеживаемости определения MHO протромбина у пациента, получающего антикоагулянты
Приложение Е
(справочное)
Элементы обеспечения качества систем мониторинга in vitro пероральной терапии антикоагулянтами
_______________
* В бумажном оригинале слова "in vitro" в наименовании приложения E выделены курсивом. - .
Таблица Е.1
Элементы обеспечения качества систем мониторинга in vitro пероральной терапии антикоагулянтами | ||||||
Прослежи- | Валидация системы | Проверка и калибровка реагента | Проверка инструмента (см. раздел 6) | Проверка измерения (см. 4.6.2) | Контроль работы системы | Проверка качества работы пользователя (см. 4.6.4 и 4.6.5) |
Изготовитель | Изготовитель | Изготовитель | Изготовитель | Самоконтроль инструмента | Пользователь | Медицинский работник |
Перед запуском; образцы пациентов против методики наклонной пробирки с использо- | Перед запуском; образцы пациентов с существен- | Каждая партия перед выпуском; контрольные пробы и образцы пациента | Тестирование инструмента перед выпуском | Перед каждым измерением - внутренний физический контроль и сопоставление с критериями процесса | С каждой новой упаковкой реактива и при появлении неожиданного результата; контрольные материалы и интегри- | Каждые 6 мес капиллярная кровь; анализ пользователя сопоставляется с анализом, выполненным медицинским работником или с исследованием рутинной методикой в лаборатории |
Приложение F
(справочное)
Применение критериев рабочих характеристик к опубликованным оценкам систем мониторинга in vitro* пероральной терапии антикоагулянтами
_______________
* В бумажном оригинале слова "in vitro" в наименовании приложения F выделены курсивом. - .
Цель этого приложения состоит в том, чтобы суммировать данные о рабочих характеристиках доступных в настоящее время систем мониторинга in vitro пероральной терапии антикоагулянтами, представленные в медицинской литературе, и сравнить результаты с минимально приемлемыми критериями точности системы в 8.6. Эти результаты - показатель достигнутого общепринятого уровня точности систем мониторинга in vitro пероральной терапии антикоагулянтами и указание на необходимость улучшения результатов пациентов (см. [27], [39]).
Ключ к интерпретации таблицы F.1: исследование, отраженное в каждой ссылке в Библиографии (1), представлено следующим образом: оцениваемое устройство (2), тип образца крови и оператор (3), методика измерения лаборатории (4), детали исследования (5), математическое (6) и клиническое (7) соответствие устройства с методикой измерения лаборатории и ожидаемыми результатами, оцененными против критериев рабочих характеристик в настоящем стандарте (8).
Таблица F.1
|
Продолжение таблицы F.1
|
Продолжение таблицы F.1
|
Продолжение таблицы F.1
|
Продолжение таблицы F.1
|
Окончание таблицы F.1
|
Библиография
[1] | International vocabulary of basic and general terms in metrology (VIM). BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML, 2nd ed., 1993 | |
[2] | ISO 3534-1:2006 | Statistics - Vocabulary and symbols - Part 1: General statistical terms and terms used in probability (Статистика. Словарь и символы. Часть 1. Общие статистические термины и термины, используемые для вероятности) |
[3] | ISO 5725-1:1994 | Accuracy (trueness and precision) of measurement methods and results. Part 1. General principles and definitions (Точность (правильность и прецизионность) методов измерения и результатов. Часть 1. Общие принципы и определения) |
[4] | EN 375:2001 | Information supplied by the manufacturer with in vitro diagnostic reagents for professional use; German version (Информация, поставляемая изготовителем с реагентами для диагностики in vitro для профессионального использования) |
[5] | POLLER, L., VAN DEN BESSELAAR, A.M.H.P., JESPERSEN, J., TRIPODI, A. and HOUGHTON, D., The European Concerted Action on Anticoagulation: Field studies of coagulometer effects on the ISI of ECCA thromboplastins. Thromb Haemost. 1998, 80, pp.615-623 | |
[6] | ISO 5725-3:1994 | Accuracy (trueness and precision) of measurement methods and results - Part 3: Intermediate measures of the precision of a standard measurement method (Точность (правильность и прецизионность) методов измерения и результатов. Часть 3. Промежуточные меры прецизионности стандартного метода измерения) |
[7] | EN 376:2002 | Information supplied by the manufacturer with in vitro diagnostic reagents for self-testing (Информация, поставляемая изготовителем с реагентами для диагностики in vitro для самотестирования) |
[8] | ISO 15197:2003 | In vitro diagnostic test systems - Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus (Системы диагностические in vitro. Требования к системам мониторного наблюдения за концентрацией глюкозы в крови для самоконтроля при лечении сахарного диабета) |
[9] | CLSI EP7-A2 | Interference testing in clinical chemistry; Approved guideline, 2nd ed. CLSI document ISBN 1-56238-584-4. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, PA 19087 - 1898 USA, 2005 |
[10] | CLSI EP18-A | Quality management for unit-use testing; Approved guideline. CLSI document ISBN 1-56238-481-3. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, PA 19087 - 1898 USA, 2002 |
[11] | WHO Expert Committee on Biological Standardization. Guidelines for thromboplastins and plasma used to control oral anticoagulation therapy. World Health Organ Tech Rep Series 1999; 889: pp.64-93 | |
[12] | NIST/SEMATECH e-Handbook of Statistical Methods, Chapter 3: Production Process Characterization, <http: //www.itl.nist.gov /div898/ handbook/>, 2003 | |
[13] | ISO 15193:2002 | In vitro diagnostic medical devices. Measurement of quantities in samples of biological origin. Presentation of reference measurement procedures (Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание референтных методик выполнения измерений) |
[14] | ISO 15194:2002 | In vitro diagnostic medical devices - Measurement of quantities in samples of biological origin - Description of reference materials (Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание стандартных образцов) |
[15] | Council Directive 98/79/EC of the European Parliament and of the Council of 27 October 1998 on in vitro Diagnostic Medical Devices, Official Journal of the European Union L331, December 7, 1998 | |
[16] | ISO 5725-2:1994 | Accuracy (trueness and precision) of measurement methods and results. Part 2. Basic method for the determination of repeatability and reproducibility of a standard measurement method (Точность (правильность и прецизионность) методов измерения и результатов. Часть 2. Основной метод для определения повторяемости и воспроизводимости стандартного метода измерения) |
[17] | PLESCH, W., KLIMPE, P., LEICHSENRING, I., HILL, J., CARR, В. and VAN DEN BESSELAAR, A.M.P.H., INR Calibration of the new CoaguChek PTS Test. Pathophysiol Haemos Thromb. 2002, 32 (Suppl II) | |
[18] | CLSI EP5-A2 | Evaluation of precision performance of quantitative measurement methods; Approved guideline, 2nd ed. CLSI document ISBN 1-56238-542-9. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, PA 19087 - 1898 USA, 2004 |
[19] | EISENWIENER, H.G., BABLOK, W., BARDORFF, W., BENDER, R., MARKOWETZ, D. and PASSING, H. et al., | |
[20] | ISO 15195:2003 | Laboratory medicine - Requirements for reference measurement laboratories (Лабораторная медицина. Требования к лабораториям референтных измерений) |
[21] | VAN DEN BESSELAAR, A.M., MEEUWISSE-BRAUN, J., SCHAEFER-VAN MANSFELD, H., VAN RIJN, С and WITTEVEEN, E.A., Comparison between capillary and venous blood international normalized ratio determinations in a portable prothrombin time device. Bl Coag Fibrinol. 2000, 11(6), pp.559-562 | |
[22] | CLSI EP9-A2 | Method comparison and bias estimation using patient samples; Approved guideline, 2nd ed. CLSI document ISBN 1-56238-472 4. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, PA 19087 - 1898 USA, 2002 |
[23] | BLAND, J.M. and ALTMAN, D.G., Statistical methods for assessing agreement between two methods of clinical measurement. Lancet, i, 1986, pp.307-310 | |
[24] | LINNET, K., Evaluation of regression procedures for methods comparison studies. Clin Chem. 1993, 39, pp.424-432 | |
[25] |
| |
[26] | HENEGHAN, C., ALONSO-COELLO, P., GARCIA-ALAMINO, J.M., PERERA, R., MEATS, E. and GLASZIOU, P., Self-monitoring of oral anticoagulation: a systematic reviewand meta-analysis. The Lancet 2006; 367: p.404-411 | |
[27] | MENENDEZ-JANDULA, В., SOUTO, J.C., OLIVER, A., MONTSERRAT, I., QUINTANA, M., GICH, I., BONFILL, X. and FONTCUBERTA, J., Comparing self-management of oral anticoagulant therapy with clinic management: a randomized trial. Ann Intern Med 2005; 142 (1): pp.1-10 | |
[28] | POLLER, L., et al., Multicentre ISI calibration of two types of РОС prothrombin time monitoring systems. Br J Haematol. 2002, 116, pp.844-850 | |
[29] | TRIPODI, A., et al., International collaborative study for the calibration of a proposed reference preparation for thromboplastin, human recombinant, plain. Thromb Haemost, 1998; 79, pp.439-445 | |
[30] | VAN DEN BESSELAAR, A.M. and BERTINA, R.M., Multi-center study of thromboplastin calibration precision. Influence of reagent species, composition and ISI. Thromb Hemost. 1993, 69, pp.35-40 | |
[31] | VAN DEN BESSELAAR, A.M., Precision and Accuracy of the INR in oral anticoagulation control. Haemostasis 1996, 26 (Suppl), pp.248-265 | |
[32] | VAN DEN BESSELAAR, A.M., et al (editors), Thromboplastin Calibration and Oral Anticoagulant Control. Martinus Nijhoff Publishers, 1984, p.109 | |
[33] | SCHEFFLER, В., Algorithms for reagent carriers. Roche Diagnostics Mannheim | |
[34] | STANKIWICZ, A., Eight reagent lots comparison. Roche Diagnostics Indianapolis, internal data | |
[35] | PLESCH, W., et al. Evaluation of the new CoaguChek "mini" PT test strips in patient's hands. Haemostasis. 1998, 28 (suppl 2), p.67 | |
[36] | ATTERMANN, J., et al. Precision of patient's measurements of the INR using a patient operated whole blood home coagulometer. Thromb Res. 1998, 92, pp.287-291 | |
[37] | ATTERMANN J, Precision of INR measured with a patient operated whole blood coagulometer. Thromb Res. 2003, 110, pp.65-68 | |
[38] | PLESCH, W., HILL, J., KIMPEL, P., SUCHY, A., CARR, В., NEWHART, A., CHANTARANGKUL, V., TRIPODI, A., SLING ERLAND, R. and DIKKESCHEI, L., Comparison of INR Results of the CoaguChek S PT and CoaguChek Pro PTn Test With International Reference Thromboplastins. Ann Hematol. 2002, 81 (Suppl 1), A65 | |
[39] | LADUCA, F., GUNNERMAN, Т., RUYBALID, R., JACOBSON, A. and ZUCKER, M., Precision of INR (International Normalized Ratio) measurement using laboratory and point-of-care assays: Understanding the impact of system influence on patient management. International Soc Thrombosis and Haemostasis. Birmingham UK, 2003. J Thromb Haemost Supplement, 2003 | |
[40] | LADUCA, F., GUNNERMAN, Т., RUYBALID, R., JACOBSON, A. and ZUCKER, M., Precision of INR (International Normalized Ratio) measurement using laboratory and point-of-care assays: Understanding the impact of system influence on patient management. Amer Assoc Clin Chem, Philadelphia PA, 2003. Clin Chem. 2003, 49, F-8 | |
[41] | TRIPODI, A., CHANTARANGKUL, V., BRESSI, С and MANNUCCI, P., International Sensitivity Index calibration of the near-patient testing prothrombin time monitor. ProTime. Am J Clin Path. 2003, 119, pp.241-245 | |
[42] | VAN DEN BESSELAAR, A.M.P.H., A comparison of INRs determined with a whole blood prothrombin device and two IRP for thromboplastin. Thromb Haemost. 2000, 84, pp.410-412 | |
[43] | SHIACH, C, CAMPBELL, В., POLLER, L, KEOWN, M. and CHAUHAN, N., Reliability of point-of-care prothrombin time testing in a community clinic: a randomized crossover comparison with hospital laboratory testing. Br J Hematol. 2002, 119, pp.330-375 | |
[44] | POLLER, L, KEOWN, M., CHAUHAN, N., VAN DEN BESSELAAR, A.M.P.H., TRIPODI, A., SHIACH, С and JESPERSEN, J., Reliability of INR from two point of care test systems: comparison with conventional methods. BMJ. 2003, p.327 | |
[45] | DOUKETIS, J., LANE, A., MILNE, J. and GINSBERG, J., Accuracy of a portable international normalization ratio monitor in outpatients receiving long-term oral anticoagulant therapy: Comparison with a laboratory reference standard using clinically relevant criteria for agreement. Thromb Res. 1998, 92, pp.11-17 | |
[46] | EN 591:2001 Instructions for use form vitro diagnostic instruments for professional use | |
[47] | JACKSON, S., BEREZNICKI, L. and PETERSON, G., Accuracy, reproducibility and clinical utility of the CoaguChek S portable international normalized ratio monitor in an outpatient anticoagulation clinic. Clin Lab Haem. 2004, 26, pp.49-55 | |
[48] | PATSCH, M., CIMINI, С and LADUCA, F., Performance evaluation of Protime3: Low volume prothrombin time (PT) test for professional and patient self-testing applications. Anticoagulation Forum, Washington DC 2001. J Thromb Thrombol. 2001, 12, 112, E11 | |
[49] | Технические отчеты ВОЗ, номер 889, 1999, приложение 3 | |
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
Обозначение и наименование ссылочного международного стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
ISO 13485:2003 Изделия медицинские. Системы менеджмента качества. Системные требования в целях регулирования | IDT | ГОСТ ISO 13485-2011 Изделия медицинские. Системы менеджмента качества. Системные требования в целях регулирования |
ISO 14971:2000 Изделия медицинские. Применение менеджмента риска к медицинским изделиям | IDT | ГОСТ ISO 14971-2011* Изделия медицинские. Применение менеджмента риска к медицинским изделиям |
________________ * На территории Российской Федерации действует ГОСТ Р ИСО 14971-2009. - . | ||
ISO 15198:2004 Клиническая лабораторная медицина. Изделия медицинские для диагностики in vitro. Подтверждение методик контроля качества, рекомендуемых изготовителями пользователям | - | * |
ISO 17511:2003 Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам | IDT | ГОСТ ISO 17511-2011 Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. |
ISO 18113-1 Клинические лабораторные исследования и диагностические медицинские системы in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 1. Термины, определения и общие требования | - | * |
ISO 18113-4 Клинические лабораторные исследования и диагностические медицинские системы in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 4. Диагностические реактивы in vitro для самотестирования | - | * |
ISO 18113-5 Клинические лабораторные исследования и диагностические медицинские системы in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 5. Диагностические инструменты in vitro для самотестирования | - | * |
IEC 61010-1:2001 Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 1. Общие требования | - | * |
IEC 61010-2-101:2002 Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 2-101. Частные требования к медицинской аппаратуре для диагностики in vitro (IVD) | - | * |
IEC 61000-4-2:95 Электромагнитная совместимость. Часть 4. Методики испытаний и измерений. Раздел 2. Испытание на невосприимчивость к электростатическому разряду | - | * |
IEC 61000-4-3:95 Электромагнитная совместимость. Часть 4-3. Методики испытаний и измерений. Испытание на устойчивость к воздействию электромагнитного поля с излучением на радиочастотах | - | * |
IEC 61326:97 Электрооборудование для измерения, управления и лабораторного использования. Требования к электромагнитной совместимости | - | * |
EN 13532:2002 Общие требования к медицинским изделиям для диагностики in vitro для самоконтроля | - | * |
EN 13612:2002 Оценка эксплуатационных характеристик медицинских диагностических устройств in vitro | - | * |
EN 13640:2002 Оценка стабильности реактивов для диагностики in vitro | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящем стандарте использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Электронный текст документа
и сверен по:
, 2013