ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТР
ИСО 22610—
2022
ХИРУРГИЧЕСКИЕ ПРОСТЫНИ, ХАЛАТЫ И КОСТЮМЫ ДЛЯ ЧИСТЫХ ПОМЕЩЕНИЙ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ ДЛЯ ЗАЩИТЫ ПАЦИЕНТОВ, МЕДИЦИНСКОГО ПЕРСОНАЛА И ОБОРУДОВАНИЯ
Метод испытания устойчивости материалов к проникновению бактерий во влажных условиях
(ISO 22610:2018, Surgical drapes, gowns and clean air suits, used as medical devices, for patients, clinical staff and equipment — Test method to determine the resistance to wet bacterial penetration, IDT)
Издание официальное
Москва Российский институт стандартизации 2022
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы «Федерация лабораторной медицины» (Ассоциация «ФЛМ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 3 октября 2022 г. № 1039-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 22610:2018 «Хирургические простыни, халаты и костюмы для чистых помещений для пациентов, медицинского персонала и оборудования, используемые как медицинские изделия. Метод испытания для определения устойчивости к проникновению бактерий во влажных средах» (ISO 22610:2018 «Surgical drapes, gowns and clean air suits, used as medical devices, for patients, clinical staff and equipment — Test method to determine the resistance to wet bacterial penetration», IDT).
Международный стандарт разработан Техническим комитетом ТК 94 «Личная безопасность — Защитная одежда и оборудование», подкомитетом ПК 13 «Защитная одежда» Международной организации по стандартизации (ISO).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5—2012 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные и межгосударственные стандарты, сведения о которых приведены в приложении ДА.
Дополнительные сноски в тексте стандарта, выделенные курсивом, приведены для пояснения текста оригинала
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2018
© Оформление. ФГБУ «РОТ», 2022
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Сущность метода
5 Оборудование, реагенты и материалы
6 Испытательное оборудование и комплектующие
7 Подготовка чашек с агаром
8 Бактериальный инокулюм
9 Порядок проведения испытания
10 Оценка
11 Обработка результата
12 Прецизионность
13 Отчет об испытании
Приложение А (обязательное) Питательные среды
Приложение В (обязательное) Испытательное оборудование (стенд) и комплектующие
Приложение С (обязательное) Оборудование и мониторинг производительности лаборатории
Приложение D (справочное) Оценка бактериальной контаминации на верхней стороне исследуемого образца и бактериальной нагрузки, оставшейся на доноре
Приложение Е (справочное) Передача инфекционных агентов во время инвазивных хирургических манипуляций
Приложение F (справочное) Прецизионность исследований на проникновение бактерий во влажных условиях
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам
Библиография
Введение
Существует много ситуаций, при которых бактерии, переносимые жидкостью, могут проникать через влажный барьерный материал. Одним из примеров является проникновение микробиотов через покровный материал во влажной среде (см. приложение Е).
В Европейских нормативных документах, касающихся медицинских изделий, ответственность за предотвращение передачи инфекционных агентов, связанных с применением изделия, возложена на производителя. Чтобы предоставить пользователю информацию о медицинском изделии и соответствие требованию по предотвращению передачи инфекционных агентов, необходимо использовать гармонизированные и признанные международные методы испытаний.
Метод испытаний, приведенный в настоящем стандарте, является микробиологическим и поэтому предназначен для использования в лабораториях, имеющих опыт и соответствующее оснащение для данной работы.
С целью повышения прецизионности метода испытаний ИСО 22610:2006 был существенно пересмотрен.
Основное различие между настоящим стандартом и ИСО 22610:2006 заключается в том, что рассматривается штамм другого вида бактерий и определены более жесткие требования к обработке материалов и процедурам, что приводит к более воспроизводимым и точным результатам измерений.
Для получения точных, повторяемых и воспроизводимых результатов необходимо не только соответствие оборудования требованиям, указанным в настоящем стандарте, но и точное и последовательное соблюдение процедуры обработки материалов и проведения испытаний. Незначительные отклонения от требований к оборудованию, процедуре и/или обращению с образцами могут в значительной мере негативно сказаться на повторяемости, воспроизводимости и точности результатов измерений.
ГОСТ Р ИСО 22610—2022
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ХИРУРГИЧЕСКИЕ ПРОСТЫНИ, ХАЛАТЫ И КОСТЮМЫ ДЛЯ ЧИСТЫХ ПОМЕЩЕНИЙ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ ДЛЯ ЗАЩИТЫ ПАЦИЕНТОВ, МЕДИЦИНСКОГО ПЕРСОНАЛА И ОБОРУДОВАНИЯ
Метод испытания устойчивости материалов к проникновению бактерий во влажных условиях
Surgical drapes, gowns and clean air suits, used as medical devices, for protection of patients, clinical staff and equipment. Test method to determine the resistance to wet bacterial penetration
Дата введения — 2023—10—01
ПРЕДОСТЕРЕЖЕНИЕ — Использование настоящего стандарта может быть связано с применением опасных материалов, операций и оборудования. Настоящий стандарт не затрагивает решения всех проблем безопасности, связанных с его использованием. Специалисты, применяющие настоящий стандарт, несут ответственность за установление соответствующих правил техники безопасности и гигиены труда до применения настоящего стандарта и за соблюдение в работе требований законодательства.
ВАЖНО — Данный метод испытаний был существенно пересмотрен с точки зрения применяемых методов и их описания. Оборудование должно соответствовать требованиям, указанным в настоящем стандарте, а измерения следует проводить в указанных условиях. Особое внимание необходимо уделить предварительной обработке образцов в строгом соответствии с процедурой, приведенной в настоящем стандарте. Незначительные отклонения от требований к оборудованию, процедуре и/или обращению с образцами могут в значительной мере негативно сказаться на повторяемости, воспроизводимости и точности результатов измерений.
1 Область применения
Настоящий стандарт устанавливает метод испытаний с применением соответствующего испытательного оборудования, используемого для определения барьерных свойств материалов.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных — последнее издание (включая все изменения)]:
ISO 11607-1, Packaging for terminally sterilized medical devices — Part 1: Requirements for materials, sterile barrier systems and packaging systems (Упаковка для медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам)
ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories (Общие требования к компетентности испытательных и калибровочных лабораторий)
ISO 17665-1, Sterilization of health care products — Moist heat — Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices (Стерилизация медицинской продукции. Влажное тепло. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий1).
1) По состоянию на момент публикации действует ГОСТ Р ИСО 17665-1—2016.
Издание официальное
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
Терминологические базы данных ИСО и МЭК доступны по следующим интернет-адресам:
- электронная платформа ИСО с функцией онлайн-просмотра терминов по адресу: //www.iso. org/obp;
- электронная база МЭК Electropedia по адресу: //www.electropedia.org/.
3.1 носитель (carrier material): Материал (бумажный лист), используемый для подготовки донора (полиуретановая пленка).
3.2 донор (donor): Материал из полиуретановой пленки, который заражен известным числом жизнеспособных клеток определенного штамма бактерий.
3.3 защитная пленка (cover film): Материал из полиэтилена высокой плотности, которым накрывают донора и испытуемый образец во время испытания.
3.4 щуп (finger): Часть стенда (установки) для испытаний, используемая для создания контакта донора и испытуемого образца с поверхностью агаризованной питательной среды в чашке.
3.5 повторный тест (replicate test): Одна полная оценка отдельного испытуемого образца, вырезанного из экземпляра (например, халата, простыни), состоящая из подсчета результатов, полученных из пяти чашек с агаризованной средой, находящихся в непосредственном контакте с донором.
3.6 испытуемый образец (test specimen): Участок материала, для которого определяется устойчивость к проникновению бактерий при трении во влажных условиях.
3.7 референтный материал (reference material): Образец сравнения для оценки точности результатов при проведении испытаний на устойчивость к проникновению бактерий при трении во влажных условиях.
3.8 устойчивость к проникновению бактерий во влажной среде (resistance to wet bacterial penetration): Устойчивость защитного материала к проникновению бактерий, переносимых донором, при воздействии механического трения во влажных условиях.
3.9 бактериальное заражение (bacterial challenge): Количество спор на мл суспензии Bacillus atrophaeus, используемой для инокуляции донора.
3.10 бактериальный инокулюм (bacterial inoculum): Суспензия спор Bacillus atrophaeus с верифицированной концентрацией.
Примечание 1 — Концентрация составляет от 5,0 • 103 до 1,5 • 104 спор/мл.
4 Сущность метода
Лист материала донора того же размера, что и испытуемый образец, содержащий бактерии, помещают на испытуемый образец зараженной стороной вниз и накрывают листом защитной пленки из полиэтилена высокой плотности. Два концентрических конических металлических кольца, плотно прилегающих друг к другу, удерживают три листа вместе (далее — конструкция). Эту конструкцию помещают на чашку с агаровой средой со стальными кольцами, свободно свисающими через края и прикладывающими растягивающую нагрузку. Износоустойчивый щуп помещают на переднюю поверхность материала с определенной силой для того, чтобы исследуемый образец контактировал с поверхностью агара. Щуп перемещают по всей поверхности чашки менее чем за 15 мин посредством поворотного рычага, приводимого в движение экзоцентрическим кулачком. Конструкция из материалов, растягиваемая весом стальных колец, гарантирует, что в любой момент времени только маленькая область исследуемого образца контактирует с поверхностью агара. Из-за совместного влияния трения и жидкостной миграции бактерии могут проходить из материала донора через исследуемый образец вниз на поверхность агара.
Испытание длится 15 мин. Через 15 мин чашку с агаровой средой заменяют на новую и испытание повторяют с той же конструкцией, то есть с тем же донором и исследуемым образцом. Пять последовательных испытаний выполняют с одной и той же конструкцией, что позволяет оценить степень проникновения с течением времени.
Оценка бактериальной контаминации на верхней стороне исследуемого образца и бактериальной нагрузки, оставшейся на материале донора, может быть определена с использованием той же методики.
Чашки с агаровой средой инкубируют для того, чтобы вырастить бактериальную колонию, которую затем регистрируют.
Результаты испытания выражаются в процентах проникновения от бактериальной нагрузки, первоначально привитой донору.
Если испытуемый материал содержит антимикробное вещество, его следует инактивировать до проведения испытания. Если инактивировать антимикробное вещество невозможно или если есть только предположение, что материал содержит антимикробное вещество, следует дополнительно определить остаточную антибактериальную активность. В отчет должна быть включена информация о любом воздействии антимикробных веществ, результаты испытания на проникновение и дополнительного испытания.
5 Оборудование, реагенты и материалы
Используют обычное лабораторное оборудование, реактивы и материалы, а также приведенные ниже.
Реагенты должны иметь качество, подходящее для проведения анализа, и/или быть пригодными для микробиологических целей.
Одноразовое оборудование/материалы/приборы являются приемлемой альтернативой многоразовой стеклянной посуде и пластику, если они имеют необходимые технические характеристики.
5.1 Шкаф биологической безопасности II класса.
5.2 Инкубаторы, способные поддерживать температуру (56 ± 2) °C и (37 ± 2) °C.
5.3 Холодильник, способный поддерживать температуру (5 ± 3) °C.
5.4 Водяная баня, способная поддерживать температуру (45 ± 2) °C.
5.5 Суспензия бактериального штамма — очищенные споры Bacillus atrophaeus АТСС 9372, суспендированные в 90 %-ном этиловом спирте в концентрации 109 спор/мл1); Могут использоваться другие титры, однако максимальная концентрация этанола после разбавления должна составлять менее 0,02 %.
5.6 Очищенная вода, свежедистиллированная, и/или деионизированная, и/или ультрафильтрованная, и/или отфильтрованная с помощью реверсного осмоса, не содержащая каких-либо токсичных или бактериальных ингибиторов роста бактерий.
5.7 Пептонная вода — 10 г пептона, 5 г NaCI и 1 г полисорбата 80, доведенных очищенной водой до 1000 мл2, стерилизуют паром в течение 15 мин при температуре автоклава (1210+3) °C.
5.8 Агар с триптоном, глюкозой и дрожжевым экстрактом (TGEA) — 3 г говяжьего экстракта, 5 г триптона, 1 г декстрозы, 15 г агара в очищенной воде, доведенных очищенной водой до 1000 мл2, стерилизуют паром в течение 15 мин при температуре (1210+3) °C (см. приложение А).
5.9 Чашки Петри — стерильные, диаметром 14 и 9 см, с крышкой.
5.10 Материал донора — пять кусков полиуретановой пленки размером около 25 см х 25 см на силиконизированной бумаге-носителе; толщина пленки от 25 до 30 мкм, каждый кусок упакован в стерилизационный пакет и стерилизован паром при температуре (1210+3) °C в течение 15 мин2\
Примечание — Руководство по выбору подходящего материала донора: смачиваемая, литая растворителем полиуретановая пленка толщиной 25 мкм (максимум 30 мкм), нанесенная на силиконизированную бумагу-носитель. Материал имеет плотность 1,12 г/см2 (согласно ИСО 1183-1, Метод А), твердость (по Шору А) 87 ± 1 (согласно ИСО 7619-1), температуру плавления от 160 °C до 175 °C (по Кофлеру), прочность на разрыв (40 ± 10) МПа (измеряется на пленках толщиной 50 мкм, измерение по ИСО 527-1, ИСО 527-3) и относительное удлинение при разрыве (500 ± 125) % (измеряется на пленках толщиной 50 мкм, измерение по ИСО 527-1, ИСО 527-3).
5.11 Защитная пленка — пять кусков пленки из полиэтилена высокой плотности -25 см х 25 см или -25 см в диаметре, толщиной (12 ± 2) мкм, плотностью (0,95 ± 0,095) г/см3)>4\
Примечание — Если испытания также проводят для оценки бактериального загрязнения на верхней стороне испытуемого образца и/или бактериальной нагрузки, оставшейся на материале донора, необходимы один или два дополнительных образца (см. раздел 7 приложения D).
5.12 Референтный материал, «400.1.0.6 — ISO 22610 Референтный материал»3 4).
- переплетение: полотняное, изготовленное из полиэстера;
- вес ткани: (110—120) г/м2;
- отделка: без химической обработки;
- окрашивание: не окрашено;
- воздухопроницаемость: -10 мм/с при 0,1 кПа в соответствии с ИСО 9237:1995;
- удельное поверхностное сопротивление: максимум 1 011 Ом в соответствии с DIN 54345-1:1992;
- стерилизуется паром.
Также может быть использован аналогичный референтный материал, если доказано, что проникновение бактерий во влажной среде находится в том же диапазоне, а прецизионность метода испытаний с использованием альтернативного материала по меньшей мере равна или имеет более высокую точность по сравнению с референтным материалом, указанным в настоящем стандарте.
5.13 Дозаторы вместимостью 1 и 10 мл.
5.14 Дозаторы вместимостью 100 и 1000 мкл, с подходящими стерильными наконечниками.
5.15 Стерильные пробирки для разведения вместимостью 10 мл.
5.16 Шпатель — Г-образной или треугольной формы с горизонтальной стороной 3 см.
5.17 Образцы для проведения испытания — пять кусков защитного материала, подлежащего испытанию, -25 см х 25 см или диаметром примерно 25 см.
6 Испытательное оборудование и комплектующие
6.1 Испытательное оборудование (стенд) и комплектующие приведены в приложении В5).
Схема испытательного оборудования (стенда) приведена на рисунке В.1. Стенд включает в себя поворотный диск с электрическим приводом и таймером, способный удерживать чашку с агаровой средой диаметром 14 см. Горизонтальный рычаг с вертикальным стальным «щупом» на конце установлен на оси, позволяющей поперечное перемещение щупа от центра к периферии вращающейся (60 ± 1) об/мин чашки с агаровой средой и обратно. Противовес может перемещаться по рычагу для регулировки силы, прикладываемой щупом к материалу. Рычаг управляется эксцентриковым кулачком, вращающимся со скоростью (5,6 ± 0,1) об/мин. Стальной щуп, имеющий полированное окончание в виде полусферы радиусом 11 мм, является съемным и должен дезинфицироваться между испытаниями.
Примечание — Из-за истирания окончание стального щупа может стать плоским. Необходимо регулярно проверять, не затупилось ли окончание стального щупа, и при необходимости заменять его.
Сила, прикладываемая щупом к материалу, должна составлять (3 ± 0,02) Н и может быть измерена динамометром, прикрепленным к рычагу, или весами, расположенными на поворотной платформе, с использованием перемещающегося противовеса (см. приложение В).
Исследуемый материал должен контактировать с агаром только в одной точке в любой момент времени. То, что щуп перемещается по всей поверхности, должно регулярно контролироваться с помощью метода, описанного в приложении С. Должны быть сделаны записи, подтверждающие правильность выполнения испытания.
6.2 Цилиндрическая нагрузка из нержавеющей стали или другого подходящего материала, пригодного для стерилизации, — примерно 9 см в диаметре и 4 см высотой.
6.3 Конические стальные кольца, общей массой (800 ± 1) г, — для фиксации конструкции из испытуемых материалов (см. приложение В).
6.4 Динамометр, способный измерять силу, — (3,00 ± 0,05) Н.
7 Подготовка чашек с агаром
Для определения наличия бактериальной инфекции на поверхности донора (см. 9.7), проверки концентрации инокулята (см. раздел 8) и контроля окружающей среды (см. 9.7) используют стандартные чашки Петри диаметром 9 см. Для одного испытуемого образца подготавливают следующие чашки с агаровой средой:
- пять чашек Петри диаметром 14 см на одно испытание (см. 9.2);
- одну чашку Петри диаметром 14 см для измерения расстояния от поверхности агара до краев (см. 9.2.2).
Чашки с агаровой средой диаметром 14 см подготавливают на горизонтальной поверхности и заполняют агаром с триптоном, глюкозой и белковым экстрактом (TGEA), приготовленным в соответствии с требованиями приложения А, либо аналогичной средой, приготовленной в соответствии с требованиями производителя, так, чтобы расстояние между поверхностью среды после застывания и верхним краем чашки диаметром 14 см составило (3,0 ± 0,5) мм.
Примечание 1 — Для чашек диаметром 9 см расстояние от поверхности агара до краев не должно составлять (3,0 ± 0,5) мм. Можно использовать установленный в лаборатории соответствующий объем среды.
Примечание 2 — Если проводят более одного испытания, то проверку концентрации инокулята и измерение расстояния от поверхности агара до краев необходимо проводить только один раз, и, следовательно, количество чашек Петри может быть соответственно уменьшено.
У разных поставщиков и/или в разных партиях высота чашек Петри может быть разная. Объем или масса агара, которым каждая чашка будет заполнена до нужного расстояния от краев, должны быть определены заранее путем измерения высоты и диаметра чашки.
Наливают определенное количество TGEA в подходящую стеклянную колбу и стерилизуют при температуре (1210+3) °C в течение 15 мин. При заполнении чашек Петри агаром применяют объемометрические или гравиметрические методы.
Колбы с TGEA можно хранить в холодильнике при температуре (5 ± 3) °C не более трех месяцев, однако предпочтительнее использовать свежеприготовленный агар.
В случае использования несвежеприготовленного TGEA агар повторно разжижают путем нагревания колб в кипящей воде, микроволновой печи или любым другим подходящим способом. Избегают перегрева и прекращают нагрев сразу после того, как среда станет жидкой.
Затем жидкий TGEA охлаждают примерно до температуры 45 °C и выливают в чашки Петри; следят за тем, чтобы на поверхности не было пузырьков воздуха и неровностей. Поверхность затвердевшего агара должна быть как можно более гладкой. Если есть сомнения, следует использовать свежеприготовленный агар.
Каждую чашку оставляют высыхать без крышки при комнатной температуре в шкафу биобезопасности класса II в течение 20 мин. На поверхности агара не должно быть видимой жидкости (конденсата). Чашки закрывают и хранят в шкафу биобезопасности или в чистой, асептической, закрытой пластиковой емкости, используют их в течение (24 ± 4) ч.
8 Бактериальный инокулюм
Подготовка бактериального инокулюма:
- за день до испытания 1 мл исходной суспензии Bacillus atrophaeus (АТСС 9372) 109 спор/мл, хранящейся в холодильнике, разбавляют 9 мл 96 %-ного этанола. Эту 10-кратно разведенную суспензию хранят в холодильнике до следующего дня. Ее концентрацию проверяют путем определения количества жизнеспособных микроорганизмов с использованием стандартных микробиологических методов,
т. е. последовательного разведения суспензии в пептонной воде и нанесения 100 мкл в чашки диаметром 9 см, содержащие TGEA;
- чашки инкубируют при температуре (37 ± 2) °C в течение 16—24 ч. Колонии в чашке не должны сливаться;
- в день испытания определяют концентрацию 10-кратной разбавленной суспензии Bacillus atrophaeus путем подсчета выросших колоний. В зависимости от полученной концентрации суспензию разбавляют пептонной водой с целью получения конечной концентрации от 5,0 ■ 103 до 1,5 • 104 спор/мл.
Примечание — При необходимости рекомендуется проводить повторную оценку концентрации 10-крат-ной разбавленной суспензии в течение нескольких последующих дней.
9 Порядок проведения испытания
9.1 Общие положения
Перед началом испытания все лабораторные поверхности должны быть продезинфицированы спороцидным дезинфицирующим средством и высушены.
Процедуру следует проводить в асептических условиях. Для засева чашек Петри рекомендуется использовать шкаф биобезопасности.
Примечание — Если испытания также проводятся для оценки бактериального загрязнения на верхней стороне испытуемого образца и/или бактериальной нагрузки, оставшейся на материале донора, необходимы одна или две дополнительные чашки Петри (см. раздел 7 и приложение D).
9.2 Подготовка чашек диаметром 14 см с агаровой средой
9.2.1 Высушивание чашекВ день испытания проверяют 14-сантиметровые чашки с агаром на предмет наличия воды в самой чашке и/или крышке. При наличии конденсата открывают 14-сантиметровые агаровые чашки и дают им подсохнуть в шкафу биобезопасности до тех пор, пока капли конденсата не испарятся. Перед их закрытием убеждаются, что конденсат отсутствует.
9.2.2 Определение расстояния от поверхности агара до края чашки
Открывают одну чашку для определения расстояния от поверхности агара до краев: помещают бритвенное лезвие толщиной (0,10 ± 0,01) мм на поверхность агара, а поперек чашки кладут стальную линейку (см. рисунок 1). Расстояние между линейкой и лезвием измеряют с помощью штангенциркуля (см. рисунок 1). Измеряют расстояние в пяти точках поверхности. Среднее расстояние должно составлять (3,0 ± 0,5) мм. Расстояние должно быть определено для каждой партии одновременно заполненных чашек.
Примечание — Острые края лезвия бритвы должны быть затуплены перед использованием.

Рисунок 1 — Измерение расстояния от поверхности агара до краев
9.3 Заражение донора
Для инокуляции донора используют суспензию Bacillus atrophaeus (см. раздел 8), разведенную пептоновой водой в пределах от 5,0 • 103 до 1,5 • 104 спор/мл.
Обработку и подготовку материала донора проводят в стерильных перчатках. Перчатки должны меняться после каждого следующего этапа процедуры, чтобы избежать переноса бактериальных спор.
а) Стерилизованный пакет с материалом донора открывают в асептической среде. Пленку донора держат на бумажной подложке и помещают на дезинфицированную рабочую поверхность (см. рисунок 2) так, чтобы бумажная сторона была обращена вниз, а пленка, покрытая спорами, — вверх. Маркером отмечают на доноре область инокуляции, соответствующую площади чашки с агаровой средой.
Дозатором вместимостью 1000,0 мкл по отмеченной области равномерно распределяют 1 мл суспензии Bacillus atrophaeus. Инокулюм распределяют шпателем (см. 5.16). После распределения пленка формируется не сразу, но по всей поверхности образуются мелкие капли (см. рисунок 2).
Сразу после инокуляции донора оставшийся инокулят помещают на лед.
Ь) Донор высушивают в инкубаторе при температуре 56 °C примерно в течение 30 мин до полного высыхания, при этом суспензию Bacillus atrophaeus наносят на донора каждые 2 мин для обеспечения равномерного распределения (см. рисунок 2).
Примечание 1 — Из-за того, что инкубатор каждые 2 мин открывают, температура 56 °C будет немного снижаться во время сушки. Цель — получить равномерное распределение спор при температуре в инкубаторе не выше 56 °C.
Примечание 2 — Чтобы избежать потери спор, между повторениями распределения (каждые 2 мин) шпатель можно хранить на держателе так, чтобы верхняя часть шпателя соприкасалась со спорами. Контакта той части шпателя, что соприкасается со спорами, с любой поверхностью, на которой споры могут быть потеряны (например, с дном мензурки), избегают.
Донор должен быть использован сразу после высыхания.
9.4 Материал для исследования
Размер образца, используемого в испытании, должен составлять примерно 25 см х 25 см или приблизительно 25 см в диаметре.
Каждый используемый образец должен быть индивидуально упакован и стерилизован, например паром или окисью этилена, в соответствии с рекомендациями поставщика.
В случае если испытательная лаборатория обрабатывает, подготавливает и проводит испытания на нестерилизованных материалах, в сопроводительной документации должно быть отражено, были ли стерилизованы образцы перед испытанием, и если да, то какой метод стерилизации использовался.
Изготовителем материала должна быть указана сторона, которая будет контактировать с инокулированным донором. Если это не указано на маркировке или в инструкции по применению, то испытание проводится на внешней стороне халата или простыни (т. е. на стороне, которая не контактирует с носителем/пациентом).
Испытание проводят на пяти образцах: каждый образец пять раз вводят в контакт с новой чашкой с агаровой средой диаметром 14 см в течение 15 мин.
Примечание 1 — Тканые материалы часто стерилизуют при температуре (134о+3) °C в течение 4 мин. Нетканые материалы, как правило, стерилизуют этиленоксидом. Использование этиленоксида запрещено во многих странах при производстве пищевых продуктов.
Примечание 2 — Предпочтительно, чтобы материалы для проведения испытания доставлялись в готовом виде и были стерилизованы.
9.5 Подготовка испытательного оборудования
Для частичного отделения по одному или двум краям полиуретановой пленки донора от бумажного листа используют стерильные щипцы или пинцет. Донор, все еще находящийся с пленкой на бумажной подложке, помещают инокулированной стороной вниз на образец ткани. Полиуретановую пленку удерживают за один или два края и крепят на текстиль вручную. Бумажный носитель аккуратно снимают и выбрасывают. Защитную пленку (из полиэтилена высокой плотности) помещают поверх полиуретановой пленки для завершения сбора конструкции для проведения испытания (см. рисунок 2).

Примечание — Периодическое распределение шпателем во время сушки при температуре 56 °C приводит к равномерному распределению спор.
а) Споровая суспензия капельно распределяется по отмеченному участку инокуляции на поверхности донора

Ь) Полиуретановый материал частично отделяется от бумажной подложки по одному или двум краям с помощью стерилизованных щипцов

Примечание — Бумажная подложка с задней стороны донора удаляется.
с) Высушенный донор кладут покрытой спорами стороной, на которой находится полиуретановая пленка, вниз на ткань, подлежащую испытанию
Рисунок 2 — Инокуляция донора и подготовка конструкции для проведения испытания
9.6 Проведение испытания
Силу (3,00 ± 0,05) Н, прикладываемую при помощи щупа к материалам, необходимо проверять не реже одного раза в день перед началом подготовки к испытанию и при необходимости корректировать при помощи динамометра (см. рисунок В.З).


а) Металлические конические кольца со стерильным цилиндрическим предметом
Ь) Образец на металлических конических кольцах и стерильном цилиндрическом объекте

с) Конструкция из образца, донора и полиэтилена высокой плотности на металлических кольцах (все стерильно)
d) Конструкция из образца, донора и полиэтилена высокой плотности, закрепленная между двух колец

е) Конструкция из образца, донора и полиэтилена высокой плотности, закрепленная между двумя кольцами, расположенными над чашкой Петри на поворотном диске, и стальной щуп, помещенный на конструкцию непосредственно на чашку Петри
Рисунок 3 — Подготовка образца для проведения испытания и сборка конструкции из материалов
Первую чашку с агаровой средой вместе с крышкой помещают на поворотный диск.
Внутреннее кольцо из двух металлических конических колец (см. рисунки За) и В.2) помещают на продезинфицированную рабочую поверхность, стерильный цилиндрический предмет — в центр. Устанавливают конструкцию в сборе из образца, донора и полиэтилена высокой плотности [см. 9.5, рисунки ЗЬ) и Зс)] на цилиндрический предмет так, чтобы образец был обращен вниз, а полиэтилен высокой плотности — вверх. Аккуратно помещают отмеченную сторону в центр кольца. Размещают наружное кольцо поверх конструкции, выровняв его с внутренним кольцом, и плотно прижимают наружное кольцо вниз так, чтобы три материала были зажаты вместе и надежно закреплены между двумя кольцами [см. рисунок 3d)]. Снимают крышку с чашки с агаровой средой и, слегка ослабив натяжение материала, помещают кольца поверх чашки с агаровой средой на поворотный круг. Стальные кольца должны свободно свисать с края чашки [см. рисунок Зе)].
Примечание 1 — Из-за того, что цилиндрический предмет, помещенный в центр внутреннего кольца при подготовке испытательного образца, несколько выше, конструкция будет слегка провисать, когда кольца будут подняты с цилиндрического предмета.
Щуп помещают на конструкцию так, чтобы он находился над поверхностью чашки. Испытуемый образец должен касаться поверхности агара. Описанное испытание выполняют в течение 15 мин при давлении, оказываемом щупом, (3,00 ± 0,05) Н.
Скорость вращения поворотного круга должна составлять (60 ± 1) об/мин. Через 15 мин кольца с конструкции, на которой проводят испытание, немедленно снимают и помещают их на продезинфицированную рабочую поверхность. Первую чашку с агаровой средой снимают с поворотного круга и плотно закрывают крышкой. На поворотный круг немедленно устанавливают вторую чашку с агаровой средой, помещают испытательную конструкцию на чашку с агаровой средой, щуп — на конструкцию так, чтобы он находился над поверхностью чашки, и продолжают испытание в течение 15 мин.
Испытания повторяют на той же испытательной конструкции, используя все пять чашек с агаровой средой.
Чашки с агаровой средой высушивают в течение 10 мин на чистой поверхности, предпочтительно под ламинарным воздушным потоком, и инкубируют при закрытых крышках в течение 16—24 ч при температуре (37 ± 2) °C до тех пор, пока рост не станет достаточным для точного подсчета, но колонии в чашке еще не будут сливаться.
Процедуру повторяют для остальных четырех испытуемых образцов, используя свежеприготовленный донор для каждого испытуемого образца.
Устройство, включая щуп, кольца и рабочие поверхности, должно быть очищено спорицидным средством до проведения испытания.
Примечание 2 — Если, например, для исследовательских целей и/или разработки материала необходимо провести оценку бактериального загрязнения, оставшегося на верхней стороне испытуемого образца и на доноре, применяют процедуру испытания, приведенную в приложении D.
9.7 Контроль качества испытаний
9.7.1 Контроль состояния окружающей средыОткрытую чашку Петри диаметром 9 см с агаровой средой TGEA или аналогичной помещают в инкубатор при температуре 56 °C на время сушки донора.
Открытую чашку Петри диаметром 9 см с агаровой средой TGEA или аналогичной средой помещают на испытательное оборудование на все время испытания одного образца (см. рисунок 3).
Испытание одного образца заканчивается после того, как образец удаляют из пятой чашки с агаровой средой.
Чашки инкубируют при температуре (37 ± 2) °C в течение 16—24 ч. Если колонии не видны, чашки инкубируют при температуре (37 ± 2) °C еще от 16 до 24 ч.
Примечание — Может потребоваться более 24 ч для инкубирования спор, чтобы сформировать видимые колонии.
Количество колоний в контрольных чашках должно быть <4 в инкубаторе и <25 в течение всей продолжительности испытания.
9.7.2 Контроль концентрации инокулюма
Подсчет количества жизнеспособных микроорганизмов проводят с использованием стандартных микробиологических методов на инокулюме, помещенном на лед, т. е. при помощи последовательного 10
разведения суспензии в пептоновой воде и нанесении 100 мкл в чашки диаметром 9 см, содержащие TGEA или аналогичную среду. Суспензия должна быть в достаточной степени разбавлена, чтобы обеспечить точный подсчет колоний в конечной чашке.
Чашки инкубируют при температуре (37 ± 2) °C в течение 16—24 ч, пока рост не станет достаточным для точного подсчета, но колонии в чашке еще не будут сливаться.
Бактериальное контрольное заражение «/» определяют, по крайней мере, в трех параллельных испытаниях доноров и выражают результат в количестве колоний/мл инокулята.
10 Оценка
10.1 Необходимые условия для валидированного исследования
- Коэффициент проницаемости бактерий во влажной среде [Р (%)] референтного материала должен регулярно определяться и отражаться в документации в соответствии с системой менеджмента качества, в которой обосновывают частоту испытаний.
- Коэффициент проницаемости бактерий во влажной среде [Р (%)] референтного материала должен находиться в диапазоне от 0,64 % до 3,04 %.
- Требования к оборудованию:
- скорость вращения чашки с агаровой средой (60 ± 1) об/мин;
- рычаг управляется эксцентриковым кулачком, вращающимся со скоростью (5,6 ± 0,1) об/мин;
- стальной щуп, имеющий полированное окончание в виде полусферы радиусом 11 мм, является съемным;
- сила (3,00 ± 0,05) Н, оказываемая стальным щупом на материалы, регулируется скользящим грузом.
- Расстояние от поверхности агара до краев составляет (3,0 ± 0,5) мм и определяется для каждой партии чашек, заполняемых вместе.
- Концентрация инокулюма от 5,0 ■ 103 до 1,5 • 104 спор/мл.
- Максимальное поддающееся счету число колоний в чашке диаметром 14 см с агаровой средой составляет 760 колоний.
- Если количество колоний в какой-либо из пяти чашек, используемых в испытании, не может быть подсчитано, то коэффициент проникновения невозможно рассчитать.
- Если при испытании материала в чашках наблюдается чрезмерный рост колоний (>760), бактериальная нагрузка должна быть снижена до тех пор, пока число колоний не достигнет <760, но бактериальная нагрузка будет составлять не менее 5 000 спор/мл. Если в чашках по-прежнему наблюдается чрезмерный рост колоний (>760), то этот метод испытания неприменим к данному материалу, поскольку соотношение бактериального контрольного заражения и пропущенных материалом бактерий не сбалансировано.
Примечание 1 — Чрезмерный рост колоний в чашках может быть признаком низкой эффективности защиты.
Примечание 2 — Некорректные результаты испытания могут быть сообщены только для сведения. Особенно целесообразно сообщать дополнительно сведения о причине, по которой результат испытания признан некорректным.
10.2 Определение количества колоний Bacillus atrophaeus
Количество колоний Bacillus atrophaeus подсчитывают в каждой чашке, задействованной в испытании. Не учитывают область радиусом 15 мм вокруг центра чашки. Количество колоний в чашках, в которых наблюдается чрезмерный рост и большое количество сливающихся колоний, не может быть подсчитано, и такие чашки должны быть исключены из рассмотрения (см. 10.1). Подсчет может осуществляться визуально или с помощью автоматического счетчика колоний при условии, что установлена корреляция между визуальным и автоматическим подсчетом.
11 Обработка результата
Процент проникновения Рп с точностью до трех знаков для каждого испытуемого образца вычисляют по формуле
где Р — процент проникновения для каждого использованного в испытании образца п;
S — общее количество подсчитанных колоний в пяти чашках, без учета области радиусом 15 мм вокруг центра чашки;
/ — бактериальное контрольное заражение донора спорами Bacillus atrophaeus, определяемое как количество бактерий/1 мл инокулюма в соответствии с 9.7.2.
Средний коэффициент проникновения Р, %, рассчитывают для всех пяти образцов.
Примечание — Проникновение одной споры и бактериальное контрольное заражение донора в объеме 15 000 спор дает коэффициент проникновения 0,006 7 %. Точность определения коэффициента проникновения составляет 0,01 %.
Пример — Коэффициент проникновения с точностью до трех знаков: 12,1 %, 1,21 %, 0,12 %, 0,01 %.
12 Прецизионность
12.1 Стандартный образец
Прецизионные данные были определены путем исследования тканого референтного материала.
Среднее................................................................1,84 Р (%)
Стандартное отклонение .........................................0,60 Р (%)
95,4 % доверительный интервал...............................от 0,64 до 3,04 Р (%)
Количество измерений N..........................................35
12.2 Материал образцов
Прецизионные данные были определены путем исследования тканого референтного материала и четырех коммерческих материалов: двух тканых и двух нетканых.
Исследование показало различный коэффициент проникновения бактерий во влажной среде Р (%) для каждого материала с различной прецизионностью, в результате чего пять испытанных материалов не могут считаться репрезентативными для материалов, которые представлены в продаже в настоящее время. Из-за того, что были выявлены различные показатели Р (%) и соответствующие им различные уровни прецизионности, в настоящем стандарте на основе имеющихся данных не может быть приведено однозначное заявление о прецизионности метода относительно всех материалов (см. приложение F). В настоящее время проводятся исследования по дальнейшему улучшению воспроизводимости этого метода испытаний.
13 Отчет об испытании
Отчет об испытании должен содержать по меньшей мере следующую информацию:
а) ссылка на настоящий стандарт, т. е. ИСО 22610:2018;
Ь) всю информацию, необходимую для полной идентификации испытуемого образца;
с) результаты мониторинга производительности в соответствии с приложением С;
d) условия испытания: температура и влажность;
е) расстояние от поверхности агара до краев чашки Петри;
f) подсчеты числа колоний отдельно в каждой чашке;
д) процент проникновения для каждого использованного в испытании образца;
h) средний коэффициент проникновения Р(%) всех пяти образцов;
i) номер штамма;
j) концентрация инокулюма;
к) любое отклонение от метода испытаний, указанного в настоящем стандарте, должно быть отражено в отчете и обосновано.
Приложение А (обязательное)
Питательные среды
А.1 Агар с триптоном, глюкозой и белковым экстрактом (TGEA)
Говяжий экстракт — 3 г.
Триптон — 5 г.
Декстроза — 1г.
Агар — 15 г.
Дистиллированная вода — 1000 мл.
Сухие ингредиенты разбавляют в воде и нагревают, помешивая до растворения и равномерного распределения. Стерилизуют при температуре (1210+3) °C в течение 15 мин, тщательно перемешивают и распределяют по емкостям.
После стерилизации pH должен составлять 7,0 ± 0,25. Если pH среды после стерилизации выходит за пределы диапазона, ее утилизируют и подготавливают новую партию.
Рекомендуется использовать промышленно изготовленный подходящий TGEA. Качество TGEA может варьироваться. TGEA низкого качества приводит к тому, что в процессе проведения испытания на поверхности чашек Петри появятся трещины, выбоины или вмятины.
А.2 Пептонная вода
Пептон — 10 г.
Хлорид натрия — 5 г.
Полисорбат 80 — 1 г.
Дистиллированная вода — 1000 мл.
Сухие ингредиенты разбавляют в воде и нагревают, помешивая до растворения и равномерного распределения. Стерилизуют при температуре (1210+3) °C в течение 15 мин.
Приложение В (обязательное)
Испытательное оборудование (стенд) и комплектующие
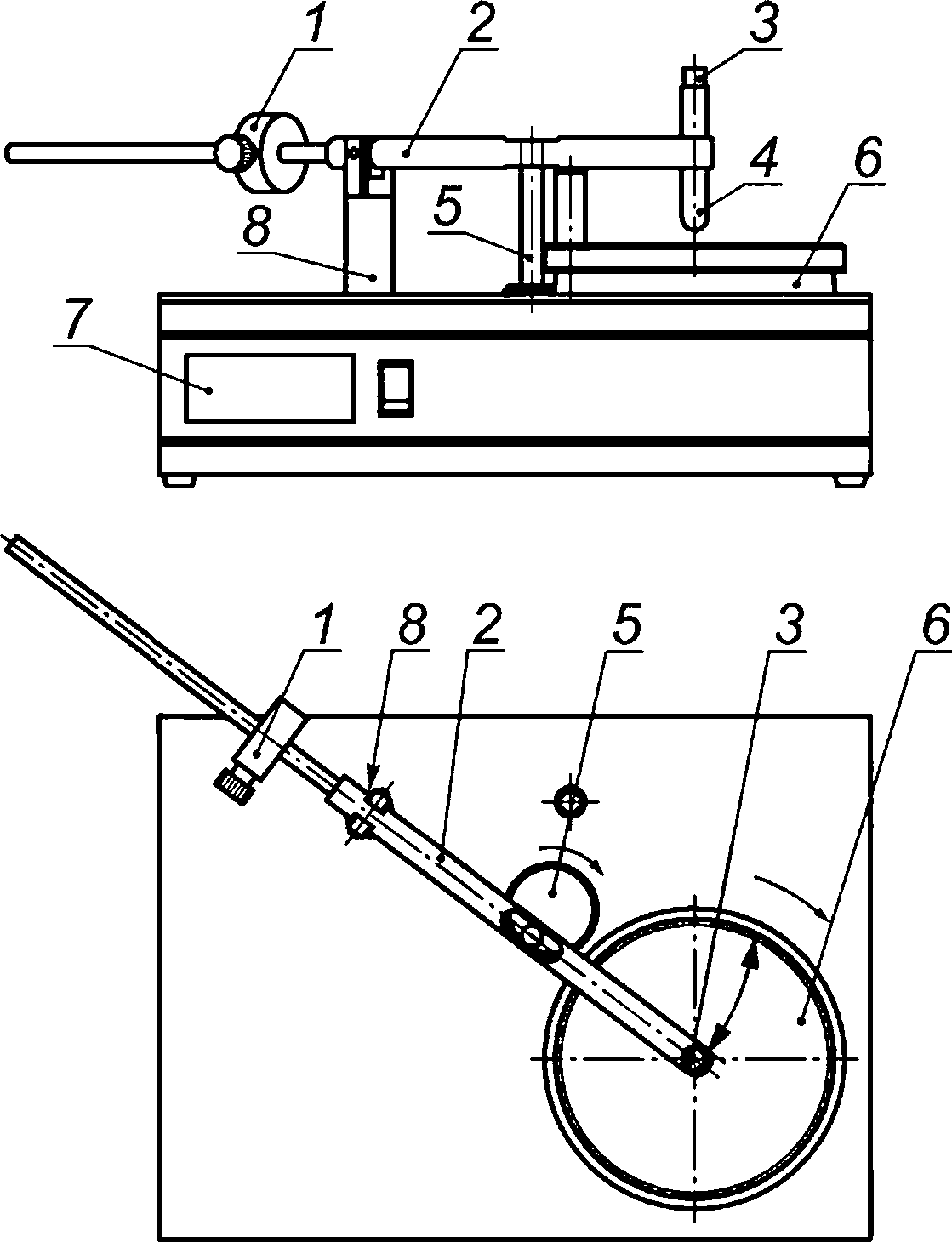
1 — противовес; 2 — рычаг балансира с щупом; 3 — петля для пружинных весов/динамометра; 4 — щуп из нержавеющей стали; 5 — экзоцентрический кулачок; 6 — поворотный круг; 7 — электронный таймер; 8 — шарнирная опора
Рисунок В.1 — Схема испытательного оборудования (стенда)
Конические стальные кольца (см. рисунок В.2) должны иметь общий вес (800 ± 1) г для фиксации конструкции из испытуемых материалов.
Размеры в миллиметрах
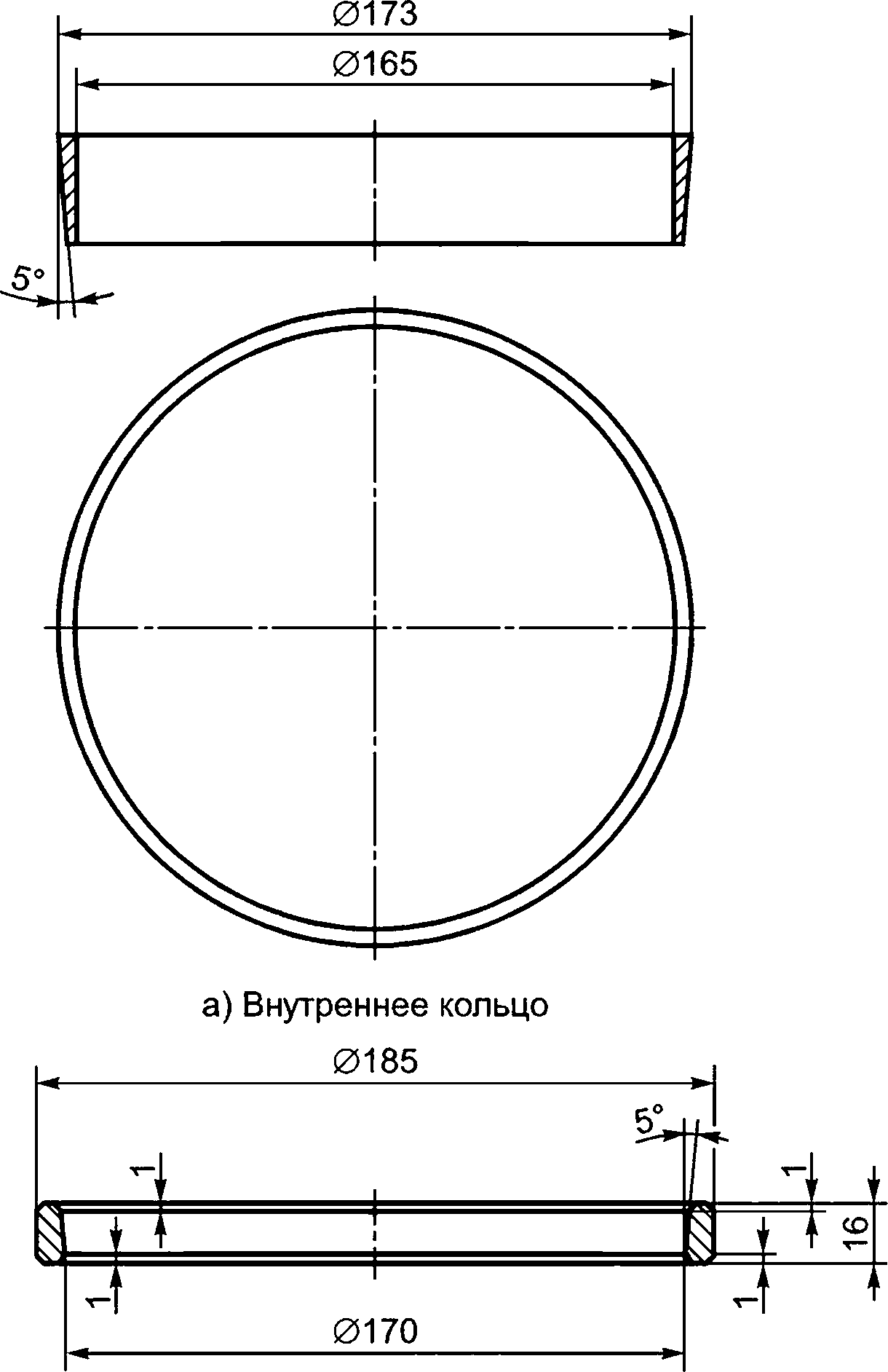
Ь) Внешнее кольцо
Рисунок В.2 — Конические стальные кольца для фиксации конструкции из материалов
Сила (3,00 ± 0,05) Н, прикладываемая при помощи щупа к материалам, должна проверяться не реже одного раза в день перед началом подготовки к испытанию и при необходимости корректироваться.
Силу, прикладываемую стальным щупом к материалу, измеряют динамометром, прикрепленным к рычагу, или весами, расположенными на поворотном круге. При необходимости силу регулируют смещением груза на рычаге (см. рисунок В.З).

Рисунок В.З — Регулировка силы, с которой щуп воздействует на чашку с агаровой средой
Приложение С (обязательное)
Оборудование и мониторинг производительности лаборатории
С.1 Общие положения
Для оценки производительности работы лаборатории используют два нижеприведенных метода. Программа мониторинга производительности должна быть описана в документах, а также должна быть зафиксирована дата последней ее оценки.
С.2 Мониторинг оборудования
Используя стальные кольца, описанные в приложении В, подготавливают конструкцию, состоящую из одного листа белой бумаги, одного листа копировальной бумаги и одного листа полиэтиленовой пленки высокой плотности. Помещают нижнюю часть чашки Петри диаметром 14 см, перевернув ее, на поворотную платформу, конструкцию устанавливают на нее, как описано в 9.6. Прикладывают щуп к полиэтиленовой пленке высокой плотности и запускают прибор на 15 мин. Извлекают белую бумагу и убеждаются, что щуп имел равномерный контакт с образцом по всей поверхности чашки.
С.З Мониторинг деятельности лаборатории
Точность выполнения работ в лаборатории контролируют путем одновременного испытания анализируемого и референтного материала, указанного в 5.12, методом испытания, приведенным в настоящем стандарте. Частота проверок должна соответствовать ISO/IEC 17025. Это должно позволить лаборатории проверять точность и объективность ее сотрудников. Невозможно делать какие-либо выводы о методе испытания без проведения дальнейших межлабораторных сличительных испытаний. Референтный материал должен быть упакован в стерильные контейнеры, соответствующие ИСО 11607-1, и стерилизован влажным теплом при температуре (1340+3) °C в течение 4—5 мин в соответствии с ИСО 17665-1.
Приложение D (справочное)
Оценка бактериальной контаминации на верхней стороне исследуемого образца и бактериальной нагрузки, оставшейся на доноре
D.1 Общие положения
Предметом настоящего стандарта является оценка проникновения бактерий во влажной среде, выраженная в процентах от бактериальной нагрузки исследуемого образца.
Если, например, для исследовательских целей и/или разработки материала необходимо оценить бактериальную нагрузку, оставшуюся на верхней стороне испытуемого образца, и нагрузку, оставшуюся на исследуемом образце, то следует применить следующую процедуру.
D.2 Подготовка дополнительных чашек Петри
Если после пяти последовательных испытаний на испытуемом образце проводят дополнительные испытания для оценки оставшейся бактериальной нагрузки на его верхней стороне и бактериальной нагрузки, оставшейся на материале донора (см. 9.6), то для одного полного испытания необходимо подготовить дополнительно две чашки Петри диаметром 14 см.
D.3 Процедура
а) Испытательную установку разбирают, из нее в асептических условиях извлекают донора и помещают в пустую стерильную чашку Петри для определения бактериальной нагрузки, оставшейся на нем.
Ь) Образец, задействованный в испытании, переворачивают вверх дном на внутреннем стальном кольце, материал накрывают новой пленкой из полиэтилена высокой плотности, конструкцию закрепляют между стальными кольцами.
с) В течение 15 мин выполняют в описанном выше порядке исследование, используя шестую чашку с агаровой средой.
d) Испытательную установку разбирают, из нее извлекают испытательный образец и помещают в нее донор загрязненной стороной вниз на внутреннее кольцо. Донор накрывают пленкой из полиэтилена высокой плотности, конструкцию закрепляют между стальными кольцами.
е) В течение 15 мин выполняют в описанном выше порядке исследование, используя седьмую чашку с агаровой средой.
f) Чашки с агаровой средой высушивают в течение 10 мин на чистой поверхности, предпочтительно под ламинарным воздушным потоком, и инкубируют при закрытых крышках в течение 16—24 ч при температуре (37 ± 2) °C до тех пор, пока рост не станет достаточным для точного подсчета, но колонии в чашке еще не будут сливаться.
д) Процедуру повторяют для остальных четырех испытуемых образцов.
Устройство, включая щуп, кольца и рабочие поверхности, должно быть очищено спорицидным средством до проведения испытания.
Приложение Е (справочное)
Передача инфекционных агентов во время инвазивных хирургических манипуляций
Приведенный в настоящем стандарте метод проведения испытания на проникновение бактерий во влажной среде определяет устойчивость материала к проникновению бактерий через рабочий материал путем комбинированного воздействия трения, давления и смачивания. Давление и механическое трение предназначены для имитации давления, которое может возникнуть во время хирургических и других инвазивных процедур — например, при движениях локтя хирурга во время процедуры. Из-за совместного воздействия давления и трения жидкость проникает вверх на поверхность агара, а бактерии могут проходить из материала донора через исследуемый образец вниз на поверхность агара.
Существует несколько возможных каналов передачи инфекционных агентов во время инвазивных хирургических вмешательств.
- Хирургические простыни, в том числе предназначенные для использования в стерильном поле, и хирургические халаты используют для того, чтобы снизить проникновение инфекционных агентов в операционные раны пациентов и из них, тем самым помогая предотвратить послеоперационные раневые инфекции.
Характеристики, которым должны удовлетворять материалы, используемые для пациентов, клинического персонала и оборудования, зависят, например, от типа и продолжительности процедуры, влажности в операционном поле, степени механической нагрузки на материалы и восприимчивости пациента к инфекции.
- Хирургические халаты используют для того, чтобы уменьшить передачу инфекционных агентов между пациентами и клиническим персоналом во время хирургических и других инвазивных процедур. Таким образом, хирургические халаты способствуют стабильности клинического состояния пациентов и защищают их безопасность, а также безопасность и здоровье тех, кто их носит.
Использование хирургических халатов, устойчивых к проникновению жидкостей, также может снизить риск заражения операционного персонала инфекционными агентами, переносимыми в крови или жидкостях организма.
Производитель продукта должен определить сторону материала, которая должна контактировать с инокулированным донором, в зависимости от его целевого назначения.
Приложение F (справочное)
Прецизионность исследований на проникновение бактерий во влажных условиях
В исследовании прецизионности приняли участие четыре лаборатории, которые проанализировали 5 образцов медицинских халатов — три из тканых материалов, из которых один был референтным, и два из нетканых. Каждый материал был подвержен испытанию пять раз, что привело к получению 100 наблюдаемых показателей коэффициента проникновения бактерий во влажной среде, Р (%).
Исследование показало различный коэффициент проникновения бактерий во влажной среде Р (%) для каждого материала с различной прецизионностью, в результате чего пять испытанных материалов не могут считаться репрезентативными для материалов, которые представлены в продаже в настоящее время. Из-за того, что были выявлены различные показатели Р (%) и соответствующие им различные уровни прецизионности, в настоящем документе на основе имеющихся данных не может быть приведено реалистичное и единообразное заявление о прецизионности метода относительно всех материалов.
Все данные (л = 100) были рассмотрены в совокупности и проанализированы на наличие отклонений в зависимости от того, в каком диапазоне находился коэффициент проникновения бактерий во влажной среде (WBP) (см. таблицы F.1, F.2 и рисунок F.1). Были выделены следующие диапазоны WBP: от 0 % до <1 %, от 1 % до <2 %, от 2 % до <4 %, от 4 % до <8%, >8 %.
Таблица F.1 — Распределение данных измерений Р (%) по диапазонам
Диапазон Р (%) | Выборка п | Среднее | Стандартное отклонение |
от 0 до <1 | 19 | 0,387 | 0,281 |
от 1 до <2 | 18 | 1,56 | 0,313 |
от 2 до <4 | 25 | 2,94 | 0,623 |
от 4 до <8 | 17 | 5,62 | 1,27 |
>8 | 21 | 16,4 | 4,54 |
Таблица F.2 — Коэффициент точности для расчета верхнего предела измеренного коэффициента проникновения бактерий во влажной среде (доверительный интервал 99,7 %)
Диапазон | Диапазон WBP Р (%) | Коэффициент точности |
1 | от > 0 до <2 | f= нет данных, UL = 3,2 %а |
2 | от 2 до <12 | f= 1,76 |
3 | от 12 до <22 | 7=2,04 |
4 | от 22 до <32 | 7=2,33 |
5 | >32 | f= 3,46 |
а Для среднего значения Р (%) в диапазоне от >0 % до <2 % верхний предел Р (%) считается равным 3,2 % (см. приложение F). | ||
Как следствие того, что интервал точности метода WBP увеличивается с ростом коэффициента WBP, стандартное отклонение значительно увеличивается по модулю с увеличением значений WBP, как показано на рисунке 1.
Для значений WPB выше 2 Р (%) стандартное отклонение не является ни константой, ни линейной функцией, для которой WBP % является переменной, но функция эта растет с увеличением коэффициента. Для расчета верхнего предела Р (%) при пятикратном измерении и доверительном интервале 99,7 % (3 сигмы) возрастающее расчетное стандартное отклонение ос можно описать формулой
ос = 0,0077 ■ х2 + 0,148 3 • х + 0,051 3, где стс — рассчитанное стандартное отклонение, используемое для расчета верхнего предела, основанное на доверительном интервале 99,7 % (3 сигмы);
х— измеренный средний коэффициент проникновения Р (%).
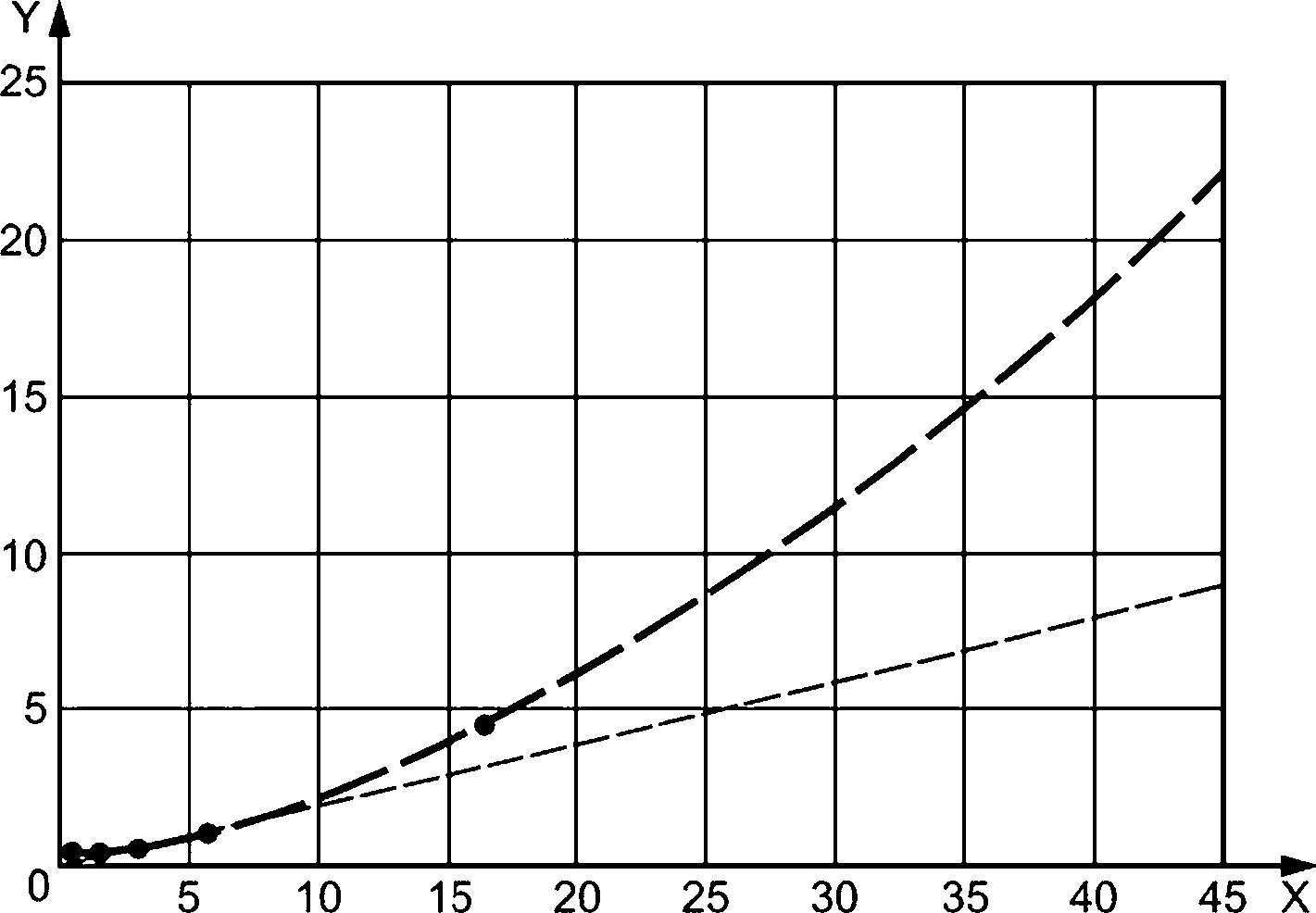
X — WBP, %; Y — стандартное отклонение; • — измеренное стандартное отклонение;-----— ожидаемое стандартное
отклонение;— — — измеренное стандартное отклонение
Рисунок F.1 — Стандартное отклонение метода испытаний на определение WBP в зависимости от Р (%)
Для значений WBP ниже 2 Р (%) расчет стандартного отклонения по приведенной выше формуле неприменим. Для диапазона >0 до 2 Р (%) вариация относительно велика из-за низкой степени проникновения и точности измерений. Небольшие абсолютные различия в (очень) низком диапазоне Р (%) оказывают очень большое влияние на стандартное отклонение и вместе с тем не влияют на точность, приводя к большому разбросу результатов. Для диапазона от 0 до 2 Р (%) «коэффициент точности» f в таблице 2 следует рассматривать как верхний предел значений для этого диапазона.
Пример — Для среднего значения WBP 4,24 %, определенного в результате пяти измерений, вычисленное стандартное отклонение — стс = 0,007 7 • 4,242 + 0,148 3 • 4,24 + 0,051 3 - 9,819 — используется для определения верхней границы с доверительным интервалом 99,7 %. Для определенного среднего значения WBP4,24 % верхний предел диапазона, в котором истинное значение считается с доверительным пределом 99,7 %, составляет 4,24 + 3 ■ 0,819 - 6,70 %.
Примечание — Нижний предел не рассматривается, поскольку он может быть отрицательным, и, что более важно, только верхний предел имеет значение для спецификаций и/или требований.
Точность метода WBP при рассмотрении 5 различных диапазонов, как показано в таблице 1, соответствует коэффициенту точности, который используется для расчета верхнего предела. Среднее значение Р (%) всех 5 образцов можно умножить на коэффициент точности, в результате чего получим верхний предел Р (%) для доверительного интервала 99,7 %.
Относительные высокие верхние пределы могут быть объяснены тем, что стандартное отклонение метода испытаний WBP значительно увеличивается с увеличением коэффециента WBP.
Расчет верхнего предела диапазона, в котором находится истинное значение наблюдаемого Р (%), считается с доверительным интервалом 99,7 %:
а) Средний коэффициент проникновения Р (%) рассчитывают для всех пяти образцов (см. раздел 11).
Ь) Выбирают соответствующий диапазон для определения точности среднего значения коэффициента WBP и исходя из него определяют соответствующий коэффициент точности.
с) Вычисляют верхний предел для диапазона, в котором находится истинное значение с доверительным интервалом 99,7 %, умножив среднее значение коэффициента WBP на коэффициент точности f.
d) Рассчитанный верхний предел коэффициента WBP — это значение, которое следует учитывать в требованиях и/или спецификациях.
Пример — Расчет верхнего предела определяемого значения коэффициента WBP.
1. Среднее значение коэффициента WBP для 5 чашек составляет 13,6 Р (%).
2. Исходя из значения Р (%) 13,6, точность будут определять так, как это делалось для элементов выборки, попавших в диапазон № 3.
3. Соответствующий коэффициент точности равен 2,04.
4. Верхний предел для диапазона, в котором находится истинное значение (доверительный интервал 99,7 %), составляет 13,6 ■ 2,04 = 27,7%.
Учитывая точность упомянутого выше метода, рекомендуется повторное исследование. Количество повторений исследования определяется исходя из требуемого уровня точности и с учетом предусмотренного применения результатов испытания. Под повторением подразумевается проведение полной процедуры испытания.
Для разработки требований, спецификаций и/или межлабораторного сравнения рекомендуется оценка результатов испытаний с использованием логарифмического уменьшения по основанию log10.
Приложение ДА (справочное)
Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам
Таблица ДА. 1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального, межгосударственного стандарта |
ISO 11607-1 | IDT | ГОСТ ISO 11607-1—2018 «Упаковка для медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам» |
ISO/IEC 17025 | IDT | ГОСТ ISO/IEC 17025—2019 «Общие требования к компетентности испытательных и калибровочных лабораторий» |
ISO 17665-1 | IDT | ГОСТ Р ИСО 17665-1—2016 «Стерилизация медицинской продукции. Влажное тепло. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT — идентичные стандарты. | ||
Библиография
[1] ISO 11135, Sterilization of health-care products — Ethylene oxide — Requirements for the development, validation and routine control of a sterilization process for medical devices (Стерилизация медицинской продукции. Этиленоксид. Требования к разработке, валидации и текущему управлению процессом стерилизации медицинских изделий)
[2] EN 12353, Chemical disinfectants and antiseptics — Preservation of test organisms used for the determination of bactericidal, mycobactericidal, sporicidal and fungicidal activity (Химические дезинфицирующие средства и антисептики. Сохранение тест-организмов, используемых для определения бактерицидной, микобактерицидной, спорицидной и фунгицидной активностей)
УДК 57.085.2:006.354
ОКС 13.340.10
Ключевые слова: проникновение бактерий, халаты для чистых помещений, медицинские изделия, костюмы для чистых помещений, защита персонала, защита оборудования, испытания, влажные условия
Редактор М.И. Митрофанова Технический редактор И.Е. Черепкова Корректор М.И. Першина Компьютерная верстка А.Н. Золотаревой
Сдано в набор 05.10.2022. Подписано в печать 11.10.2022. Формат 60x84%. Гарнитура Ариал. Усл. печ. л. 3,26. Уч.-изд. л. 2,95.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «РСТ» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.
1
) Суспензию спор в спиртовой взвеси можно приобрести в SIMICON Gmbh — Munchen. Эта информация представлена для удобства пользователей настоящего стандарта и не является подтверждением торгового названия со стороны ISO [в Российской Федерации возможно использование спор Bacillus atrophaeus из государственных или референтных коллекций микроорганизмов, например, Гэсударственная коллекция патогенных микроорганизмов (ГКПМ) (ФГБУ «НЦЭСМП» Минздрава России) или Государственная коллекция патогенных микроорганизмов и клеточных культур (ГКПМ-Оболенск) (ФБУН «ГНЦ ПМБ» Роспотребнадзора)].
2
) Подходящий материал донора можно приобрести в Gerlinger Industries GmbH, Schwarzhammermuhle, D-08491 Нецшкау, Германия (номер по каталогу: 4220М или 4220). Материал также можно заказать в компании schuett-biotec GmbH, Rudolf-Wissell-Str. 13, D-37079 Гёттинген — в составе набора для проведения испытаний. Эта информация представлена для удобства пользователей настоящего стандарта, не является подтверждением торгового названия со стороны ISO и не исключает возможности использования аналогичных материалов.
3
) Подходящую защитную пленку можно заказать, например, в Mo Industrial АВ, Strakenvagen 3, SE-56576 Боттнарюд, Швеция (номер по каталогу: 1623-001). Материал также можно заказать в компании schuett-biotec GmbH, Rudolf-Wissell-Str. 13, D-37079 — Гёттинген — в составе набора для проведения испытаний. Эта информация представлена для удобства пользователей настоящего стандарта, не является подтверждением торгового названия со стороны ISO и не исключает возможности использования аналогичных материалов.
4
) Поставляется компанией Rotecno AG, Via Vite 3, СН-6855 Стабио, Швейцария. Материал также можно заказать в компании schuett-biotec GmbH, Rudolf-Wissell-Str. 13, D-37079 Гёттинген. Эта информация представлена для удобства пользователей настоящего стандарта, не является подтверждением торгового названия со стороны ISO и не исключает возможности использования аналогичных материалов.
5
) Поставляется schuett-biotec GmbH, Rudolf-Wissell-Str. 13, D-37079 Гёттинген, Германия. Эта информация представлена для удобства пользователей настоящего стандарта, не является подтверждением торгового названия со стороны ISO и не исключает возможности использования аналогичных материалов.

