ГОСТ 29311-92
Группа Р35
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ГИДРОЛИЗАТЫ ПАНКРЕАТИЧЕСКИЕ ДЛЯ БАКТЕРИАЛЬНЫХ ПИТАТЕЛЬНЫХ СРЕД
Общие технические условия
Pancreatic hydrolyzates for bacterial nutrient media. General specifications
МКС 11.220
ОКП 93 8880
Дата введения 1993-01-01
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Главным управлением ветеринарии Министерства сельского хозяйства и продовольствия
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Комитета стандартизации и метрологии СССР от 28.02.92 N 187
3. ВВЕДЕН ВПЕРВЫЕ
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка | Номер пункта |
ГОСТ 61-75 | 4.5.1 |
ГОСТ 1625-89 | 4.3.1 |
ГОСТ 1770-74 | 4.7.1 |
ГОСТ 3118-77 | 4.6.3.1 |
ГОСТ 4165-78 | 4.4.1 |
ГОСТ 4198-75 | 4.6.3.1 |
ГОСТ 4204-77 | 4.3.1; 4.6.3.1 |
ГОСТ 4233-77 | 4.7.1 |
ГОСТ 4328-77 | 4.2.1.1; 4.3.1; 4.4.1 |
ГОСТ 4478-78 | 4.5.1 |
ГОСТ 5959-80 | 1.2.3 |
ГОСТ 6709-72 | 4.2.1.1; 4.3.1; 4.4.1; 4.6.3.1 |
ГОСТ 10131-93 | 1.2.3 |
ГОСТ 10931-74 | 4.6.3.1 |
ГОСТ 12923-82 | 1.2.3 |
ГОСТ 13805-76 | 4.7.1 |
ГОСТ 14192-96 | 1.3.2 |
ГОСТ 17206-96 | 4.7.1; 4.7.2.1 |
ГОСТ 20730-75 | 4.2; 4.7.1 |
ГОСТ 25336-82 | 4.3.1; 4.7.1 |
ГОСТ 28085-89 | 4.8 |
ГОСТ 29227-91 | 4.2.1.1; 4.3.1; 4.4.1; 4.5.1; 4.7.1 |
ГОСТ 29251-91 | 4.3.1; 4.5.1; 4.7.1 |
ОСТ 64-009-86 | 1.2.2; 3.5 |
ТУ 6-09-5393-88 | 4.6.3.1 |
ТУ 38 1051835-88 | 1.2.2 |
ТУ 10-09-202-86 | 1.2.1 |
ТУ 64-2-179-78 | 1.2.1 |
ТУ 38.006.108-90 | 1.2.2; 3.5 |
ТУ 10-09-30-89 | 1.2.3 |
ТУ 10-09-202-86 | 1.2.1; 3.5 |
ТУ 6-09-20-88 | 4.2.1.1 |
5. ПЕРЕИЗДАНИЕ. Май 2004 г.
Настоящий стандарт распространяется на панкреатические гидролизаты мяса, мясопродуктов, крови, а также их белоксодержащих отходов с разным уровнем содержания аминокислот - высоким (N 1), средним (N 2) и низким (N 3), предназначенные для изготовления бактериальных питательных сред.
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. Характеристики
1.1.1. Панкреатические гидролизаты для бактериальных питательных сред должны изготавливать в соответствии с требованиями настоящего стандарта по технологическим регламентам или инструкциям, утвержденным в установленном порядке.
1.1.2. Панкреатические гидролизаты по физико-химическим и биологическим показателям должны соответствовать требованиям, указанным в табл.1.
Таблица 1
Наименование показателей | Номер гидролизатов | ||
1 | 2 | 3 | |
1. Внешний вид | Прозрачная жидкость, возможен белый осадок тирозина | ||
2. Цвет | Темно-коричневый | Коричневый | Светло-коричневый |
3. Общий азот, %, не менее | 1,20 | 1,00 | 0,75 |
4. Аминный азот, %, не менее | 0,7 | 0,5 | 0,3 |
5. Полипептиды, %, не менее | 2,0 | 2,5 | 2,5 |
6. Аминокислоты*, % | Выше 6,5 | 4,5-6,5 | Ниже 4,5 |
7. Азот аминокислот*, % | Выше 0,80 | 0,59-0,80 | Ниже 0,59 |
8. Рост тест-штаммов микроорганизмов: | |||
типичность | Рост должен быть типичным, колонии на плотной среде - в S-форме | ||
интенсивность роста, ед. опт. плотности, не менее: | |||
для Staphylococcus aureus штамм Лоссманов | 0,45 | 0,40 | 0,35 |
для Escherichia coli штамм 675 | 0,60 | 0,60 | 0,50 |
для Streptococcus faecalis штамм 6783 | 0,40 | 0,40 | 0,25 |
9. Стерильность | Должен быть стерильным | ||
________________ | |||
1.2. Упаковка
1.2.1. Гидролизат расфасовывают стерильно или с добавлением 1% хлороформа в стеклянные флаконы вместимостью 200 см по ТУ 10-09-202* или стеклянные бутыли вместимостью 0,5; 1,0; 2,5; 5,0; 10 или 20 дм
по ТУ 64-2-179*.
________________
* ТУ, упомянутые здесь и далее по тексту не приводятся. За дополнительной информацией обратитесь по ссылке. - .
1.2.2. Флаконы закрывают резиновыми пробками по ТУ 38.006.108, закатывают алюминиевыми колпачками по ОСТ 64-009*; бутыли - резиновыми пробками по ТУ 38 1051835.
________________
* Документ в информационных продуктах не содержится. За информацией о документе Вы можете обратиться в Службу поддержки пользователей. - .
1.2.3. Стеклянные флаконы с панкреатическим гидролизатом упаковывают в дощатые ящики по ГОСТ 10131. Каждый флакон обертывают алигнином по ГОСТ 12923 или ватой по ГОСТ 5959. Масса брутто не более 15 кг.
Стеклянные бутыли упаковывают в полиэтиленовые емкости или в ящики по ТУ 10-09-30, обеспечивающие их неподвижность и целостность.
1.3. Маркировка
1.3.1. На флаконы и бутыли наклеивают бумажные этикетки с указанием:
наименования ведомства;
наименования предприятия-изготовителя и его товарного знака;
наименования препарата;
количества препарата в бутыли;
номера серии;
номера контроля;
даты изготовления;
срока годности;
условий хранения;
обозначения настоящего стандарта.
1.3.2. На каждое грузовое место (ящик, емкость) наносят транспортную маркировку по ГОСТ 14192 с указанием манипуляционных знаков "Хрупкое. Осторожно!", "Ограничение температуры" и предупредительную надпись "Биопрепараты".
Маркировка, характеризующая упакованную продукцию, должна содержать следующие данные:
наименование предприятия-изготовителя;
наименование препарата;
количество препарата в ящике;
номер серии;
дату изготовления;
срок годности;
условия хранения;
обозначение настоящего стандарта.
Не допускается совмещение транспортной маркировки и маркировки с данными об упакованной продукции на одной стороне ящика.
1.3.3. Внутрь каждого ящика или полиэтиленовой емкости вкладывают контрольный (упаковочный) лист с указанием: наименования предприятия-изготовителя; наименования препарата; количества препарата в ящике (полиэтиленовой емкости); номера серии; номера контроля; даты упаковки; срока годности; номера или фамилии упаковщика.
2. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
Требования безопасности, производственной санитарии и санитарно-противоэпидемического режима выполняют в соответствии с "Правилами техники безопасности, производственной санитарии, санитарно-противоэпидемического режима для предприятий по производству бактерийных и вирусных препаратов", утвержденными Минздравом СССР.
3. ПРИЕМКА
3.1. Панкреатические гидролизаты принимают сериями. Под серией понимают определенное количество панкреатического гидролизата, изготовленное за один технологический цикл в одной емкости, одновременно расфасованное и оформленное одним документом о качестве с указанием номера контроля.
3.2. В документе о качестве должны быть указаны:
наименование предприятия-изготовителя и его товарный знак;
наименование препарата;
номер серии;
дата изготовления препарата;
номер документа о качестве;
дата выдачи документа о качестве;
количество препарата в серии;
результаты анализа;
срок годности препарата;
обозначение настоящего стандарта.
3.3. Каждая серия панкреатического гидролизата должна быть принята на предприятии-изготовителе контролером.
3.4. Для контроля качества гидролизата от каждой серии делают выборку. Выборку () составляют из единиц упаковок, отобранных из разных мест серии, в количестве, рассчитанном по формуле
![]() ,
,
где - количество упаковок в серии.
3.5. При расфасовке гидролизата во флаконы из выборки отбирают шесть флаконов. Три из них используют для анализа, три - хранят в архиве контролера.
При расфасовке в бутыли из каждой бутыли отбирают точечную пробу объемом 100-500 см. Точечные пробы соединяют вместе и составляют объединенную пробу объемом не менее 1,2 дм
. Объединенную пробу тщательно перемешивают и разливают во флаконы вместимостью 200 см
по ТУ 10-09-202. Половину флаконов передают в лабораторию для анализа, в остальные добавляют 1% хлороформа, закрывают резиновыми пробками по ТУ 38.006.108 и алюминиевыми колпачками по ОСТ 64-009 и обкатывают их. В архиве контролера хранят в течение 6 мес при температуре 4-10 °С.
3.6. Определение роста тест-штаммов микроорганизмов проводят по каждой десятой серии препарата.
3.7. При получении неудовлетворительных результатов испытаний хотя бы по одному из показателей по нему проводят повторные испытания на удвоенном количестве флаконов гидролизата, отобранных от той же серии. Результаты повторных испытаний распространяют на всю серию.
3.8. Контроль качества гидролизата по требованию потребителя проводит в течение срока годности профильная лаборатория ВГНКИ ветеринарных препаратов.
4. МЕТОДЫ ИСПЫТАНИЙ
4.1. Определение внешнего вида и цвета
Внешний вид: наличие механической примеси, плесени, хлопьев, осадка устанавливают, просматривая флаконы с гидролизатом в проходящем свете, для чего флаконы встряхивают и переворачивают пробками вниз.
Цвет определяют визуально на белом фоне.
4.2. Определение общего азота - по ГОСТ 20730 или по методу Несслера.
4.2.1. Определение общего азота по методу Несслера
Сущность метода заключается в том, что получаемый в результате минерализации вещества сульфат аммония расщепляется в щелочной среде до аммиака. При рН 12 аммиак вступает в реакцию с реактивом Несслера. При этом образуется комплексное соединение ртути желто-оранжевого цвета, интенсивность окраски которого пропорциональна концентрации аммиака и может быть измерена колориметрически.
4.2.1.1. Аппаратура и реактивы
Фотоэлектроколориметр.
Пипетки по ГОСТ 29227.
Натрия гидроксид по ГОСТ 4328, 10%-ный раствор.
Реактив Несслера по ТУ 6-09-20.
Вода дистиллированная по ГОСТ 6709.
4.2.1.2. Подготовка к испытанию
Построение калибровочной кривой
Готовят стандартный раствор сернокислого аммония, 1 см которого содержит 0,1 мкг азота: 0,4716 г аммония сернокислого ос.ч. или х.ч. растворяют в 1 дм
дистиллированной воды. В мерные колбы вместимостью 50 см
вносят 0,5-1,0-1,5-2,0-2,5-3,0 см
стандартного раствора, что соответствует 0,1-0,2-0,3-0,4-0,5-0,6 миллиграмм-процента азота. Добавляют до
объема колбы дистиллированную воду, вносят 2,5 см
реактива Несслера, доводят водой до метки и перемешивают.
Измеряют на фотоэлектроколориметре при 440 нм (синий светофильтр) в кюветах с толщиной поглощающего свет слоя 1 см против кюветы с контрольным раствором (9,5 см воды плюс 0,5 см
реактива Несслера).
4.2.1.3. Проведение испытания
Для минерализации в колбу Кьельдаля берут 0,5 см предварительно профильтрованного гидролизата и 1,0 см
серной кислоты. Минерализат переносят в мерную колбу вместимостью 100 см
, многократно обмывая колбу Кьельдаля. Раствор доводят водой до метки и тщательно перемешивают.
В пробирку отбирают 0,5 см раствора, добавляют 0,1 см
гидроксида натрия, перемешивают, добавляют 8,9 см
воды и 0,5 см
реактива Несслера.
В качестве оптического контроля используют образец, состоящий из 9,5 см воды и 0,5 см
реактива Несслера.
Пробы тщательно перемешивают и через 2 мин колориметрируют при 440 нм (синий светофильтр) в кюветах с толщиной поглощающего свет слоя 1 см.
4.2.1.4. Обработка результатов
Массу общего азота () в процентах вычисляют по формуле
![]() ,
,
где - масса азота, определенная по стандартной кривой, мг/%;
100 - коэффициент пересчета для первого разведения;
10 - коэффициент пересчета для второго разведения;
- объем гидролизата, используемый для определения, см
;
- объем 1-го разведения, используемый для реакции, см
;
1000 - коэффициент пересчета в грамм-проценты.
4.3. Определение аминного азота
Сущность метода заключается в связывании аминогруппы аминокислот формальдегидом и оттитровывании диссоциированной карбоксильной группы раствором щелочи.
4.3.1. Аппаратура, материалы и реактивы
pH-метр: иономер ЭВ-74 или другой прибор того же назначения.
Весы ВЛР-500 или другие того же класса точности.
Стаканы и колбы лабораторные по ГОСТ 25336.
Пипетки, бюретки по ГОСТ 29227, ГОСТ 29251.
Формалин технический по ГОСТ 1625.
Фенолфталеин раствор с массовой долей 1%.
Натрия гидроксид по ГОСТ 4328, раствор массовой концентрации ![]() моль/дм
моль/дм.
Кислота серная по ГОСТ 4204, раствор массовой концентрации ![]() моль/дм
моль/дм.
Вода дистиллированная по ГОСТ 6709.
4.3.2. Подготовка к испытанию
Приготовление формальной смеси
К 50 см отфильтрованного формалина добавляют 1 см
1%-ного раствора фенолфталеина и доводят окраску до слабо-розовой добавлением раствора гидроксида натрия.
4.3.3. Проведение испытания
1 см предварительно профильтрованного гидролизата вносят в широкий низкий стаканчик для pH-метрии, добавляют дистиллированную воду до достаточного погружения электродов рН-метра. Доводят рН раствора до 7,0 путем добавления нескольких капель раствора серной кислоты или гидроксида натрия.
Добавляют 2 см формольной смеси. При этом рН сдвигается в связи с образованием свободных карбоксильных групп в кислую сторону. Титрование ведут раствором гидроксида натрия концентрации
![]() моль/дм
моль/дм до рН 8,5.
4.3.4. Обработка результатов
Массу аминного азота в гидролизате () в процентах вычисляют по формуле
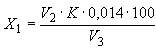 ,
,
где - объем раствора гидроксида натрия, израсходованный на титрование испытуемой пробы, см
;
- поправочный коэффициент к титру раствора гидроксида натрия концентрации
![]() моль/дм
моль/дм:
- объем гидролизата, используемый для анализа, см
;
100 - коэффициент пересчета в проценты;
0,0014 - количество азота, соответствующее 1 см раствора гидроксида натрия концентрации 0,1 моль/дм
, г.
4.4. Определение содержания полипептидов
Сущность метода заключается в биуретовой реакции - образовании красно-фиолетовых комплексов при реакции пептидов с солями окисной меди в щелочной среде.
4.4.1. Аппаратура, материалы, реактивы
Фотоэлектроколориметр или спектрофотометр.
Пробирки центрифужные.
Центрифуга настольная типа ОПн-8-14.
Пипетки по ГОСТ 29227.
Натрия гидрат окиси по ГОСТ 4328, 10%-ный раствор.
Медь сернокислая по ГОСТ 4165, 2%-ный раствор.
Вода дистиллированная по ГОСТ 6709.
4.4.2. Подготовка к испытанию
4.4.2.1. Построение калибровочного графика
Для построения калибровочного графика по оси абсцисс откладывают значение концентрации полипептидов в процентах и по оси ординат - значение оптической плотности раствора согласно данным, приведенным в табл.2.
Таблица 2
Концентрация полипептидов, % | Оптическая плотность |
0,1 | 0,14 |
0,2 | 0,26 |
0,3 | 0,37 |
0,4 | 0,49 |
4.4.3. Проведение испытания
В две центрифужные пробирки вносят 0,5 см гидролизата, 4,5 см
воды, добавляют 0,5 см
10%-ного раствора гидроксида натрия и 0,5 см
2%-ного раствора сернокислой меди. Смесь хорошо перемешивают после добавления каждого реактива.
Параллельно ставят контрольную пробу, для чего к 0,5 см гидролизата добавляют 5,5 см
дистиллированной воды. Пробы центрифугируют с частотой вращения 3000-4000 мин
по 10 мин.
Интенсивность окраски измеряют на фотоэлектроколориметре или спектрофотометре при 540 нм в кюветах с толщиной поглощающегося слоя 1 см. В качестве оптического контроля используют центрифугат контрольной пробы.
4.4.4. Обработка результатов
Концентрацию полипептидов в гидролизате () в процентах определяют по калибровочному графику. Полученное значение умножают на коэффициент разведения, равный десяти.
За окончательный результат испытания принимают среднее арифметическое результатов двух параллельных определений, допускаемое расхождение между которыми не должно превышать 5%.
4.5. Определение аминокислот
Сущность метода заключается в хроматографии аминокислот и индикации их при окраске нингидрином а-аминогрупп, с использованием автоматического анализатора.
Дополнительно определяется содержание триптофана титрометрическим методом в реакции с хлорамином.
4.5.1. Аппаратура и реактивы
Анализатор аминокислот.
Центрифуга настольная.
Пипетки, бюретки по ГОСТ 29227, ГОСТ 29251.
Кислота сульфосалициловая по ГОСТ 4478, концентрации 3%.
Реактивы для хроматографии аминокислот ос.ч. или х.ч. в соответствии с инструкцией к прибору.
Кислота уксусная ледяная по ГОСТ 61.
Хлорамин Б, 1%-ный водный раствор.
4.5.2. Подготовка к испытанию
4.5.2.1. Депротеинизация образца гидролизата
В центрифужную пробирку вносят 3 см гидролизата и 3 см
сульфосалициловой кислоты. Смесь центрифугируют при 4-6 тыс. мин
15-20 мин. Разводят 1 см
супернатанта в 40-120 раз (из расчета содержания аминного азота в конечном разведении 4-5 миллиграмм-процента) бидистиллированной водой или буферным раствором рН 2,2, приготовленным в соответствии с инструкцией к прибору. Полученный раствор фильтруют.
4.5.3. Проведение испытания
0,5 см фильтрата наносят на колонку аминокислотного анализатора. Хроматографию аминокислот проводят в соответствии с инструкцией к прибору.
При хроматографии с использованием двухколоночного метода и трех буферных растворов (рН 3,25; 4,25 и 5,28) обычно количественно определяют все аминокислоты, входящие в состав белка, за исключением триптофана. В этом случае для определения общего аминокислотного состава гидролизата содержание триптофана определяют отдельно.
4.5.4. Определение триптофана
В три пробирки берут по 1 см предварительно профильтрованного гидролизата, добавляют по 1 см
ледяной уксусной кислоты и титруют свежеприготовленным раствором хлорамина, добавляя по 1 капле и тщательно встряхивая. По мере титрования появляется розовая окраска. Окончанием титрования является переход окраски из максимально розовой в палевую или желтую, который обычно происходит от одной капли хлорамина.
4.5.5. Обработка результатов
Массу аминокислот в гидролизате () в процентах по хроматограмме вычисляют по формуле
![]() ,
,
где - массовая концентрация аминокислоты, мк моль/см
, рассчитанная в соответствии с инструкцией к прибору;
- молекулярная масса аминокислоты;
- коэффициент разведения образца;
10 - коэффициент пересчета микрограммов в граммы;
100 - коэффициент пересчета в проценты.
Массовую долю триптофана () в процентах рассчитывают по формуле
![]() ,
,
где - объем 1%-ного раствора хлорамина, израсходованный на титрование; см
;
1000 - коэффициент пересчета миллиграммов в граммы;
100 - коэффициент пересчета в проценты.
Общее содержание аминокислот () определяют как сумму
и
4.6. Определение азота аминокислот
Сущность метода заключается в расчете азота аминокислот как разности результатов содержания общего азота, азота полипептидов и нуклеотидов.
4.6.1. Определение азота полипептидов
Массу азота полипептидов () в процентах вычисляют по формуле
![]() ,
,
где - количество полипептидов, %;
6,25 - коэффициент пересчета.
4.6.2. Определение азота нуклеотидов
Азот нуклеотидов определяют как эквивалент фосфору нуклеотидов.
4.6.3. Определение фосфора нуклеотидов
Сущность метода заключается в определении интенсивности окраски молибденовой сини с восстановлением хлористым оловом.
4.6.3.1. Аппаратура и реактивы
Фотоэлектроколориметр.
Кислота серная по ГОСТ 4204 концентрированная, концентрации ![]() моль/дм
моль/дм.
Натрий молибденовокислый двуводный по ГОСТ 10931.
Олово хлористое, х.ч. или ч.д.а. по ГОСТ 36*.
________________
* На территории Российской Федерации документ не действует. Действуют ТУ 6-09-5393-88. - .
Кислота соляная по ГОСТ 3118, концентрированная.
Калий фосфорнокислый однозамещенный по ГОСТ 4198.
Вода дистиллированная по ГОСТ 6709.
Вода бидистиллированная.
4.6.3.2. Подготовка к испытанию
Приготовление серной кислоты концентрации ![]() моль/дм
моль/дм. Берут 69,6 дм
серной кислоты плотностью 1,84 г/см
и разводят в бидистиллированной воде в мерной колбе вместимостью 1 дм
.
Приготовление молибдата натрия
Навеску молибдата натрия 18,75 г растворяют в 1 дм серной кислоты концентрации
![]() моль/дм
моль/дм. Раствор хранят в темной посуде с притертой пробкой.
Приготовление раствора хлорида олова.
10 г хлорида олова растворяют в 25 см концентрированной соляной кислоты при нагревании. Хранят в темной посуде с притертой пробкой. Перед употреблением 0,5 см
раствора разводят в 100 см
бидистиллированной воды.
Приготовление стандартного раствора фосфора
Калий фосфорнокислый однозамещенный перекристаллизованный высушивают в эксикаторе над серной концентрированной кислотой в течение 6-7 дней. Навеску фосфата калия 0,4394 г разводят в 1 дм дистиллированной воды в мерной колбе. 1 дм
раствора содержит 0,1 мг фосфора.
Построение калибровочной кривой
Для построения калибровочной кривой в мерные колбы вместимостью 100 см берут стандартный раствор в количестве 1, 2, 3, 4, 5, 6, 7, 8 см
и доводят до метки бидистиллированной водой.
В две пробирки наливают по 2,5 см испытуемого раствора, добавляют по 2 см
раствора молибдата натрия, тщательно перемешивают, добавляют 0,5 см
раствора хлорида олова и снова перемешивают.
В контрольные пробирки наливают воду и остальные реактивы. Выдерживают 1 мин и колориметрируют при длине волны 670 нм (красный светофильтр) в кювете с толщиной поглощающего слоя 3 мм.
4.6.3.3. Проведение испытания
Из раствора минерализата, полученного по п.4.2.1.3, отбирают 2,5 см, переносят в пробирку, добавляют 2 см
раствора молибдата натрия, тщательно перемешивают, добавляют 0,5 см
хлорида олова и снова перемешивают.
4.6.3.4. Обработка результатов
Массу фосфора нуклеотидов () в процентах, равную количеству азота нуклеотидов, вычисляют по формуле
![]() ,
,
где - количество фосфора, определенное по кривой, мг/%;
- объем гидролизата, используемый для анализа, см
;
100 - коэффициент пересчета на 100 см гидролизата в проценты;
1000 - коэффициент пересчета из миллиграммов в граммы.
Масса азота аминокислот () в процентах равна
![]() .
.
4.7. Рост тест-штаммов микроорганизмов
4.7.1. Аппаратура, материалы и реактивы
Термостат с температурой нагрева (37±1)°С.
Фотоэлектроколориметр.
Автоклав.
Весы технические.
pH-метр.
Пипетки вместимостью 1, 2, 10 см по ГОСТ 29227 и пипетки пастеровские стерильные.
Бюретки вместимостью 25 или 50 см по ГОСТ 29251.
Пробирки стеклянные по ГОСТ 1770 с ватно-марлевыми пробками, стерильные.
Воронки для фильтрования по ГОСТ 25336.
Фильтры бумажные.
Чашки Петри, стерильные.
Петля платиновая.
МПБ (1:1) по ГОСТ 20730 и МПА в пробирках с ватно-марлевыми пробками, стерильные.
Пептон сухой ферментативный по ГОСТ 13805.
Агар микробиологический по ГОСТ 17206.
Натрия хлорид по ГОСТ 4233.
Культуры тест-штаммов микроорганизмов: Staphylococcus aureus штамм Лоссманов, Escherichia coli шт. 675, Streptococcus faecalis 6783.
4.7.2. Подготовка к испытанию
4.7.2.1. Приготовление питательных сред
Из испытуемого гидролизата готовят питательную среду с содержанием аминного азота 0,15-0,18%, полипептидов - не менее 1,5%, рН 7,4-7,6.
С этой целью гидролизат разводят по аминному азоту из расчета его содержания в разведении 0,15%. Добавляют, в случае необходимости, сухой ферментативный пептон до получения в среде указанного минимума полипептидов, а также 0,5% хлорида натрия. Устанавливают рН 7,6-7,8 добавлением 10%-ного раствора гидроксида натрия или соляной кислоты, кипятят 5-10 мин, охлаждают, доводят водой до первоначального объема и фильтруют. Если в процессе обработки рН среды сдвигается, его вновь доводят до указанных величин, после чего нагревают до кипения и снова фильтруют. Фильтрат разливают в пробирки по 8 см, закрывают ватно-марлевыми пробками и пергаментными колпачками и стерилизуют в автоклаве в течение 30 мин при 1,5 кгс/см
.
Для приготовления агаровой среды в полученную после внесения ингредиентов жидкую питательную среду добавляют 2% микробиологического агара по ГОСТ 17206. Устанавливают рН 7,6-7,8. Среду кипятят до полного растворения агара, фильтруют и разливают в пробирки по 5 см, в стерильные чашки Петри - толщиной слоя 5-8 мм. Пробирки закрывают ватно-марлевыми пробками и пергаментными колпачками, стерилизуют в автоклаве при тех же условиях, что и пробирки с жидкими средами.
Чашки Петри с плотными питательными средами устанавливают на горизонтальной поверхности, охлаждают до затвердевания среды, переворачивают вверх дном и помещают в термостат при (37±1)°С для подсушивания на 16-20 ч.
Плотные среды в пробирках перед употреблением необходимо скосить, для чего их расплавляют, затем охлаждают, установив пробирки в наклонном положении.
4.7.2.2. Хранение и освежение культур
Культуры тест-штаммов микроорганизмов хранят в лиофилизированном состоянии или в пробирках с полужидкой средой (0,1-0,2% агара), без глюкозы, под парафинированными пробками и резиновыми колпачками или с резиновыми пробками при температуре 4-6°С.
Перед употреблением культуры освежают. С этой целью сухие культуры из ампул или из пробирок с полужидкой средой рассевают в три пробирки с мясо-пептонным бульоном. Посев проводят пастеровскими пипетками или платиновой петлей. Пробирки с засеянной средой выдерживают в термостате при температуре (37±1)°С в течение 20-24 ч. Для последующей работы возможны еще два пассажа на жидкие питательные среды. В дальнейшем берут новую ампулу лиофилизированной культуры или пробирку с полужидким агаром.
4.7.2.3. Проведение испытания
В две-три пробирки с испытуемой и контрольной (МПБ) жидкими питательными средами вносят по 0,2 см 20-24-часовой бульонной культуры тест-штамма, а в две-три пробирки или чашки Петри с плотными средами (испытуемой и МПА) ее рассевают дробно бактериологической петлей. Инкубацию проводят 20-24 ч при температуре (37±1)°С.
Типичность роста культур на плотных и жидких питательных средах определяют визуально и под микроскопом. Рост должен быть типичным для каждого штамма микроорганизмов.
S. aureus - в бульоне вызывает значительное помутнение среды с выпадением обильного осадка, нередко с появлением пристеночного серовато-белого кольца или пленки. На плотной питательной среде - четко оформленные выпуклые круглые колонии диаметром 1-4 мм с ровными краями, золотисто-желтого, оранжевого или лимонного цвета.
Е. coli - дает обильный рост в бульонной среде при значительном ее помутнении, с образованием сероватого легкоразбивающегося осадка. На плотной среде - прозрачные сочные колонии с серовато-голубым отливом, сливающиеся между собой. Края колоний могут быть расплывчатыми или волнистыми.
S. faecalis - на агаровой среде образует мелкие 0,5-1 мм мутные, серовато-белые или сероватые зернистые нерезко очерченные колонии. На бульонной среде рост с образованием пристеночного и придонного мелкозернистого осадка.
Интенсивность роста в жидкой питательной среде оценивают на фотоэлектроколориметре при длине волны 630-670 нм в кювете с толщиной слоя светопропускания 5 мм против контрольной кюветы с исходной питательной средой.
4.8. Определение стерильности - по ГОСТ 28085.
5. ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
5.1. Панкреатические гидролизаты транспортируют всеми видами транспорта в соответствии с правилами перевозок скоропортящихся грузов и багажа, действующими на данном виде транспорта.
5.2. Бутыли с гидролизатами хранят в рефрижераторе при температуре 4-10°C или в помещении при тех же температурах.
6. ГАРАНТИИ ИЗГОТОВИТЕЛЯ
6.1. Изготовитель гарантирует соответствие панкреатического гидролизата требованиям настоящего стандарта при соблюдении условий транспортирования, хранения и применения.
6.2. Гарантийный срок хранения панкреатического гидролизата N 1 - 6 мес, N 2 и 3 - 3 мес со дня изготовления.
Электронный текст документа
и сверен по:
М.: ИПК Издательство стандартов, 2004

