ГОСТ Р 51446-99
(ИСО 7218-96)
Группа Н09
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Микробиология
ПРОДУКТЫ ПИЩЕВЫЕ
Общие правила микробиологических исследований
Microbiology. Food stuffs. General rules for microbiological examinations
ОКС 07.100.30
ОКСТУ 9209, 9210
Дата введения 2001-01-01
Предисловие
1 РАЗРАБОТАН Временным творческим коллективом с участием членов Технического комитета по стандартизации ТК 116 “Продукты переработки птицы, яиц и сублимационной сушки”
ВНЕСЕН ТК 116 “Продукты переработки птицы, яиц и сублимационной сушки”
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 22 декабря 1999 г. N 601ст
3 Настоящий стандарт представляет собой аутентичный текст международного стандарта ИСО 7218-96 “Микробиология продуктов питания и кормовых продуктов. Общие правила микробиологических исследований”, содержит дополнительные требования, отражающие потребности экономики страны (наименование, разделы 1, 2, 3, 4, 5, пункты 6.2.3, 6.6, 8.1, 9,1, 9,2, 9.3.1), за исключением кормов
4 ВВЕДЕН ВПЕРВЫЕ
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и устанавливает общие правила проведения микробиологических исследований.
Стандарт способствует обоснованности исследований, обеспечению идентичности общих технических условий приемов исследований, применяемых в различных лабораториях, достижению сопоставимости результатов, полученных в разных лабораториях, и содействию по защите здоровья персонала лаборатории путем устранения опасности заражения.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ИСО 6887-83* Микробиология. Общее руководство по приготовлению разбавлений для микробиологического исследования
_______________
* Действует до введения в действие ГОСТ Р, разработанного на основе ИСО.
3 Требования к помещениям
Общее размещение лаборатории и ее инфраструктура должны удовлетворять требованиям [1]. Лаборатория должна иметь разрешение на работу с микроорганизмами III-IV групп патогенности в соответствии с [1].
3.1 Классификация помещений
Помещения лаборатории подразделяют на следующие зоны:
1) рабочая зона для выполнения следующих операций:
- приема, хранения, подготовки и обработки проб,
- приготовления и стерилизации питательных сред и оборудования,
- проведения исследования путем взвешивания, приготовления разведений, посева, пересева, термостатирования, сохранения штаммов и других лабораторных работ,
- обеззараживания и очистки оборудования, ликвидации отходов исследований;
2) дополнительные зоны, включающие следующие помещения:
- входы, коридоры, лестницы, лифты,
- административные помещения - секретарская и офисная комнаты, комната для работы с документами и другие,
- рездевалки и туалеты,
- архивы,
- склады;
3) при работе с патогенными для человека микроорганизмами помещения рабочей и дополнительных зон должны быть разделены также на “заразную” и “чистую” в соответствии с [1].
3.2 Требования к расположению помещений
Окружающие условия, в которых проводят микробиологические исследования, не должны влиять на их достоверность.
Помещения следует располагать таким образом, чтобы избежать опасности перезаражения. Для достижения этой цели необходимо организовать поточность прохождения чистых и загрязненных материалов и обеспечить непересечение потоков.
Следует обеспечить защиту от экстремальных условий, таких как повышенная температура, запыленность, влажность, пар, шум, вибрация, воздействие прямых солнечных лучей и т.д.
Площадь рабочей зоны должна быть достаточно большой для поддержания в ней чистоты и порядка. Во всех аналитических помещениях для каждого аналитика рекомендуется рабочее место площадью примерно 20 м.
Во время проведения испытаний в рабочую зону следует допускать только персонал, участвующий в проведении исследований.
Должны быть предусмотрены отдельные комнаты и/или отдельные зоны и/или специально огороженные участки для следующих операций:
- прием и хранение проб;
- подготовка проб, особенно в случае необработанного сырья (например порошкообразных продуктов, содержащих большое количество микроорганизмов);
- работа с патогенами (например Salmonella, Listeria monocytogenes);
- приготовление и стерилизация питательных сред и оборудования;
- мойка стеклянной посуды и другого оборудования, а также обеззараживание оборудования и контаминированных питательных сред;
- проверка на стерильность пищевых продуктов.
Может быть также предусмотрено выделение следующих зон:
- для приготовления питательных сред и помещения для стерилизации питательных сред и оборудования;
- для обеззараживания и моечной.
Термостаты, холодильники, морозильные камеры могут быть размещены в отдельных, специально подготовленных комнатах.
3.3 Требования к оборудованию помещений
3.3.1 Чтобы уменьшить опасность загрязнения пылью и, следовательно, микроорганизмами, помещения для проведения испытаний должны быть устроены следующим образом:
- стены, потолок и пол должны быть гладкими, легко очищаемыми, устойчивыми к действию детергентов и дезинфицирующих веществ, используемых в лаборатории, полы не должны быть скользкими;
- помещения не должны пересекать водопроводные трубы, если они герметично не изолированы;
- окна с наружной стороны должны быть оборудованы системой защиты от прямого солнечного излучения (за исключением особых случаев);
- во избежание сквозняков во время проведения испытаний окна и двери должны закрываться герметично. Их конструкция должна препятствовать скоплению пыли и облегчать очистку.
3.3.2 Температура и качество окружающего воздуха (содержание микроорганизмов, влажность, запыленность и другое) должны соответствовать требованиям, предъявляемым к проведению испытаний. Для этого рекомендуется притяжная вентиляционная система, снабженная фильтрами. Допускается установка кондиционеров в рабочих помещениях и боксах в соответствии с [1].
Если для испытаний требуется очень чистая атмосфера, то помещение должно быть оборудовано ламинарным шкафом с очисткой воздуха и/или безопасным боксом. Это оборудование должно быть снабжено соответствующими инструкциями.
3.3.3 Верхняя поверхность лабораторного инвентаря и мебели должна быть изготовлена из гладкого непроницаемого материала, легко очищаемого и дезинфицируемого. Для предупреждения накопления пыли шкафы должны достигать потолка.
Конструкция лабораторной мебели не должна затруднять уборку помещения (например передвижная мебель).
Документация, используемая при работе с пробами, питательными средами, реактивами и т.д., должна храниться в закрытых шкафах.
Примечание - Редко используемые документы и книги желательно размещать вне рабочий зоны.
3.3.4 В помещениях должно быть хорошее освещение, без мешающих световых бликов. Следует избегать попадания прямого солнечного света на рабочее место и чувствительное оборудование, в частности, термостаты.
3.4 Требования по уходу и контролю
Полы, стены, полки, лабораторный инвентарь и мебель следует содержать в чистоте и ремонтировать, чтобы избежать образования трещин, которые могут способствовать скоплению грязи и тем самым являться источником заражения.
Для поддержания в помещениях условий, пригодных для выполнения исследований, проводят регулярную уборку и дезинфекцию. Дезинфекцию различных объектов при работе с микроорганизмами III-IV групп патогенности проводят в соответствии с [1].
Постоянно проводят проверку исправности вентиляционных установок и их фильтров, в случае необходимости фильтры заменяют.
Регулярно контролируют микробиологическое состояние поверхностей стен, рабочих мест и воздуха в помещениях рабочей зоны.
Загрязнение поверхностей может быть определено наложением на них контактных пластин, содержащих подходящие нейтрализующие соединения. Качество воздуха может быть установлено путем экспонирования в течение 15 мин открытых чашек Петри, содержащих неселективную агаровую питательную среду (например МПА - мясопептонный агар).
Примечание - При определении загрязнения поверхностей и воздуха могут быть использованы и другие методы.
4 Аппаратура и оборудование
Вся аппаратура и оборудование должны содержаться в чистоте и в рабочем состоянии. Операции по обслуживанию и ремонту должны контролироваться. Приборы, оборудование и средства измерений должны быть аттестованы и подвергнуты метрологическому контролю в установленные сроки, иметь технический паспорт и другую документацию в соответствии с требованиями [1].
4.1 Микробиологические боксы
4.1.1 Бокс (боксированные помещения или помещения, оснащенные боксами биологической безопасности) - защищенное от пыли рабочее место, оборудованное установкой для горизонтального или вертикального ламинарного потока воздуха. В микробиологии используют безопасные боксы с улавливанием микроорганизмов фильтрами. При работе с патогенными микроорганизмами устройство боксов и их эксплуатация должны проводиться в соответствии с [1].
По степени очистки от пыли боксы условно делят на классы в соответствии с максимально допустимым количеством частиц размером более 0,5 мкм/м. Для боксов, применяющихся в пищевой микробиологии, количество частиц не должно превышать 4000 в кубическом метре.
Боксы могут быть двух типов:
а) бокс биологической безопасности с очисткой воздуха, который предназначен для защиты продукта от внешнего заражения и сведения к минимуму заражения, связанного с оператором;
б) боксированное помещение, предназначенное для предохранения продукта от внешнего заражения, а также защиты оператора и окружающей среды.
При всех работах с патогенами следует использовать, как минимум, боксированные помещения.
4.1.2 Требования к обслуживанию и контролю
Эффективность работы боксов биологической безопасности должна проверяться квалифицированным персоналом при вводе в эксплуатацию и далее не реже одного инспектирования в год. Если боксы оснащены фильтрами притяжной вентиляции, последние должны систематически заменяться.
После работы боксы убирают и дезинфицируют. Периодический контроль на всевозможные микробные загрязнения рабочих поверхностей и стен бокса проводят в помощью обычного оборудования. Например, путем экспонирования в течение 30 мин в каждом боксе нескольких открытых чашек Петри, содержащих неселективную агаровую питательную среду (например МПА). Могут быть использованы и другие методы.
4.2 Весы
4.2.1 Использование
Лаборатория пищевой микробиологии должна быть оснащена для взвешивания различных продуктов весами нужного диапазона и классов точности взвешивания ±0,01 и ±0,0001 г.
Эти весы используют главным образом для взвешивания навесок анализируемой пробы, компонентов питательных сред и реактивов. Они могут быть также использованы для измерения путем взвешивания объемов жидкостей, применяемых для разведений.
4.2.2 Требования к обслуживанию и контролю
Весы должны быть размещены на устойчивой горизонтальной подставке, защищенной от вибрации, и постоянно проверяться по рабочему эталону, желательно каждый рабочий день. Поверка весов проводится не реже одного раза в год квалифицированным специалистом по всему диапазону измерения.
При необходимости чашки весов очищают после каждого взвешивания, но не реже одного раза в день. Механизм весов должны чистить и проверять квалифицированные специалисты не реже одного раза в год.
4.3 Гомогенизатор
4.3.1 Прибор используют для приготовления исходной суспензии из испытуемой пробы нежидких продуктов. Могут применяться следующие приборы:
- гомогенизатор перистальтического типа со стерильными пластиковыми пакетами (типа Стомахер и др.); может быть оснащен таймером и регулировкой скорости;
- ротационный гомогенизатор со скоростью вращения 8000-45000 об/мин, со стеклянными или металлическими резервуарами, снабженными крышками и выдерживающими условия стерилизации.
В особых случаях гомогенизацию можно проводить с помощью выдерживающих стерилизацию стеклянных шариков, имеющих соответствующий диаметр (приблизительно 6 мм).
4.3.2 Порядок работы
Время обработки пробы на перистальтическом гомогенизаторе обычно составляет от одной до двух минут. Этот тип гомогенизатора не используют для следующих пищевых продуктов:
- продукты, способные прокалывать пакет (в связи с наличием острых, твердых или сухих частиц);
- продукты которые трудно гомогенизировать из-за из структуры (например колбасы типа салями).
Продолжительность работы ротационного гомогенизатора должна подбираться таким образом, чтобы общее количество оборотов ротора находилось в пределах 15000-20000. Однако даже в случае гомогенизаторов с низкой скоростью вращения ротора время обработки не должно превышать 2,5 мин.
Метод приготовления суспензии путем встряхивания пробы со стеклянными шариками может быть использован в случае вязких или густых продуктов, в частности молочных продуктов.
4.3.3 Обслуживание и контроль
Обслуживание и контроль приборов для гомогенизации проводят в соответствии с инструкциями изготовителя.
4.4 рН-метр
4.4.1 Описание прибора
рН-метр используют для измерения при определенной температуре разности потенциалов между измеряющим электродом и электродом сравнения, погруженными в продукт. Точность измерения должна составлять ±0,1 рН, порог чувствительности - 0,01 рН. Прибор должен быть снабжен ручным или автоматическим компенсатором температуры.
Примечание - Измеряющий электрод и электрод сравнения часто размещают в одном комбинированном электроде.
4.4.2 Использование прибора
рН-метр используют для измерения и коррекции питательных сред, реактивов (по 7.2), а также испытуемой пробы или приготовленной суспензии. рН-метр должен соответствовать стандартам на конкретный вид продукта, в которых должны быть предусмотрены условия измерения и коррекции рН, а также методы очистки и обеззараживания электродов.
4.4.3 Обслуживание и контроль
рН-метр градуируют в соответствии с инструкциями изготовителя, используя не менее двух стандартных буферных растворов, не раньше чем за день до применения. Значения рН стандартных растворов должны быть известны с точностью до второго знака после запятой при заданной температуре (обычно рН 4,0 и 7,0 при 20 °С). Измеряемое значение рН должно находиться между значениями рН стандартных растворов.
Электроды проверяют и эксплуатируют в соответствии с инструкциями изготовителя. В частности, постоянно проверяют:
- состояние электродов с учетом их старения и загрязнения;
- временные характеристики и устойчивость показаний.
Перед началом измерений проверяют, были ли рабочие части электродов полностью погруженными в дистиллированную воду или в любую другую жидкость, рекомендованную изготовителем, в противном случае до проведения измерений их выдерживают в дистиллированной воде или в рекомендованной жидкости в течение 24 ч.
Электроды очищают после каждого измерения. Принимая во внимание загрязнение и старение электродов, периодически проводят их более тщательную очистку в соответствии с инструкциями изготовителя.
Электроды хранят в соответствии с инструкциями изготовителя.
4.5 Автоклав
4.5.1 Описание
Автоклав - аппарат, обеспечивающий достижение температуры насыщенного пара не ниже 121 °С для уничтожения микроорганизмов.
4.5.2 Использование
Автоклав не должен использоваться одновременно для стерилизации чистого и загрязненного использованного оборудования (и/или питательных сред). Для этих процессов применяют отдельные автоклавы.
Автоклав должен быть оборудован:
- по крайней мере одним предохранительным клапаном;
- манометром;
- сливным краном;
- регулирующим устройством, обеспечивающим поддержание температуры с погрешностью не более ±1 °С от заданного значения (кроме особо оговоренных случаев);
- контрольным максимальным термометром или измерительной термопарой.
Желательно, чтобы автоклав был снабжен указателем продолжительности операций или программируемым таймером.
При стерилизации паром перед подъемом давления весь воздух должен быть вытеснен.
Если автоклав не оснащен автоматическим устройством для откачки воздуха, его необходимо вытеснять до появления непрерывной струи пара.
4.5.3 Обслуживание и контроль
Автоклавы поддерживают в рабочем состоянии; их регулярный контроль осуществляют компетентные органы в соответствии с инструкциями изготовителя.
Все измерительные приборы автоклава содержат в безупречно работающем состоянии и подвергают поверке в установленные сроки.
Систематически удаляют накипь и проверяют герметичность автоклава.
4.6 Термостат
4.6.1 Описание
Термостат состоит из камеры, обеспечивающей поддержание стабильной температуры и равномерное ее распределение с погрешностью ±1 °С, кроме особо оговоренных случаев.
4.6.2 Использование
Термостат должен быть снабжен системой, обеспечивающей поддержание стабильной температуры на заданном уровне равномерно по всему внутреннему рабочему объему.
Если температура окружающей среды близка или превышает температуру в термостате, камеру необходимо оборудовать охлаждающей системой.
Термостат должен быть защищен от воздействия прямого солнечного света.
Термостат не следует загружать полностью за один прием, поскольку это приведет к увеличению времени установления постоянной температуры в питательных средах, независимо от типа используемого термостата - с принудительной воздушной вентиляцией или без нее.
Загрузку термостата необходимо проводить так, чтобы обеспечить циркуляцию воздуха в камере; чашки Петри и пробирки размещают на расстоянии не менее 25 мм от внутренних стенок термостата. Количество чашек Петри в стопках не должно превышать шести, расстояние между стопками - не менее 25 мм.
4.6.3 Обслуживание и контроль
Установление постоянной температуры в рабочем объеме контролируют несколькими термостатами или термопарами.
Погрешность измерения должна быть в четыре раза меньше, чем требуемая точность поддержания температуры (например при требуемой точности ±2 °С, погрешность измерения должна составлять ±0,5 °С).
Стабильность температуры контролируют с помощью одного или нескольких максимальных и минимальных термометров.
Температуру в термостате необходимо проверять каждый рабочий день, для чего термостат должен быть снабжен, по крайней мере, одним термометром, шарик которого погружен в глицерин, содержащийся в закрытом сосуде. Могут быть использованы другие контролирующие системы или аналогичные устройства.
Внутренние и внешние стенки термостата систематически очищают, дезинфицируют и, при необходимости, удаляют пыль из вентиляционной системы.
4.7 Холодильник или холодильная камера
4.7.1 Описание
Камеры должны гарантированно обеспечивать хранение при пониженных температурах. Кроме особо оговоренных случаев, температура должна составлять (3±2) °С, исключением является консервация проб для исследований, когда температура должна быть (2±2) °С.
4.7.2 Использование
Для хранения стерильных питательных сред и реактивов, проб для исследований, культур микроорганизмов и инкубированных сред используют отдельные камеры.
Холодильники и холодильные камеры необходимо загружать таким образом, чтобы поддерживалась достаточная циркуляция воздуха.
4.7.3 Обслуживание и контроль
Температуру в каждой камере проверяют каждый рабочий день с помощью термометра или встроенного датчика. Точность измерения - по 4.6.3.
За холодильными камерами должен проводиться постоянный уход:
- удаление пыли с лопастей и внешних пластин теплообменника;
- размораживание;
- очистка и дезинфекция внутренней части камер.
4.8 Морозильная камера
4.8.1 Описание
Морозильная камера должна гарантированно обеспечивать хранение в замороженном состоянии. Температура, кроме особо оговоренных случаев, должна быть не выше минус 18 °С, желательно минус (24±2) °С.
4.8.2 Использование
Отдельные морозильные камеры используют для хранения:
- стерильных питательных сред и реактивов;
- проб для исследований;
- культур микроорганизмов.
Морозильная камера должна загружаться таким образом, чтобы поддерживалась достаточно низкая температура, в особенности, если в нее помещают незамороженные продукты.
4.8.3 Обслуживание и контроль
Температуру в каждой камере проверяют каждый рабочий день с помощью термометра или встроенного датчика. Точность измерения - по 4.6.3.
За холодильными камерами должен проводиться постоянный уход по 4.7.3.
4.9 Баня с терморегулятором
4.9.1 Описание
Баня должна поддерживать заданную температуру с погрешностью ±0,5 °С, кроме особо оговоренных случаев. Рабочие температуры оговариваются в каждом используемом методе.
4.9.2 Использование
Баню используют для:
- сохранения стерильной расплавленной агаровой среды при температуре (47±2) °С;
- культивирования засеянных питательных сред при постоянной температуре;
- приготовления исходных растворов при заданной температуре (например при приготовлении исходных суспензий казеинатов требуется поддерживать температуру 37 °С в течение 15 мин);
- тепловой обработки исходных суспензий при определенной температуре (например при подсчете спор может потребоваться разрушение вегетативных клеток).
Для точного термостатирования баня должна быть оснащена циркуляционным водяным насосом и системой автоматического терморегулирования. Перемешивание воды не должно сопровождаться разбрызгиванием капель.
4.9.3 Обслуживание и контроль
Каждая баня должна быть оснащена термометром или термопарой, независимой от автоматической системы терморегуляции.
Температуру бани контролируют в течение всего времени ее использования, желательно ежедневно.
Необходимо регулярно проверять уровень жидкости в бане (воды, этиленгликоля и других). Во избежание микробного загрязнения жидкость часто меняют.
4.10 Стерилизационный сушильный шкаф
4.10.1 Описание
Стерилизационный сушильный шкаф - камера, которая должна обеспечивать поддержание температуры от 170 до 180 °С для разрушения микроорганизмов воздействием сухого горячего воздуха.
4.10.2 Использование
В стерилизационном шкафу стерилизуют только стеклянное и металлическое оборудование. После достижения нужной температуры стерилизация должна продолжаться не менее одного часа.
ПРЕДУПРЕЖДЕНИЕ. Мерную стеклянную посуду не следует обеззараживать в стерилизационном шкафу.
Температура должна быть равномерной по всему шкафу. Шкаф должен быть снабжен:
- терморегулятором; термометром или измерительной термопарой.
Желательно, чтобы шкаф был оборудован также индикатором продолжительности работы или программируемым устройством/таймером.
4.10.3 Обслуживание и контроль
Проверяют равномерность температуры во всем рабочем объеме.
Стерилизационный шкаф содержат в хорошем рабочем состоянии. Измерительные приборы подвергают поверке в установленные сроки. Рекомендуется постоянная очистка шкафа.
4.11 Микроволновая печь
4.11.1 Описание
Микроволновая печь - аппарат, обеспечивающий нагрев продукта с помощью микроволнового излучения.
4.11.2 Использование
Микроволновую печь можно использовать только для расплавления агаровых питательных сред.
Существующие аппараты работают при обычном атмосферном давлении. Они способны нагревать питательные среды в контролируемых условиях с помощью цикла микроволнового излучения.
Для исключения перегрева микроволновое поле должно равномерно распределяться по объему нагреваемой среды. Для лучшего распределения тепла необходимо использовать аппарат с вращающимся поддоном.
ПРЕДУПРЕЖДЕНИЕ. Микроволновую печь используют с осторожностью, так как перегрев агаровых питательных сред в ней может привести к задержке закипания.
Примечание - Ввиду недостаточного обоснования эффективности использования микроволн для стерилизации питательных сред, это направление их использования в данный стандарт не включено.
4.12 Оптический микроскоп
4.12.1 Использование
Оптический микроскоп содержит объективы с разным увеличением. Объектив с большим увеличением и масляной иммерсией позволяет исследовать морфологию микроорганизмов в водной суспензии или после фиксации. Желательно оснащение микроскопа фазово-контрастным объективом и подплатформенным конденсором для улучшения условий исследования живых культур.
Примечание - Платформенные микроскопы с малым увеличением и идеальным стереоскопическим фокусированием подходят для изучения колоний бактерий в питательной агаровой среде или на ее поверхности.
4.12.2 Обслуживание и контроль
После работы с применением иммерсии линзы очищают от использованных иммерсионных веществ, не допуская ухудшения их оптических свойств.
Не реже одного раза в год уполномоченный сотрудник лаборатории должен проводить генеральную чистку микроскопа, а также проверку его механической и оптической частей.
4.13 Газовая, спиртовая горелки или прокаливатель проволоки
Газовую и спиртовую горелки используют для создания и поддержания защитной зоны вокруг пламени. Они применяются для стерилизации металлических игл и петель путем доведения их до красного каления.
При работе с патогенными бактериями для стерилизации металлических игл и петель предпочтительнее использовать прокаливатель проволоки.
4.14 Дозатор питательных сред и реактивов
4.14.1 Описание
Дозатор - инструмент или аппарат, применяемый для дозирования питательных сред и реактивов в пробирки, флаконы или чашки Петри (например мерный цилиндр, обычная пипетка, автоматическая пипетка, перистальтический насос или аппарат для автоматической подачи).
4.14.2 Использование
Если требуется асептическое дозирование питательных сред или реактивов, все части инструмента или аппарата, контактирующие с разливаемым продуктом, должны быть стерильными по 6.2. Точность инструментов или аппаратов должна соответствовать точности измерения разливаемых объемов. При приготовлении десятикратных разведений относительная погрешность измерения объемов жидкости, используемой для разбавлений, не должна превышать ±2%.
4.14.3 Обслуживание и контроль
Дозаторы содержат в безукоризненном состоянии в соответствии с инструкциями изготовителя.
Дозируемые объемы регулярно контролируют.
4.15 Механический смеситель
Аппарат используется для равномерного перемешивания различных жидкостей (например десятикратных разведений и жидких проб) или для получения жидкой суспензии бактериальных клеток. Принцип действия основан на приведении содержимого пробирок в некруговое (вихревое) вращение (приборы типа Vortex).
4.16 Прибор для подсчета колоний
Прибор должен быть оборудован осветительной системой с темной подложкой, увеличительным стеклом с увеличением не менее 1,5 и механическим или электронным счетчиком. Для подсчета могут быть использованы любые другие равноценные автоматические устройства для подсчета и равноценные по производительности (например лазерный счетчик).
4.17 Оборудование для культивирования в модифицированной атмосфере
4.17.1 Описание оборудования
Герметически закрываемый сосуд или любые другие соответствующие аппараты, способные поддерживать искусственную атмосферу, в которой находится питательная среда, на все время ее инкубирования (например анаэробное термостатирование). Могут быть использованы другие устройства аналогичного действия, например, анаэробные камеры. Установку и эксплуатацию проводят по инструкциям изготовителя.
4.17.2 Использование оборудования
Состав модифицированной атмосферы, получаемой путем смешивания газов (например из газовых баллонов) или с помощью других подходящих средств (готовые покупные упаковки с газом), должен быть оговорен в нормативном документе.
4.17.3 Обслуживание и контроль
В каждой камере во время ее использования должен находиться индикатор состава атмосферы. Если используют катализатор, его регулярно регенерируют в соответствии с инструкциями изготовителя. Оборудование для инкубирования в модифицированной атмосфере регулярно очищают и обеззараживают.
4.18 Прочее оборудование
Для проведения исследований используют и другое оборудование и приспособления: устройства для фильтрования, стеклянные или пластиковые емкости (пробирки, флаконы, бутыли), стеклянные или пластиковые чашки Петри (как правило диаметром от 90 до 100 мм), стеклянные или пластиковые пипетки вместимостью 10, 2, 1 см, инструменты для отбора проб, иглы и петли хромовоникелевые, платиноиридиевые, одноразовые пластиковые и из других материалов.
5 Требования к персоналу
5.1 Компетенция
Весь персонал, работающий в микробиологической лаборатории, должен быть соответствующим образом подготовлен для правильного выполнения операций, возложенных на него. Персонал, выполняющий работу с микроорганизмами III-IV групп патогенности, должен отвечать требованиям [1].
Сотрудники, отвечающие за проведение испытаний, должны иметь хорошее знание и практический опыт работы с изучаемыми микроорганизмами и микробиологическими методами. Они должны уметь оценивать точность и воспроизводимость, требуемые для получения достоверных результатов. Для этого они могут, например, принимать участие в круговых сличительных испытаниях, использовать стандартные образцы или проводить самооценочные тесты на определение количества микроорганизмов.
Весь персонал должен получать по мере необходимости актуализированную информацию по вопросам гигиены и безопасности работ в лаборатории.
5.2 Личная гигиена
Во избежание заражения проб и питательных сред, а также для предупреждения инфицирования персонала предпринимают следующие меры предосторожности:
- лабораторная одежда должна быть светлой, чистой и хорошего качества, фабричного изготовления из малогорючего материала. В этой одежде нельзя выходить из рабочей зоны, в частности, в туалет;
- надевают, если это необходимо, защитные повязки на голову и бороду;
- при работе с микроорганизмами III-IV групп патогенности применяют средства индивидуальной защиты согласно [1].
- ногти содержат в исключительной чистоте, хорошо ухоженными, желательно короткими;
- до и после микробиологических исследований и непосредственно после посещения туалета необходимо мыть руки теплой водой, желательно из нерегулируемого вручную крана, используя жидкое или порошковое мыло или дезинфицирующее средство, поступающее из дозирующего устройства, содержащегося на должном уровне чистоты. Для сушки рук используют одноразовые бумажные или матерчатые полотенца;
- при посеве необходимо избегать разговоров, кашля и т.д.;
- не курить, не пить и не принимать пищу в рабочей зоне;
- особые предосторожности должны предприниматься лицами, имеющими инфекцию (панариций) или заболевание, возбудители которого способны заражать пробу, что отразится на результатах;
- не хранить пищевые продукты для личного потребления в лабораторных холодильниках.
6 Подготовка оборудования
6.1 Предварительная подготовка
Подготовка оборудования, используемого в микробиологии, должна гарантировать его чистоту и стерильность вплоть до момента использования.
Оборудование, включая новое, должно быть вымыто перед применением.
Пробирки и флаконы закрывают перед стерилизацией подходящим образом (ватными, металлическими пробками и т.д.). В концы пипеток вкладывают по кусочку ваты или других подходящих материалов.
При необходимости стерилизуемое оборудование помещают в специальные контейнеры или заворачивают в подходящий материал (специальная бумага, алюминиевая фольга и другие). Оборудование стерилизуют в автоклаве отдельно от сред и других водных растворов, доступ пара к нему должен быть свободным, иначе стерилизация будет неэффективной.
6.2 Стерилизация оборудования
6.2.1 Стерилизация сухим горячим воздухом
Оборудование нагревают в стерилизационном шкафу по 4.10 не менее 1 ч при температуре от 170 до 180 °С.
6.2.2 Стерилизация влажным паром
Оборудование нагревают не менее 15 мин при температуре 121 °С и выше в автоклаве (по 4.5), желательно снабженном вакуумной сушилкой. Используют термоиндикаторы для контроля достижения требуемой температуры (например специальную бумагу).
6.2.3 Стерилизация оборудования, используемого для отбора проб
Допускается стерилизация оборудования, применяемого для отбора проб (посуды, инструмента и материалов), в соответствии с ГОСТ 26668.
6.3 Оборудование одноразового использования
Одноразовое оборудование используют таким же образом, как и стеклянную посуду многоразового использования (чашки Петри, пипетки, флаконы, пробирки и другое), если они имеют сходные технические характеристики.
Поэтому желательно получить у изготовителя подтверждение, что предлагаемое оборудование пригодно для микробиологического использования (особенно по стерилизуемости) и что материал не содержит веществ, ингибирующих рост микроорганизмов.
Одноразовое оборудование перед уничтожением обеззараживают. Помимо методов, приведенных в 6.6, может применяться сжигание. Если имеется в распоряжении прокаливатель, обеззараживание и уничтожение могут быть совмещены в одной операции.
6.4 Содержание чистого оборудования
Чистое оборудование хранят в условиях, обеспечивающих сохранность его чистоты и защиту от пыли.
6.5 Содержание стерильного оборудования
Перед использованием оборудование хранят в условиях, обеспечивающих сохранность его стерильности. Одноразовое оборудование хранят в соответствии с рекомендациями изготовителя, без повреждения упаковки. Оборудование, подготовленное в лаборатории, хранят в чистых контейнерах.
При приобретении готового стерильного оборудования для микробиологических целей, проверяют на каждой упаковке наличие информации о сроке годности (или дате изготовления). Герметически упакованное оборудование хранят не более трех месяцев. Упакованное, но не закрытое герметически оборудование хранят в течение более короткого срока (например 8 дней).
6.6 Обеззараживание
После использования (культивирования микроорганизмов или контакта с ними) оборудование и его содержимое, независимо от вида микроорганизмов, обеззараживают перед очисткой или уничтожением. Например, ватные тампоны удаляют из пипеток только после обеззараживания последних, пробирки с жидкой средой обеззараживают непосредственно перед мойкой. Обеззараживание проводят одним из следующих способов:
- стерилизацией влажным паром в автоклаве (по 4.5) не менее 30 мин при температуре 121 °С и выше всего оборудования и материалов, которые контактировали с культурами микроорганизмов (посевы на твердых или жидких питательных средах, зараженные реактивы, оборудование и другое);
- путем погружения коррозийно-устойчивого оборудования, например пипеток, в дезинфицирующий раствор (пипетки полностью погружают в вертикальном положении в раствор, избегая образования в каналах пузырьков воздуха).
При работе с микроорганизмами III-IV групп патогенности обеззараживание оборудования проводят согласно [1].
Пластиковые пипетки используют только однократно. Оборудование из пластмасс может быть сожжено без обеззараживания, если это допускается законами страны.
6.7 Мойка
Оборудование моют только после его обеззараживания. Емкости освобождают от их содержимого. Перед мойкой удаляют с пробок и колпачков печати, если они имеются.
Тщательно моют пробки, колпачки и стеклянную посуду в горячей воде раствором готового детергента.
При его отсутствии может быть использован раствор карбоната натрия массовой долей 0,125% с последующим погружением в разбавленную кислоту (например соляную кислоту НСl концентрации с=0,1 моль/дм).
Все оборудование промывают дистиллированной или равноценной по качеству водой.
Для облегчения операций очистки могут быть использованы специальные устройства (например моечные аппараты для пипеток, чашек, ультразвуковые аппараты и другие).
7 Приготовление и стерилизация питательных сред и реактивов
Тщательное приготовление питательных сред - один из основных этапов микробиологического исследования, требующий особого внимания.
7.1 Дистиллированная вода
Используемая вода должна быть дистиллированной или равноценной по качеству, то есть свободной от веществ, способных ингибировать или воздействовать на рост микроорганизмов в период испытания. Если дистиллированную воду получают из хлорированной, перед перегонкой необходимо нейтрализовать хлор.
Дистиллированную воду хранят в емкостях, изготовленных из инертных материалов (например нейтрального стекла, полиэтилена и т.д.), в которых перед использованием установлено отсутствие ингибирующих веществ.
Примечание - В ряде случаев необходимо использовать свежеприготовленную воду, свободную от растворенного диоксида углерода.
Качество воды оценивают по удельному сопротивлению, которое должно быть не менее 300000 Ом/см.
Примечание - Из-за загрязнения при прохождении через ионообменник деминерализованная вода часто имеет повышенное содержание микроорганизмов, поэтому целесообразно проверять такую воду на их содержание. Следует проконсультироваться с изготовителем ионообменника о возможности применения улучшенных методов, уменьшающих микробиологическое заражение воды. После стерилизации путем фильтрования деионизированной воды, сильно контаминированной микроорганизмами, она, однако, еще может содержать вещества, ингибирующие рост некоторых микроорганизмов.
7.2 Приготовление питательных сред
Для приготовления питательных сред используют два способа:
- из отдельных сухих или жидких компонентов;
- из сухой готовой среды.
Емкости, содержащие отдельные сухие компоненты или сухую готовую среду, хранят в темном сухом месте при температуре, установленной изготовителем.
По истечении установленных сроков годности исходные компоненты и готовые среды не используют.
Если сухие компоненты и среды гигроскопичны, необходимо быстро и тщательно закрывать емкости после взятия навесок. Не используют сухие среды, имеющие признаки слеживания или затвердения, свидетельствующие о поглощении влаги.
7.2.1 Обводнение сухих готовых сред
Использование сухих готовых сред проводят в соответствии с требованиями нормативного документа на конкретную готовую среду и/или рекомендациями изготовителя.
7.2.2 Измерение рН
С помощью рН-метра (по 4.4) измеряют и корректируют рН таким образом, чтобы после стерилизации и охлаждения до 25 °С значение рН среды отличалось от требуемого не более чем на ±0,2 рН (если не оговорены другие условия).
Корректировку обычно проводят с помощью раствора гидроокиси натрия (NaOH) концентрации 40 г/дм (примерно 1 моль/дм
) или соляной кислоты (НСl) концентрации 36,5 г/дм
(примерно 1 моль/дм
).
7.2.3 Разливка сред
Среды разливают в соответствующие емкости вручную или с помощью автоматических аппаратов (по 4.14).
Для предупреждения выбрасывания среды при стерилизации в автоклаве используют емкость, имеющую объем в 2-З раза больший объема разливаемой среды.
7.3 Стерилизация
Стерилизацию питательных сред и реактивов проводят различными способами, в том числе:
- влажным паром;
- фильтрованием.
В соответствии с требованиями нормативного документа на конкретный метод испытаний и/или рекомендаций изготовителя некоторые среды и реактивы используют без специальной стерилизации.
После стерилизации среды проверяют ее рН, цвет, стерильность и бактериологическую пригодность.
7.3.1 Влажная стерилизация
Влажная стерилизация проводится в отдельном автоклаве (4.5) или в аппарате для приготовления и разливки сред. Обычно эту операцию проводят при температуре 121 °С (245 кПа) в течение 15 мин. Для объемов сред, превышающих 1 дм, продолжительность стерилизации может быть изменена. Во всех случаях следуют указаниям нормативного документа на конкретный метод испытания или инструкциям изготовителя.
Перед стерилизацией емкости со средами должны быть снабжены полосками термочувствительной бумаги (имеющейся в продаже) в количестве, достаточном для фиксирования достижения желаемой температуры во всех частях автоклава.
7.3.2 Стерилизация фильтрованием
Стерилизацию фильтрованием проводят с использованием вакуума или избыточного давления.
При этом используют мембраны и фильтры диаметром пор 0,22 мкм. Перед применением они должны быть простерилизованы в автоклаве (4.5). Закупленные в готовом стерильном состоянии фильтрующие элементы или мембраны используют в соответствии с инструкциями изготовителя.
Различные детали фильтрующих устройств, в собранном или разобранном виде, стерилизуют в автоклаве (4.5) в течение 15 мин при температуре 121 °С. В случае необходимости после автоклавирования проводят сборку этих устройств в асептических условиях в стерильном боксе. Некоторые устройства в собранном виде могут быть закуплены в стерильном состоянии.
7.4 Хранение
Каждая упаковка бутылей, пробирок или чашек Петри должна быть этикетирована и содержать следующую информацию:
- название среды;
- дату приготовления и/или дату истечения срока годности.
7.4.1 Питательные среды и реактивы лабораторного изготовления
Питательные среды, разлитые в бутыли и пробирки, а также реактивы, не использованные немедленно, предохраняют от света и высыхания (например используют при хранении резиновые пробки или завинчивающиеся крышки).
Если не оговорено в нормативном документе на конкретный метод испытания, среды хранят в холодильнике (4.7) не более трех месяцев или при температуре 18-23 °С не более одного месяца в условиях, не допускающих изменения их состава.
Подсохшие среды не используют.
Перед использованием желательно температуру питательной среды довести до температуры в помещении лаборатории.
7.4.2 Готовые питательные среды и реактивы
Готовые питательные среды и реактивы используют в соответствии с инструкциями изготовителя, в которых должны быть указаны сроки годности, температура и условия хранения, условия применения (рН и прочее), контроль качества.
7.5 Расплавление агаровых питательных сред
Питательные среды расплавляют на кипящей водяной бане или другим способом, который дает аналогичный результат (например текучим паром в автоклаве или с помощью микроволновой печи). Избегают перегрева среды и удаляют ее сразу же после расплавления. Перед использованием питательную среду содержат в расплавленном состоянии на бане с терморегулятором (4.9) при температуре (47±2) °С. Питательную среду температурой выше 50 °С не используют. Сохраняют расплавленную питательную среду не более 8 ч. Не использованную до конца среду после ее затвердения не применяют.
В случае особо чувствительных питательных сред длительность нахождения в расплавленном состоянии следует сократить в соответствии с требованиями стандарта на конкретный метод испытания.
7.6 Деаэрирование питательных сред
При необходимости деаэрирования питательную среду нагревают непосредственно перед использованием на кипящей водяной бане или текучим паром в течение 15 мин, пробки или крышки приоткрывают. После прогревания их плотно закрывают и быстро охлаждают среду до рабочей температуры.
7.7 Подготовка чашек Петри
Расплавленную агаровую питательную среду наливают в чашки Петри таким образом, чтобы толщина ее слоя была не менее 2 мм (например для чашек диаметром 90 мм обычно требуется 12 см агаровой среды). Затем для охлаждения и затвердевания среды чашки Петри помещают на холодную горизонтальную поверхность.
Приготовленные таким образом чашки Петри используют немедленно или хранят при условиях, предупреждающих изменение их состава, т.е. в темноте и в холодильнике (по 4.7), не более одной недели. Этот срок может быть удлинен или сокращен согласно требованиям, установленным стандартом на конкретный метод испытания. Маркировку чашек выполняют по 7.4.
Чашки используют после подсушивания. При поверхностном посеве чашки обычно подсушивают с открытыми крышками и перевернутой вниз поверхностью агара в сушильном шкафу при температуре от 25 до 50 °С до тех пор, пока с поверхности среды не исчезнут капли влаги, при этом стараясь не пересушить их дольше. Агар в чашках может быть также подсушен в ламинарном шкафу биологической безопасности выдерживанием в течение 30 мин с полуоткрытыми крышками или в течение ночи - в закрытом состоянии.
Готовые к использованию покупные чашки с агаром хранят и используют в соответствии с инструкциями изготовителя.
8 Лабораторные пробы
8.1 Отбор проб
Очень важно, чтобы лаборатория получала пробы, которые были бы действительно представительными для продукта и не были повреждены и изменены во время транспортирования или хранения.
Отбор проб проводится в соответствии с требованиями специализированных стандартов, разработанных для рассматриваемых групп продукции.
При отсутствии специализированных стандартов отбор проб проводится по ГОСТ 26668 или по специальному соглашению между заинтересованными сторонами.
8.2 Транспортирование проб
При транспортировании проб в лабораторию обеспечивают их содержание в условиях, предупреждающих любые изменения количества микроорганизмов, присутствующих в них. Предпочтение отдают наиболее быстрым способам транспортирования.
Особое внимание обращают на соблюдение следующих температур при хранении нижеперечисленных продуктов:
- устойчивые продукты - температура окружающей среды;
- свежие и охлажденные продукты - от 0 до 4 °С;
- продукты замороженные и глубокой заморозки - ниже минус 18 °С;
- пастеризованные и аналогичные продукты - от 0 до 4 °С;
- образцы испорченных устойчивых продуктов - от 0 до 4 °С.
ПРЕДОСТЕРЕЖЕНИЕ - Нестойкие пищевые продукты (например субпродукты, свежая рыба) следует хранить при температуре от 0 до 2 °С.
Образцы испорченных устойчивых продуктов должны транспортироваться в закрытых упаковках для защиты от возможного протекания.
8.3 Приемка и хранение проб
При поступлении проб персонал лаборатории должен проверить их состояние. Если состояние неудовлетворительное или пробы не соответствуют требованиям, лаборатория должна отбраковать их. В особых случаях можно провести испытания таких проб, но в протоколе испытаний должно быть дано обоснование полученных результатов.
Принятые лабораторией пробы документируют таким образом, чтобы их движение вплоть до составления протокола испытаний можно было проконтролировать.
Должна быть зафиксирована следующая информация:
- дата поступления пробы;
- особенности процедуры отбора проб (дата отбора, условия отбора и другие);
- имя и адрес заявителя;
- характеристики продукта.
Пробы перед исследованием хранят в условиях, предупреждающих любое изменение в количестве присутствующих микроорганизмов.
Особое внимание должно быть уделено температуре хранения и предельным срокам проведения исследований для следующих продуктов:
- устойчивые продукты - как можно быстрее, до истечения предельных сроков хранения;
- свежие и охлажденные продукты - в течение 24 ч после получения, при необходимости более длительного хранения пробы быстро замораживают при температуре ниже минус 18 °С и отмечают это в протоколе испытаний, потому что замораживание отдельных продуктов изменяет состав микрофлоры;
- пастеризованные и аналогичные им продукты - как можно быстрее, до истечения предельных сроков хранения;
- образцы испорченных устойчивых продуктов - как можно быстрее, не более 48 ч.
8.4 Отбор навесок пробы
Чтобы избежать заражения окружающей среды и навески, рекомендуется работать в специальном помещении или в боксе. При их отсутствии продукты, для которых заранее известно, что они содержат мало микроорганизмов (например пастеризованные продукты или готовые к употреблению блюда), всегда исследуют в первую очередь, и вслед за ними - более зараженные.
Защита окружающей среды от заражения особенно важна при взвешивании и приготовлении навесок проб интенсивно зараженных порошкообразных продуктов. Эту операцию следует проводить в боксе.
При отборе навесок принимают все меры по исключению любого риска их загрязнения. Для этого предпринимают следующие меры предосторожности:
- если не используют бокс, то работают вблизи открытого пламени;
- в случае упакованных продуктов очищают наружную сторону упаковки в месте ее вскрытия 70%-ным этанолом; если возможно - фламбируют;
- любой инструмент, который применяют для вскрытия упаковки (консервный нож, ножницы и другой), должен быть стерильным;
- любой инструмент, используемый для отбора навески пробы (ложка, пинцет, пипетка и другой), должен быть стерильным;
- на пластиковый пакет, сосуд и другую емкость (8.3) с навеской осторожно (аккуратно) наносят маркировку, позволяющую идентифицировать исходный образец (пробу).
8.5 Хранение и обеззараживание лабораторных образцов
Кроме особых случаев, лабораторные образцы сохраняют до получения всех результатов анализов, если необходимо, то и более длительное время. Образцы упаковывают в стерильные емкости или пластиковые пакеты и хранят при температуре хранения данного продукта. Охлажденные свежие продукты хранят в замороженном виде.
Испорченные и представляющие опасность лабораторные образцы перед выбрасыванием обеззараживают. Неиспорченные лабораторные образцы выбрасывают без обработки.
9 Методы исследований и обработка результатов
9.1 Гигиенические меры предосторожности при проведении исследований
Для того, чтобы проводить работы в максимально асептических условиях, предпринимают следующие меры предосторожности:
- удостоверяются, что рабочая зона является чистой и отсутствуют сквозняки (двери и окна закрыты);
- обеззараживают рабочую поверхность до и после работы подходящим дезинфицирующим средством;
- перед началом работы удостоверяются в том, что все необходимое для ее проведения, имеется в наличии;
- при проведении работ в стерильном боксе используют стерильные перчатки или перед началом работы обеззараживают руки (например смесью высокомолекулярных спиртов), в процессе работы избегают скрещивания рук;
- при работе вне стерильного бокса открывают пробирки и флаконы в зоне пламени, удерживая их в максимально наклоненном положении;
- работу выполняют как можно быстрее, избегая ненужных движений;
- если в ходе исследований содержимое бокса с пипетками, чашками Петри и т.д. не используют целиком, то после изъятия нужного количества предметов бокс надежно закрывают;
- стерилизуют петли и иглы в пламени до и после употребления; чтобы избежать разбрызгивания веществ и микроорганизмов, используют прокаливатель (по 4.13); при любой возможности применяют одноразовые пипетки и иглы;
- перед обеззараживанием по 6.6 использованные пипетки, шпатели и т.д. помещают в специальные сосуды, содержащие подходящее дезинфицирующее средство (например пипетки помещают в раствор гипохлорита натрия);
- перед обеззараживанием чашки Петри, питательные среды и прочее оборудование, которое может содержать микроорганизмы, помещают в специальные контейнеры, затем подвергают мойке;
- перед обеззараживанием или сжиганием по 6.6 одноразовое оборудование помещают в подходящие контейнеры;
- немедленно удаляют любые брызги зараженных и других продуктов с помощью ватных тампонов или других подходящих материалов, смоченных 70%-ным этанолом или другим дезинфицирующим средством; перед продолжением работы моют и дезинфицируют рабочую поверхность.
Обращение с продуктами, предположительно зараженными патогенными бактериями (Salmonella, Listeria monocytogenes и т.д.) или токсинами, требует особых мер предосторожности, которые приведены в нормативных документах по безопасности проведения работ в микробиологических лабораториях (например СП 1.2.731). Рекомендуемые меры предосторожности:
- все этапы исследования должны проводиться в стерильном боксе;
- запрещается наполнять пипетки путем засасывания ртом, для этой цели необходимо использовать резиновую грушу или другое механическое устройство.
Аэрозоли являются основной причиной заражения окружающей среды и инфицирования. Аэрозоли образуются при:
- открытии чашек Петри, пробирок и флаконов;
- использовании смесителей, шприцов, центрифуг и т.д.;
- опорожнении пипеток выдуванием;
- стерилизации петель и игл после влажной инокуляции;
- открытии ампул, содержащих лиофилизированные культуры микроорганизмов.
9.2 Приготовление исходной суспензии и разведений
Приготовление исходной суспензии и разведений - по ГОСТ 26669.
Период времени между окончанием приготовления исходной суспензии и посевом на питательную среду не должен превышать 45 мин, если не оговорено иное в соответствующем стандарте на метод испытания конкретного вида продукта.
9.3 Метод подсчета с использованием твердой среды
9.3.1 Посев на агар в чашках Петри
Готовят среды (содержащуюся на водяной бане при 47 °С в расплавленном состоянии), чашки Петри, жидкость для разведений и разведения, подлежащие исследованию в соответствии с 9.2, в объемах и количествах, предусмотренных планом посева, установленным в соответствии с конкретным стандартом на метод испытания.
В маркированные чашки Петри вносят предусмотренные объемы разведений, подлежащих исследованию. Наливают в каждую чашку объем среды в соответствии с 7.7. Незамедлительно и тщательно перемешивают расплавленную среду и посевной материал так, чтобы микроорганизмы равномерно распределились в массе среды. Для охлаждения и застывания оставляют чашки Петри на холодной горизонтальной поверхности (время затвердения агара не должно превышать 10 мин).
Если в исследуемом продукте предполагается присутствие микроорганизмов, образующих при росте налеты на поверхности среды (“ползучий” рост колоний, например Proteus spp.), то при выполнении исследований чашки Петри с посевным материалом заливают сверху стерильным голодным агаром или же агаром, идентичным питательной среде.
9.3.2 Поверхностный посев
Посевной материал вносят в центр маркированной чашки Петри на поверхность агаровой питательной среды (приготовленной в соответствии с 7.7). Как можно быстрее равномерно распределяют его по поверхности среды с помощью стерильного стеклянного или пластикового шпателя до тех пор, пока на поверхности агара не останется видимых следов жидкости.
Для улучшения распределения могут быть использованы стеклянные шарики. В некоторых случаях, установленных в стандартах на конкретные методы испытаний, посевной материал наносят на мембрану и затем распределяют с помощью стеклянных шариков.
9.3.3 Термостатирование
Засеянные чашки немедленно переворачивают и быстро помещают в термостат, установленный на соответствующую температуру (кроме особо оговоренных случаев). Если наблюдается чрезмерное обезвоживание среды (например при 55 °С или вследствие интенсивной циркуляции воздуха), чашки перед термостированием неплотно укладывают в пластиковый пакет или аналогичное приспособление с тем же эффектом. В период термостатирования допускаются кратковременные колебания температуры, например, во время таких обычных операций, как загрузка или разгрузка термостата.
Примечание - В отдельных случаях, чтобы не спутать частицы исследуемого продукта с колониями микроорганизмов, полезно приготовить дубликаты засеянных чашек, которые хранят при температуре 2 °С для последующего сопоставления при подсчете с инкубированными засеянными чашками.
Чашки следует анализировать непосредственно после термостатирования. В других случаях, кроме особо оговоренных, их хранят не более 24 ч в холодильнике (4.7).
9.3.4 Подсчет колоний
После термостатирования, установленного соответствующим стандартом на конкретный метод испытания, подсчитывают количество колоний на каждой чашке, содержащей менее 300 колоний (или менее другого количества, установленного соответствующим стандартом на конкретный метод испытания).
Примечание - В некоторых случаях подсчет колоний может быть затруднен (например в присутствии инвазивных микроорганизмов). Эти случаи рассматриваются в соответствующих стандартах на конкретные методы испытаний.
9.3.5 Обработка результатов
9.3.5.1 Метод расчета (общий случай)
Для получения достоверных результатов при подсчете количества колоний необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний.
Количество микроорганизмов в 1 г (см
) пробы вычисляют как средневзвешенное значение из подсчетов на двух последовательных разведениях по формуле
![]() ,
,
где - сумма колоний, подсчитанных на всех чашках в двух последовательных разведениях, из которых хотя бы одна чашка содержит не менее 15 колоний;
- объем посевного материала, внесенного в каждую чашку, см
;
- количество отобранных для подсчета чашек в первом разведении;
- количество отобранных для подсчета чашек во втором разведении;
- коэффициент разбавления, соответствующий первому разведению.
Результат вычисления округляют до двух значащих цифр. Для этого, если последняя цифра меньше 5, предшествующую цифру не изменяют; если последняя цифра равна или более 5, предшествующую увеличивают на единицу. Округление проводят поэтапно до получения двух значащих цифр.
За результат принимают количество микроорганизмов в 1 см (жидкие продукты) или в грамме (прочие продукты), выраженное в виде числа от 1,1 до 9,9, умноженного на 10 в соответствующей степени.
ПРИМЕР
![]() .
.
Округление результата дает 19000 или 1,9·10 микроорганизмов в грамме продукта.
9.3.5.2 Метод расчета при проведении идентификации
Если используемый метод требует идентификации, определенное количество колоний (обычно 5) пересевают с каждой чашки, отобранной для подсчета колоний. После идентификации рассчитывают для каждой чашки количество идентифицированных микроорганизмов
по формуле
![]() ,
,
где - количество колоний, соответствующих критериям идентификации;
- общее количество колоний.
Результат вычисления округляют до целого числа, как описано в 9.3.5.1.
Количество идентифицированных микроорганизмов, присутствующих в 1 г (см
) испытуемой пробы рассчитывают как средневзвешенное значение по 9.3.5.1, заменив
на
.
ПРИМЕР
Прямой подсчет жидкого продукта дал следующие результаты:
- в первом выбранном разведении (10) в двух чашках выявлено соответственно: 66 и 80 колоний;
- во втором выбранном разведении (10) - 4 и 7 колоний.
Результаты идентификации:
из чашки с 66 колониями для идентификации отобрано 8 колоний, из которых 6 соответствовали критериям; следовательно =50;
из чашки с 80 колониями отобрано 9 колоний, из которых 6 соответствовали критериям; следовательно =53;
из чашки с 7 колониями отобрано 5 колоний, из которых 4 соответствовали критериям; следовательно =6;
из чашки с 4 колониями все 4 идентифицированы положительно; следовательно =4.
![]() .
.
Таким образом, количество обнаруженных в пробе микроорганизмов составляет 5,1·10 в 1 см
.
9.3.5.3 Приближенные оценки количества микроорганизмов
9.3.5.3.1 Если в каждой из двух чашек содержится менее 15 колоний на уровне исходной пробы (жидкие продукты) или исходной суспензии (прочие продукты), то рассчитывают среднее арифметическое колоний, подсчитанных на этих чашках.
Результат выражают следующим образом:
- для жидких продуктов - приближенное количество микроорганизмов в 1 см
![]() ;
;
- для прочих продуктов - приближенное количество микроорганизмов в 1 г ![]() , где
, где - коэффициент разбавления исходной суспензии.
9.3.5.3.2. Если две чашки не содержат колоний на уровне исходной пробы (жидкие продукты) или исходной суспензии (прочие продукты), то результаты выражают следующим образом:
- менее 1 микроорганизма в 1 см (жидкие продукты);
- менее 1/ микроорганизмов в 1 г (прочие продукты), где
- коэффициент разбавления исходной суспензии.
9.3.6 Доверительные пределы
Для того, чтобы определить достоверность результатов и избежать слишком однозначной их трактовки, необходимо рассчитать доверительные интервалы, которые характеризуют статистическое распределение микроорганизмов в образце.
Прочие погрешности связаны с самими используемыми методами исследований, особенно с ошибками разведений. Влияние этих погрешностей на результаты испытаний может быть разным для разных лабораторий.
9.3.6 Метод расчета (общий случай)
Доверительный интервал , характеризующий статистическое распределение микроорганизмов в пробе при доверительной вероятности Р=0,95, рассчитывают по формуле:
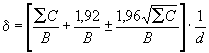 ,
,
где ![]()
- сумма колоний, подсчитанных на всех отобранных чашках;
- количество чашек, отобранных в первом разведении;
- количество чашек, отобранных во втором разведении;
- объем посевного материала, внесенный в каждую чашку, см
;
- коэффициент разбавления, соответствующий первому разведению.
ПРИМЕР 1. Случаи экстремальных количеств колоний (см. таблицу 1)
Таблица 1
Количество подсчитанных колоний | Средневзвешенное | Доверительный интервал | |
Разведение | Разведение | ||
300 | 30 | 300 | От 278 до 324 |
300 | 30 | От -7 до +8% | |
15 | 1 | 14 | От 10 до 20 |
15 | 1 | От -29 до +43% | |
ПРИМЕР 2. Доверительный интервал для примера, приведенного в 9.3.5.1 при =1,9х10
в грамме для 422 подсчитанных колоний, составляет
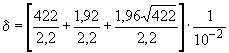 .
.
или
![]() .
.
Отсюда пределы доверительного интервала составляют:
![]() и
и ![]() .
.
Доверительный интервал, выраженный в процентах и рассчитанный по неокругленным значениям, составляет от минус 9,1 до +10% включительно.
9.3.6.2 Расчет при проведении идентификации
Доверительный интервал , характеризующий статистическое распределение микроорганизмов в пробе при доверительной вероятности Р=0,95, рассчитывают по формуле, приведенной в 9.3.6.1, заменив
на
.
ПРИМЕР. Для случая, рассмотренного в 9.3.5.2, количество микроорганизмов в 1 см
составило 5,1х10
при 113 идентифицированных, отсюда
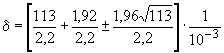 .
.
или
![]() .
.
Отсюда пределы доверительного интервала составляют
![]() и
и ![]() .
.
В рассматриваемом случае доверительный интервал, выраженный в процентах, составляет от минус 16,7 до +20,1% включительно.
9.3.6.3 Доверительные интервалы при приближенной оценке количества микроорганизмов
Доверительные интервалы приведены в таблицах А.1 и А.2.
9.4 Метод подсчета с использованием жидкой среды. Метод наиболее вероятного числа (НВЧ)
Примечание - Возможны два способа посева. В наиболее часто используемом способе, называемом “симметричным”, применяется одинаковое количество пробирок в каждом разведении, объемы соседних разведений обычно соотносятся как 1:10. Этот способ используют, если нужно определить не только превышение определенных предельных норм, но и количество присутствующих микроорганизмов. Используют также способ называемый “асимметричным”, который предусматривает разное количество пробирок в отдельных разведениях. В данном стандарте рассматривается только “симметричный” способ с десятикратными разведениями.
9.4.1 Посев
В зависимости от требуемой точности результатов засевают необходимое количество флаконов или пробирок одним и тем же разведением (например три, пять или десять). Как правило, применяемые методы требуют трех пробирок или флаконов на разведение.
Посевной материал вносят в флаконы или пробирки с помощью пипетки. Для каждого разведения используют новую стерильную пипетку.
9.4.2 Термостатирование
Помещают засеянные флаконы и/или пробирки в термостат или, предпочтительнее, в водяную баню с терморегулятором (4.9).
9.4.3 Оценка результатов
9.4.3.1 Выбор разведений
Примечание - Исходная суспензия и исходная жидкая проба также рассматриваются как разведение.
В общем случае, когда в каждом разведении засевают три пробки или флакона, для каждого испытуемого образца отбирают три последовательных разведения в соответствии с 9.4.3.1.1, 9.4.3.1.2 или 9.4.3.1.3.
9.4.3.1.1 Вариант 1
По крайней мере одно разведение содержит три положительные пробирки согласно таблице 2.
Выбирают самое высокое разведение (наименьшая концентрация пробы) из тех, которые содержат три положительные пробирки, а также два последующих более высоких разведения, в которых концентрация пробы составляет 1/10 и 1/100 от концентрации в первом выбранном разведении. Пример 1 из таблицы 2, а также 9.4.3.1.2.
Если вслед за высоким разведением с тремя положительными пробирками отсутствуют последующие высокие разведения, то выбирают три наиболее высоких разведения серии (наименьшей концентрации пробы). Пример 2 из таблицы 2, а также 9.4.3.1.2.
Таблица 2 - Пример выбора положительных результатов при расчете значения НВЧ
Пример | Количество положительных пробирок среди трех засеянных при следующих количествах пробы, высеянной в пробирку*: | НВЧ** | |||||
Жидкие продукты | |||||||
10 см | 1 см | 10 | 10 | 10 | Жидкие продукты, см | Прочие | |
Прочие продукты | |||||||
1 г | 10 | 10 | 10 | 10 | |||
1 | 3 | 3 | 2 | 1 | 0 | 1,5 х 10 | 1,5 х 10 |
2 | 3 | 3 | 3 | 0 | - | 2,4 х 10 | 2,4 х 10 |
3 | 2 | 2 | 1 | 1 | 0 | 7,4 | 7,4 х 10 |
4 | 3 | 3 | 0 | 0 | 0 | 2,4 | 2,4 х 10 |
5 | 2 | 2 | 0 | 1 | 0 | 2,1 х 10 | 2,1 |
* Выбранные комбинации выделены жирным шрифтом. | |||||||
9.4.3.1.2 Вариант 2.
Ни одно из разведений не содержит трех положительных пробирок
В случае, когда вариант 1 не может быть использован, отбирают три наивысших разведения серии, т.е. содержащие наименьшую концентрацию пробы, которые содержат, по крайней мере, один положительный результат. Пример 3 из таблицы 2, а также 9.4.3.1.3.
9.4.3.1.3 Особые случаи
Во всех случаях, когда более одного из трех разведений, отобранных в соответствии с 9.4.3.1.1 и 9.4.3.1.2, не содержат положительные пробирки, выбирают самое низкое разведение (наибольшей концентрации пробы), которое не содержит положительные пробирки, и два предшествующих низких разведения, концентрация пробы в которых в 10 или 100 раз превышает первое выбранное разведение; см. пример 4 и 5 из таблицы 2. Исключение составляют случаи, когда положительные пробирки присутствуют только в первом разведении, приготовленном из исходной пробы. В последнем варианте необходимо для расчета НВЧ использовать первые три разведения, даже если два разведения в этой серии не содержат положительные пробирки.
9.4.3.2 Расчет наиболее вероятного числа микроорганизмов
9.4.3.2.1 Выбирают желаемую категорию надежности результатов и в соответствии с количеством проанализированных проб, взятых от партии, по таблице Б.1 проверяют, является ли количественное сочетание положительных пробирок в разведениях, выбранных по 9.4.3.1, удовлетворительным со статической точки зрения. Приемлемость результатов зависит как от количества проанализированных проб, так и от решения - использовать или отбросить результаты, отнесенные к категории 2 или 3 по таблице Б.2.
Например, если желательны только результаты категории 1, то сочетание 221 может быть приемлемо, если были проанализированы 10 проб исследуемой партии. Если же устраивают менее вероятные результаты категории 2, то сочетание 221 может быть приемлемым и в случае, когда проанализированы две, три или пять проб. Если сочетание 221 получено при исследовании только одной пробы, оно является неприемлемым ни при каких обстоятельствах.
9.4.3.2.2 Значения индекса НВЧ для всех приемлемых согласно 9.4.3.2.1 сочетаний находят по таблице Б.1.
9.4.4 Обработка результатов
С помощью индекса НВЧ, взятого из таблицы Б.1 согласно 9.4.3.2, определяют наиболее вероятное количество микроорганизмов в заданном объеме
по формуле
![]() ,
,
где - индекс НВЧ, взятый из таблицы Б.1 для базового разведения
;
- число, обратное коэффициенту разбавления исходной пробы. Это разведение (1,0) использовано в таблице Б.1 как базовое разведение (обычно
=10,100 и т.д.);
- заданный объем, выбранный для выражения содержания микроорганизмов;
- объем, использованный для посева базового разведения.
Если наименьшее разведение из отобранных соответствует пробирке, приготовленной из среды двойной концентрации (посев 10 см), индекс НВС*, взятый из таблицы Б.1, делят на 10.
_______________
* Здесь и далее по тексту. Вероятно ошибка оригинала. Следует читать НВЧ (см. пункт 9.4, приложение Б). - Примечание "КОДЕКС".
Если НВЧ меньше 0,3 микроорганизмов в 1 см (жидкие продукты) или в 1 г (другие продукты) и если была использована методика, предназначенная для малых количеств микроорганизмов, результаты должны выражаться следующим образом: менее 1 микроорганизма в 1 см
для жидких продуктов или 1 г для прочих продуктов.
ПРИМЕР. Для твердого продукта установлен индекс НВС*, равный 24; первая выбранная пробирка соответствует посеву 1 см исходной суспензии (
=10), отсюда
, в г составляет
![]() .
.
_______________
* Вероятно ошибка оригинала. Следует читать НВЧ (см. пункт 9.4). - Примечание "КОДЕКС".
9.4.5 Доверительные пределы
Доверительные пределы приведены в таблице Б.1.
Учитывая, что при использовании методов НВЧ наблюдается значительный разброс результатов, они должны использоваться с осторожностью.
9.5 Метод обнаружения
Метод обнаружения - это метод, который определяет наличие или отсутствие микроорганизмов в заданном объеме продукта.
9.5.1 Сущность метода
Если не установлено иное в конкретных стандартах на методы испытаний, количество испытываемого продукта смешивают (жидкие продукты) или гомогенизируют (прочие продукты) с 9
см
или г элективной или селективной жидкой среды. После термостатирования, желательно в бане с терморегулятором (по 4.9), распределяют бактериологической петлей выросшую культуру на поверхности селективной агаровой среды таким образом, чтобы получить изолированные колонии. После термостатирования несколько колоний (обычно пять) подвергают идентификации.
В некоторых случаях для оживления микроорганизмов, подвергшихся стрессовым воздействиям, желательно предварить обогащение элективной или селективной жидкой среды обогащением питательного бульона. Иногда имеет смысл использовать для тех же целей две или более элективные или селективные жидкие среды, а также две или более селективные агаровые среды.
9.5.2 Оценка результатов
Если искомый микроорганизм обнаружен, результат выражают следующим образом:
- “обнаружен, при этом указывается навеска исследуемого продукта”.
Если искомый микроорганизм отсутствует, результаты выражают следующим образом:
- “не обнаружен, при этом указывается навеска исследуемого продукта”.
Ни при каких обстоятельствах результат не распространяют на иное, большее количество продукта.
9.6 Основные методы идентификации
9.6.1 Приготовление чистых культур
9.6.1.1 Общие положения
Приготовление чистых культур начинают с выделения колоний на/или в агаровой среде, которая была засеяна разведением испытуемой пробы или культурой.
Выделенную колонию затем пересеивают на неселективную агаровую среду. После термостатирования выделяют хорошо изолированную колонию. В случае необходимости повторяют пересев.
Используют метод посева на агар в чашках Петри, описанный в 9.6.1.2. В особых случаях могут быть использованы и другие методы. Для анаэробных микроорганизмов может также применяться методика, приведенная в 9.6.1.2, с условием, что культура будет контактировать с воздухом минимально короткое время.
9.6.1.2 Рассев
Кончиком стерильной петли берут небольшое количество материала с поверхности хорошо изолированной колонии. Затем рассеивают или непосредственно клетки, присутствующие на петле (9.6.1.2.1), или суспензию этих клеток после ее приготовления (по 9.6.1.2.2).
9.6.1.2.1 Метод прямого рассева
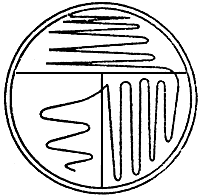
Рисунок 1 - Пример рассева. Прямой метод
Пример
Кончиком петли засевают тесными штрихами примерно третью часть поверхности агаровой среды. Стерилизуют и охлаждают петлю. От края засеянной поверхности продолжают другую, более разряженную, серию штрихов, засевая половину свободной площади. Повторяют процедуру на оставшейся поверхности, делая еще более редкие штрихи.
9.6.1.2.2 Метод с использованием жидкости для разведений
Клетки суспензируют в 1-2 см жидкости для разведений, растирая посевной материал петлей о стенки пробирки у поверхности жидкости, затем хорошо перемешивают.
Стерилизуют и охлаждают петли. Захватывают петлей небольшое количество микробной суспензии и далее действуют согласно 9.6.1.2.1.
9.6.1.3 Термостатирование
Кроме особо оговоренных случаев, переворачивают засеянные чашки Петри, помещают их в термостат и выдерживают при выбранной температуре в течение заданного времени.
9.6.1.4 Выделение
После термостатирования выделяют с чашки Петри хорошо изолированную колонию для последующего рассева или проведения испытания.
Заключительные испытания следует по возможности проводить на клетках, полученных с одной изолированной колонии. Если материала с одной колонии недостаточно, из нее предварительно выращивают субкультуру на жидкой среде или на агаровых чашках Петри. После этого субкультура может быть использована для проведения испытаний.
9.6.2 Окрашивание по Граму (модифицированный метод Хаккера)
Это окрашивание бактериальных клеток позволяет описать морфологию бактерий и классифицировать их на две группы на основании способности образовывать в условиях испытания фиолетовое окрашивание с кристаллическим фиолетовым. Это разделение является следствием различий в структуре клеточных стенок двух групп и коррелирует с другими основными различиями между этими группами. Имеется целый ряд способов окрашивания по Граму, однако все они основаны на методе, приведенном ниже.
9.6.2.1 Растворы
Могут быть использованы готовые имеющиеся в продаже растворы. В этом случае следуют рекомендациям изготовителя.
9.6.2.1.1 Раствор кристаллического фиолетового состоит из:
кристаллического фиолетового | - 2,0 г; |
этанола (95%) | - 20 см |
аммония оксалата (C | - 0,8 г; |
дистиллированной воды | - 80 см |
Приготовление
Растворяют кристаллический фиолетовый в этаноле оксалата аммония - в дистиллированной воде.* Смешивают два раствора и оставляют смесь на 24 ч перед использованием.
_______________
* Текст соответствует оригиналу. - Примечание "КОДЕКС".
9.6.2.1.2 Раствор иода состоит из:
иода | - 1,0 г; |
калия иодида | - 2,0 г; |
дистиллированной воды | - 100 см |
Приготовление
Растворяют иодид калия в 10 см дистиллированной воды и добавляют порциями иод. После растворения доводят до 100 см
в мерной колбе.
9.6.2.1.3 Раствор сафранина состоит из:
сафранина О | - 0,25 г; |
этанола (95%) | - 10 см |
дистиллированной воды | - 100 см |
Приготовление
Растворяют сафранин в этаноле, затем смешивают с дистиллированной водой.
9.6.2.2 Техника окрашивания
После фиксации на предметном стекле бактериальной пленки из 18-24-часовой культуры или забродившего бульона заливают пленку раствором кристаллического фиолетового (9.6.2.1.1) и оставляют на одну минуту для протекания реакции.
Стекло в наклонном положении осторожно промывают несколько секунд водой. Наносят на стекло раствор иода (9.6.2.1.2) и оставляют на 1 мин для протекания реакции.
Стекло в наклонном положении осторожно промывают несколько секунд водой.
Стекло в наклонном положении осторожно и непрерывно промывают этанолом (95%) в течение не более 30 с до прекращения вымывания фиолетового красителя.
Стекло в наклонном положении осторожно промывают водой для удаления этанола.
Наносят на стекло раствор сафранина (по 9.6.2.1.3) и оставляют на 10 с.
Стекло в наклонном положении осторожно промывают водой.
Высушивают стекло.
9.6.2.3 Оценка результатов
Стекло просматривают под микроскопом (4.12), используя для этого светосильный объектив с масляной иммерсией. Бактериальные клетки, окрашенные в синий или фиолетовый цвет, относят к грамположительным (Грам+); другие, окрашенные в цвета от темно-розового до красного, относят к грамотрицательным (Грам-).
У чистых культур некоторых типов бактерий в поле микроскопа могут присутствовать как грамположительные, так и грамотрицательные клетки.
Примечание - Плотные скопления клеток могут давать нетипичную картину окрашивания.
9.6.3 Проба на каталазу
Обнаружение этого фермента, который разлагает перекись (пероксид) водорода (НО
) на воду и кислород, можно проводить, используя бульонную культуру или отдельную колонию на агаровой среде.
Если в конкретных стандартах на методы испытаний не установлены другие требования, то во всех случаях питательная среда не должна содержать кровь. Исключение составляет кровь, подвергшаяся термической обработке (среда с вареной кровью).
Примечания
1 Некоторые молочнокислые бактерии при их культивировании в отсутствие глюкозы или ее присутствии в низкой концентрации (0,1%) содержат “псевдокаталазу”, которая не имеет гемовой группы.
2 В случае анаэробных бактерий перед добавлением перекиси (пероксида) водорода культуру выдерживают 30 с на открытом воздухе.
9.6.3.1 Проба на каталазу с бульонной культурой
К 1 см культуры добавляют 0,5 см
раствора перекиси (пероксида) водорода массовой долей 3% (1:10 по объему). Отмечают появление пузырьков кислорода (положительная проба на каталазу) или их отсутствие (отрицательная проба на каталазу).
9.6.3.2 Проба на каталазу с культурой на агаровой среде
На культуру наносят 1-2 см раствора перекиси водорода массовой долей 3% (1:10 по объему). Немедленно, а также через 5 мин наблюдают образование или отсутствие пузырьков кислорода.
9.6.3.3 Проба на каталазу с колонией
На предметное стекло наносят отдельно две капли раствора перекиси водорода массовой долей 3% (1:10 по объему). Отделяют колонию от среды стерильным стеклом или пластиковой палочкой (но не металлической иглой) и осторожно диспергируют ее в одной из капель. Немедленно, а также через несколько минут (но не менее 1 мин) отмечают отсутствие или образование пузырьков кислорода. В сомнительном случае покрывают обе капли предметным стеклом и сравнивают наличие пузырьков в обеих каплях.
Наблюдения проводят визуально или с помощью микроскопа при малом увеличении.
9.6.4 Проба на оксидазу
Обнаружение оксидазы проводят по измерению окрашивания компонентов вследствие окисления под действием этого фермента
9.6.4.1 Реактив
9.6.4.1.1 Состав:
N, N, N', N'-Тетраметил--фенилендиамин
дигидрохлорид (C | - 1,0 г; |
дистиллированная вода | - 100 см |
9.6.4.1.2 Приготовление
Растворяют реактив в холодной воде. Реактив готовят непосредственно перед применением. Могут быть использованы готовые (имеющиеся в продаже) диски и карандаши. В этом случае следуют рекомендациям изготовителя.
9.6.4.2 Методика
Увлажняют кусок фильтрованной бумаги реактивом. Отбирают пробу бактериальной культуры с агаровой среды с помощью платиновой иглы, стеклянной или пластиковой палочки (никель-хромовая игла дает ошибочные положительные результаты). Пробу помещают на увлажненную фильтрованную бумагу.
9.6.4.3 Оценка результатов
В случае присутствия оксидазы через 5-10 с появляется окрашивание от фиолетового до пурпурного цвета. Если после 10 с цвет не изменился, проба на оксидазу считается отрицательной.
9.6.5 Использование биохимических наборов для идентификации
Для идентификации могут быть использованы изготовляемые в настоящее время биохимические наборы. Однако не все готовые формы наборов обладают равной степенью достоверности. Поэтому их характеристики должны быть проверены перед использованием, в особенности, если они не сертифицированы независимой организацией.
ПРИЛОЖЕНИЕ А
(обязательное)
Пределы доверительных интервалов для подсчитанных количеств колоний
Таблица А.1 - Подсчет на одной чашке Петри
Количество микроорганизмов* | Доверительный интервал при уровне вероятности 95% | Уровни относительной ошибки определения, %** | ||
нижний | верхний | нижний | верхний | |
1 | <1 | 6 | -97 | +457 |
2 | <1 | 7 | -88 | +261 |
3 | <1 | 8 | -79 | +192 |
4 | 1 | 10 | -73 | +156 |
5 | 2 | 12 | -68 | +133 |
6 | 2 | 13 | -63 | +118 |
7 | 3 | 14 | -60 | +106 |
8 | 3 | 16 | -57 | +97 |
9 | 4 | 17 | -54 | +90 |
10 | 5 | 18 | -52 | +84 |
11 | 6 | 20 | -50 | +79 |
12 | 6 | 21 | -48 | +75 |
13 | 7 | 22 | -47 | +71 |
14 | 8 | 24 | -45 | +68 |
15 | 8 | 25 | -44 | +65 |
* Равно количеству колоний. ** По отношению к количеству микроорганизмов. | ||||
Таблица А.2 - Подсчет на двух чашках Петри
Количество колоний* | Количество микроорганизмов | Доверительный интервал при уровне вероятности 95% | Уровни относительной ошибки определения, %** | ||
нижний | верхний | нижний | верхний | ||
1 | 1 | <1 | 3 | -97 | +457 |
2 | 1 | <1 | 4 | -88 | +261 |
3 | 2 | <1 | 4 | -79 | +192 |
4 | 2 | 1 | 5 | -73 | +156 |
5 | 2 | 1 | 6 | -68 | +133 |
6 | 3 | 1 | 6 | -63 | +118 |
7 | 4 | 2 | 7 | -60 | +106 |
8 | 4 | 2 | 8 | -57 | +97 |
9 | 4 | 2 | 9 | -54 | +90 |
10 | 5 | 2 | 9 | -52 | +84 |
11 | 6 | 6 | 10 | -50 | +79 |
12 | 6 | 6 | 10 | -48 | +75 |
13 | 6 | 7 | 11 | -47 | +71 |
14 | 7 | 8 | 12 | -45 | +68 |
15 | 8 | 4 | 12 | -44 | +65 |
16 | 8 | 5 | 13 | -43 | +62 |
17 | 8 | 5 | 14 | -42 | +60 |
18 | 9 | 5 | 14 | -41 | +58 |
19 | 10 | 6 | 15 | -40 | +56 |
20 | 10 | 6 | 15 | -39 | +54 |
21 | 10 | 6 | 16 | -38 | +53 |
22 | 11 | 7 | 17 | -37 | +51 |
23 | 12 | 7 | 17 | -36 | +50 |
24 | 12 | 8 | 18 | -36 | +49 |
25 | 12 | 8 | 18 | -35 | +48 |
26 | 13 | 8 | 19 | -35 | +47 |
27 | 14 | 9 | 20 | -34 | +46 |
28 | 14 | 9 | 20 | -34 | +45 |
29 | 14 | 9 | 21 | -33 | +44 |
30 | 15 | 10 | 21 | -32 | +43 |
* Подсчитанных на двух чашках Петри. ** По отношению к количеству микроорганизмов | |||||
ПРИЛОЖЕНИЕ Б
(обязательное)
Таблицы НВЧ
Таблица Б.1 - Таблица для расчета наиболее вероятного числа микроорганизмов
Число положительных пробирок трех выбранных разведений | НВЧ | Категория оценки для одновременно проанализированных проб в количестве | Действительное число микроорганизмов в 1 г (см | |||||||||
95% | 99% | |||||||||||
1,0 | 0,1 | 0,01 | 1 | 2 | 3 | 5 | 10 | от | до | от | до | |
0 | 0 | 0 | <0,30 | 0,00 | 0,94 | 0,00 | 1,40 | |||||
0 | 0 | 1 | 0,30 | 3 | 2 | 2 | 2 | 1 | 0,01 | 0,95 | 0,00 | 1,40 |
0 | 1 | 0 | 0,30 | 2 | 1 | 1 | 1 | 1 | 0,01 | 1,00 | 00 | 1,60 |
0 | 1 | 1 | 0,61 | 0 | 3 | 3 | 3 | 3 | 0,12 | 1,7 | 0,05 | 2,50 |
0 | 2 | 0 | 0,62 | 3 | 2 | 2 | 2 | 1 | 0,12 | 1,70 | 0,05 | 2,50 |
0 | 3 | 0 | 0,94 | 0 | 0 | 0 | 0 | 3 | 0,35 | 3,3 | 0,18 | 4,60 |
1 | 0 | 0 | 0,36 | 1 | 1 | 1 | 1 | 1 | 0,02 | 1,70 | 0,05 | 2,50 |
1 | 0 | 1 | 0,72 | 2 | 2 | 1 | 1 | 1 | 0,12 | 1,70 | 0,05 | 2,50 |
1 | 0 | 2 | 1,1 | 0 | 0 | 0 | 3 | 3 | 0,4 | 3,5 | 0,2 | 4,6 |
1 | 1 | 0 | 0,74 | 1 | 1 | 1 | 1 | 1 | 0,13 | 2,00 | 0,06 | 2,70 |
1 | 1 | 1 | 1,1 | 3 | 3 | 2 | 2 | 2 | 0,4 | 3,5 | 0,2 | 4,6 |
1 | 2 | 0 | 1,1 | 2 | 2 | 1 | 1 | 1 | 0,4 | 3,5 | 0,2 | 4,6 |
1 | 2 | 1 | 1,5 | 3 | 3 | 3 | 3 | 2 | 0,5 | 3,8 | 0,2 | 5,2 |
1 | 3 | 0 | 1,6 | 3 | 3 | 3 | 3 | 2 | 0,5 | 3,8 | 0,2 | 5,2 |
2 | 0 | 0 | 0,92 | 1 | 1 | 1 | 1 | 1 | 0,15 | 3,50 | 0,07 | 4,60 |
2 | 0 | 1 | 1,4 | 2 | 1 | 1 | 1 | 1 | 0,4 | 3,5 | 0,2 | 4,6 |
2 | 0 | 2 | 2,0 | 0 | 3 | 3 | 3 | 3 | 0,5 | 3,8 | 0,2 | 5,2 |
2 | 1 | 0 | 1,5 | 1 | 1 | 1 | 1 | 1 | 0,4 | 3,8 | 0,2 | 5,2 |
2 | 1 | 1 | 2,0 | 2 | 2 | 1 | 1 | 1 | 0,5 | 3,8 | 0,2 | 5,2 |
2 | 1 | 1 | 2,0 | 2 | 2 | 1 | 1 | 1 | 0,5 | 3,8 | 0,2 | 5,2 |
2 | 1 | 2 | 2,7 | 0 | 3 | 3 | 3 | 3 | 0,9 | 9,4 | 0,5 | 14,2 |
2 | 2 | 0 | 2,1 | 1 | 1 | 1 | 1 | 1 | 0,5 | 4,0 | 0,2 | 5,6 |
2 | 2 | 1 | 2,8 | 3 | 2 | 2 | 2 | 1 | 0,9 | 9,4 | 0,5 | 14,2 |
2 | 2 | 2 | 3,5 | 0 | 0 | 0 | 0 | 3 | 0,9 | 9,4 | 0,5 | 14,2 |
2 | 3 | 0 | 2,9 | 3 | 2 | 2 | 2 | 1 | 0,9 | 9,4 | 0,5 | 14,2 |
2 | 3 | 1 | 3,6 | 0 | 3 | 3 | 3 | 3 | 0,9 | 9,4 | 0,5 | 14,2 |
3 | 0 | 0 | 2,3 | 1 | 1 | 1 | 1 | 1 | 0,5 | 9,4 | 0,3 | 14,2 |
3 | 0 | 1 | 3,8 | 1 | 1 | 1 | 1 | 1 | 0,9 | 10,4 | 0,5 | 15,7 |
3 | 0 | 2 | 6,4 | 3 | 3 | 2 | 2 | 2 | 1,6 | 18,1 | 1,0 | 25,0 |
3 | 1 | 0 | 4,3 | 1 | 1 | 1 | 1 | 1 | 0,9 | 18,1 | 0,5 | 25,0 |
3 | 1 | 1 | 7,5 | 1 | 1 | 1 | 1 | 1 | 1,7 | 19,9 | 1,1 | 27,0 |
3 | 1 | 2 | 12 | 3 | 2 | 2 | 2 | 1 | 3 | 36 | 2 | 44 |
3 | 1 | 3 | 16 | 0 | 0 | 0 | 3 | 3 | 3 | 38 | 2 | 52 |
3 | 2 | 0 | 9,3 | 1 | 1 | 1 | 1 | 1 | 1,8 | 36,0 | 1,2 | 43,0 |
3 | 2 | 1 | 15 | 1 | 1 | 1 | 1 | 1 | 3 | 38 | 2 | 52 |
3 | 2 | 2 | 21 | 2 | 1 | 1 | 1 | 1 | 3 | 40 | 2 | 56 |
3 | 2 | 3 | 29 | 3 | 3 | 3 | 2 | 2 | 9 | 99 | 5 | 152 |
3 | 3 | 0 | 24 | 1 | 1 | 1 | 1 | 1 | 4 | 99 | 5 | 152 |
3 | 3 | 1 | 46 | 1 | 1 | 1 | 1 | 1 | 9 | 198 | 5 | 283 |
3 | 3 | 2 | 110 | 1 | 1 | 1 | 1 | 1 | 20 | 400 | 10 | 570 |
3 | 3 | 3 | <110 | |||||||||
Примечание - Доверительные пределы, представленные в таблице Б.1, предназначены только для того, чтобы дать некоторые представления о влиянии на результаты статистических отклонений. Обычно имеют место и другие источники, которые иногда могут быть значительными. | ||||||||||||
Таблица Б.2 - Классификация результатов
Категория | Определение |
1 | Найденное НВЧ соответствует количеству микроорганизмов в продукте с наибольшей вероятностью (наиболее часто встречаемые комбинации положительных пробирок). Шанс получения результата менее вероятного, чем наименее вероятный из результатов данной категории, составляет менее 5% |
2 | Найденное НВЧ соответствует количеству микроорганизмов в продукте с меньшей вероятностью, чем даже в случае наименее вероятного из результатов категории 1 (менее вероятные по сравнением с категорией 1 комбинации пробирок, встречаемые в 4% случаев). Однако шанс получения результата менее вероятного, чем наименее вероятный из результатов данной категории, составляет менее 1% |
3 | Найденное НВЧ соответствует количеству микроорганизмов в продукте с меньшей вероятностью, чем даже в случае наименее вероятного из результатов категории 2. Однако шанс получения результата менее вероятного, чем наименее вероятный из результатов данной категории, составляет менее 0,1% |
0 | Найденное НВЧ соответствует количеству микроорганизмов в продукте с меньшей вероятностью, чем даже в случае наименее вероятного из результатов категории 3. В данной категории шанс получения безошибочного результата составляет менее 0,1% |
До начала испытания необходимо принять решение о приемлемости той или иной категории, например 1; 1 и 2, или даже 1, 2 и 3 согласно таблицам Б.1. и Б.2. Если на основе результатов принимается достаточно важное решение, следует признавать только результаты категории 1 или, самое большее, категорий 1 и 2. Результаты категории 0 следует принимать с большой осторожностью.
ПРИЛОЖЕНИЕ В
(справочное)
Библиография
[1] СП 1.2.731-99 Санитарные правила. Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами
Текст документа сверен по:
М.: ИПК Издательство стандартов, 2000

