ГОСТ Р 55027-2012/ISO/TS 10272-3:2010
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Горизонтальный метод обнаружения и подсчета бактерий Campylobacter spp.
Часть 3
Полуколичественный метод
Microbiology of food and animal feeding stuffs. Horizontal method for detection and enumeration of Campylobacter spp. Part 3. Semi-quantitative method
ОКС 07.100.30
Дата введения - 2014-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004* "Стандартизация в Российской Федерации. Основные положения"
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 1.0-2012. - .
Сведения о стандарте
1 ПОДГОТОВЛЕН ОАО "Всероссийский научно-исследовательский институт сертификации" (ОАО "ВНИИС") на основе аутентичного перевода на русский язык международного документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 24 октября 2012 г. N 555-ст
4 Настоящий стандарт является идентичным международному документу ИСО/ТУ 10272-3:2010* "Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения и подсчета бактерий Campylobacter spp. Часть 3. Полуколичественный метод" (ISO/TS 10272-3:2010 "Microbiology of food and animal feeding stuffs - Horizontal method for detection and enumeration of Campylobacter spp. - Part 3: Semi-quantitative method") с учетом технической поправки ISO/TS 10272-3:2010/Cor. 1:2011.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Техническая поправка выделена в тексте (таблица 3) вертикальной чертой*.
______________
* В бумажном оригинале вертикальная черта в таблице 3 отсутствует. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов и документов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемом информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт устанавливает метод полуколичественного определения Campylobacter spp.
Настоящий стандарт распространяется:
- на пищевую продукцию и корма для животных;
- на пробы окружающей среды в области производства и обращения пищевой продукции.
Настоящий стандарт не применяют при контроле некоторых видов пищевой продукции и кормов.
2 Нормативные ссылки
Следующие ссылочные нормативные документы* являются обязательными при применении данного стандарта. Для датированных ссылок применяется только указанное издание. Для недатированных ссылок применяется последнее издание стандарта (включая любые изменения).
____________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 6887 (все части) Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований (ISO 6887 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination (all part))
ИСО 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям (ISO 7218 Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations)
ИСО/ТУ 11133-1 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству питательных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления питательных сред в лаборатории (ISO/TS 11133-1 Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory)
ИСО/ТУ 11133-2:2003 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству питательных сред. Часть 2. Практические руководящие указания по определению эффективности питательных сред (ISO/TS 11133-2:2003 Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 2: Practical guidelines on performance testing of culture media)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
3.1 Campylobacter (Campylobacter) (Микробиология Campylobacter пищевых продуктов и кормов для животных): Род микроорганизмов, образующих характерные колонии на твердых селективных средах, когда их инкубируют микроаэробным способом при температуре 41,5 °С, но не при 25 °С, и которые обладают характерной подвижностью, биохимическими свойствами и способностью к росту, описанными в тех случаях, когда испытания проводятся в соответствии с настоящим стандартом.
Примечание - Наиболее часто встречающимися видами являются Campylobacter jejuni и С. coli. Вместе с тем были описаны и другие виды (С. lari, С. upsaliensis и некоторые другие).
3.2 полуколичественное определение (semi-quantitative determination) (Микробиология Campylobacter пищевых продуктов и кормов для животных): Определение уровня загрязнения Campylobacter в том случае, когда ожидается небольшое количество или если уровень сопутствующей флоры относительно высок.
4 Принцип
4.1 Общие положения
Для полуколичественного определения Campylobacter spp. необходимо выполнение операций, описанных в 4.2-4.4 (см.рисунок А.1).
4.2 Обогащение в селективной жидкой среде
Пробу для анализа и ее десятичные разбавления инокулируют или разбавляют в жидкой обогатительной среде (бульон Болтона) и гомогенизируют.
Обогатительную среду инкубируют при 37 °С в течение 4-6 ч и затем при 41,5 °С в течение (44±4)ч.
4.3 Изоляция и отбор для подтверждения
Из культур, полученных по 4.2, твердую селективную среду, основанную на модифицированном агаре с углем, цефоперазоном и дезоксихолатом (mCCD агар), инокулируют, инкубируют при 41,5 °С в микроаэробной атмосфере и проверяют после (44±4) ч с целью обнаружения присутствия колоний, которые по своим характеристикам предположительно являются Campylobacter spp.
4.4 Подтверждение
Колонии, предположительно являющиеся Campylobacter spp., пересевают на неселективный колумбийский кровяной агар и затем подтверждают при помощи исследования под микроскопом и надлежащих биохимических испытаний, и испытаний на рост. Дополнительно вид Campylobacter spp. идентифицируют путем специфических биохимических испытаний и испытаний на чувствительность к антибиотикам.
5 Питательные среды и реактивы
5.1 Общие положения
Для получения информации об общепринятой лабораторной практике см. ИСО 7218, ИСО/ТУ 11133-1 и ИСО/ТУ 11133-2.
Примечание - Ввиду наличия большого количества питательных сред и реактивов и для ясности изложения, их составы и процедуры приготовления приведены в приложении В.
5.2 Жидкая обогатительная среда: бульон Болтона
См. В.1.
5.3 Селективная среда для чашек Петри: модифицированный агар с углем, цефоперазоном и дезоксихолатом (mCCD агар)
См. В.2.
5.4 Среды и реактивы для подтверждения и идентификации
5.4.1 Колумбийский кровяной агар
См. В.З.
5.4.2 Бульон для бруцелл
См. В.4.
5.4.3 Реактив для обнаружения оксидазы
См. В.5.
5.4.4 Раствор пероксида водорода, 3% (объемная доля)
5.4.5 Реактивы для определения гидролиза гиппурата
См. В.6.
5.4.6 Кровяной агар Мюллера-Хинтона
См. В.7.
5.4.7 Диски с налидиксовой кислотой и цефалотином
Каждый тип диска содержит по 30 мкг реактива.
5.4.8 Диски с индоксилацетатом
См. В.8.
6 Аппаратура
Используют обычную микробиологическую лабораторную аппаратуру (см. ИСО 7218) и, в частности, нижеприведенную.
6.1 Оборудование для сухой стерилизации (сушильный шкаф) или влажной стерилизации (автоклав).
См. ИС0 7218.
6.2 Сушильный шкаф, ламинарный бокс или термостат, способные функционировать в диапазоне температур от 37 °С до 55 °С.
6.3 Термостат, работающий при температуре (25±1) °С, (37±1) °С и (41,5±1) °С.
6.4 Баня водяная, работающая при температуре (37±1) °С.
6.5 Баня водяная, работающая в диапазоне температур от 47 °С до 50 °С.
6.6 рН-метр, с точностью до 0,1 ед. рН при температуре 25 °С.
6.7 Емкости, в частности, культуральные пробирки с размерами 18 мм180 мм и 9 мм
180 мм, пробирки для гемолиза с размерами 13 мм
75 мм, бутылки с нетоксичными металлическими крышками и/или колбы подходящей вместимости с соответствующими крышками.
6.8 Чашки Петри, стеклянные или пластиковые, с диаметром 90 мм - 100 мм.
6.9 Пипетки градуированные, поставляющие полный объем, с широким отверстием, номинальной вместимостью 1 см и 10 см
, градуированные с ценой деления 0,1 см
, ИСО 835 класс А [1], и пастеровские пипетки, ИСО 7712 [2].
6.10 Соски резиновые, или любая другая безопасная система, которую можно адаптировать к градуированным пипеткам.
6.11 Петли стерильные, из платиново-иридиевого или никелево-хромового сплава либо пластиковые, с диаметром приблизительно 3 мм, и проволоки из того же материала или стеклянная, или пластиковая палочка.
Петля из никелево-хромового сплава не пригодна для использования в испытании на оксидазу (см.9.5.6).
6.12 Пинцет, тонкий, с закругленными краями, из нержавеющей стали.
6.13 Микроскоп предпочтительно с фазовым контрастом (для наблюдения характерной подвижности Campylobacter spp.).
6.14 Оборудование, пригодное для достижения микроаэробной атмосферы с объемными долями: кислорода (5±2)%, диоксида углерода (10±3)%, альтернативного водорода 10%, с соблюдением баланса азота. Используют надлежащие герметичные контейнеры, чтобы удерживать чашки Петри и/или колбы, или бутылки вместимостью примерно 350 см
, используемые для обогатительного бульона, например, бактериологические анаэробные сосуды.
Примечание 1 - Соответствующая микроаэробная атмосфера может быть получена при использовании имеющихся в продаже газогенераторных комплектов; следует в точности соблюдать инструкции изготовителя, особенно те из них, которые касаются объема сосуда и вместимости газогенераторного комплекта. В качестве альтернативы можно использовать заполнение сосуда надлежащей газовой смесью перед инкубацией.
Примечание 2 - В качестве альтернативы инкубации в микроаэробной атмосфере, обогатительный бульон можно инкубировать в бутылках с винтовыми крышками, колбах или пробирках, заполнив их обогатительным бульоном, оставляя свободное пространство величиной менее 20 мм и тщательно закупоривая крышками.
7 Отбор проб
В лабораторию должна поступать репрезентативная проба. Она не должна подвергаться повреждению или изменению в период транспортирования или хранения.
Отбор проб не является частью метода, установленного в настоящем стандарте. Рекомендуется конкретный стандарт, распространяющийся на данную продукцию. Если не существует конкретного стандарта, рекомендуется, чтобы заинтересованные стороны достигли согласия поданному вопросу.
Принимая во внимание, что Campylobacter spp. весьма чувствительны к замораживанию, но наиболее устойчивы при низких температурах, рекомендуется, чтобы пробы хранились при температуре (3±2) °С и анализировались в кратчайшие сроки. Также принимают меры по предотвращению высыхания проб.
8 Приготовление испытуемой пробы
Испытуемую пробу приготовляют в соответствии с соответствующей частью ISO 6887, распространяющейся на определенный вид продукции. Если не существует соответствующей части ISO 6887, рекомендуется, чтобы заинтересованные стороны достигли согласия поданному вопросу.
9 Методика
9.1 Общие положения
См. рисунок А.1.
9.2 Проба для анализа, исходная суспензия и разбавления
9.2.1 Вводят пробу для анализа в количестве г или
см
(минимум 15 г или 15 см
) из испытуемой пробы (раздел 8) в восьмикратный объем (120 см
минимум) обогатительной среды - бульон Болтона (5.2) и гомогенизируют.
Полученная суспензия является исходной суспензией.
9.2.2 Переносят 90 см исходной суспензии (9.2.1) в бутылку вместимостью 100 см
. Это соответствует 10 г пробы для анализа. При подсчете результатов это разбавление соответствует 10
.
9.2.3 Переносят 10 см исходной суспензии (9.2.1) в культуральную пробирку. При подсчете результатов это разбавление соответствует 10
. После следующей стадии разбавления (9.2.4) остается 9 см
этого разбавления. Это соответствует 1 г пробы для анализа.
9.2.4 Делают обычную серию 10-кратных разбавлений (например, до ) из 10
разбавления (9.2.3), перенося по 1,0 см
в пробирки, содержащие 9,0 см
бульона Болтона. Из наибольшего разбавления отбрасывается 1,0 см
, поскольку все пробирки должны содержать по 9,0 см
. При подсчете результатов эти разбавления соответствуют
,
и т.д.
9.3 Обогащение
Инкубируют пробы для анализа и разбавления (9.2.2, 9.2.3 и 9.2.4) в микроаэробной атмосфере (6.14) при 37 °С от 4 ч до 6 ч, затем при 41,5 °С в течение (44±4) ч.
9.4 Изоляция
9.4.1 Используя каждую из культур, полученных в обогатительной среде (9.3), инокулируют стерильной петлей (6.11) поверхность слоев с селективной изолирующей средой на основе mCCD агара (5.3).
9.4.2 Инкубируют слои (9.4.1) при 41,5 °С в микроаэробной атмосфере (6.14).
9.4.3 После инкубации в течение (44±4) ч исследуют слои с целью выявления типичных и/или подозрительных колоний Campylobacter spp.
Типичные колонии на mCCD агаре имеют сероватый цвет, часто с металлическим блеском, они плоские и влажные и имеют тенденцию к разрастанию. Разрастание колоний выражено меньше на более сухих поверхностях агара. Могут встречаться и другие формы колоний.
9.5 Подтверждение вида Campylobacter spp.
9.5.1 Общие положения
Поскольку рассматриваемые бактерии быстро разрушаются на воздухе, необходимо незамедлительно следовать процедурам, описанным в 9.5.2-9.5.6.
9.5.2 Отбор колонии для подтверждения
9.5.2.1 Для подтверждения с каждого слоя (9.4.3) отбирают по меньшей мере одну колонию, рассматриваемую в качестве типичной или подозрительной колонии Campylobacter spp., исследуют морфологию и подвижность с помощью микроскопа (9.5.3.1) и продолжают тем же способом с еще четырьмя колониями, если первая дала отрицательный результат.
9.5.2.2 Производят посев каждой из отобранных колоний на слой колумбийского кровяного агара (5.4.1), чтобы дать развиться четко изолированным колониям. Слои инкубируют в микроаэробной атмосфере при 41,5 °С в течение 24 ч - 48 ч. При исследовании морфологии, подвижности, микроаэробного роста при 25 °С, аэробного роста при 41,5 °С и присутствия оксидазы используют чистые культуры.
9.5.3 Исследование морфологии и подвижности
9.5.3.1 Суспендируют одну колонию со слоя колумбийского кровяного агара (9.5.2.2) в 1 см бульона для бруцелл (5.4.2) или солевого раствора пептона и исследуют морфологию и подвижность при помощи микроскопа (6.13).
9.5.3.2 Для дальнейшего исследования сохраняют все культуры (9.5.2.2), в которых обнаружены изогнутые бациллы со спиральной "штопорообразной" подвижностью (9.5.3.1).
9.5.4 Исследование роста при температуре 25 °С (микроаэробного)
Используя колонии, изолированные в 9.5.2.2, инокулируют при помощи петли (6.11) поверхность слоя колумбийского кровяного агара (5.4.1)).
Инкубируют слой при 25 °С в микроаэробной атмосфере (6.14) в течение (44±4) ч.
Исследуют слой с целью выявления видимого роста колоний Campylobacter spp.
9.5.5 Исследование роста при температуре 41,5 °С (аэробного)
Используя колонии, изолированные в 9.5.2.2, инокулируют при помощи петли (6.11) поверхность слоя колумбийского кровяного агара (5.4.1).
Инкубируют слой при температуре 41,5 °С в аэробной атмосфере в течение (44±4) ч.
Исследуют слой с целью выявления видимого роста колоний Campylobacter spp.
9.5.6 Обнаружение оксидазы
Используя петлю из платиново-иридиевого сплава, пластиковую петлю или стеклянную палочку (6.11), отбирают порцию четко изолированной колонии из каждой отдельной чашки (9.5.2.2) и наносят на фильтровальную бумагу, смоченную реактивом для обнаружения оксидазы (5.4.3). Появление розовато-лилового, фиолетового или темно-синего цвета в течение 10 с свидетельствует о положительной реакции. Если используется имеющийся в продаже набор для анализа оксидазы, необходимо следовать инструкциям изготовителя.
Подтверждают результаты, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются Pseudomonas aeruginosa NCTC 10662 (положительный контроль) и Escherichia coli NCTC 9001 (отрицательный контроль).
9.5.7 Интерпретация
Campylobacter spp. дает результаты согласно таблице 1.
Таблица 1 - Характеристики Campylobacter spp.
Морфология (9.5.3) | Малые искривленные бациллы |
Подвижность (9.5.3) | Характерная |
Микроаэробный рост при температуре 25 °С (9.5.4) | - |
Аэробный рост при температуре 41,5 °С (9.5.5) | - |
Оксидаза (9.5.6) | + |
Campylobacter spp. присутствует, если по меньшей мере одна колония демонстрирует вышеуказанные характеристики.
9.6 Идентификация вида Campylobacter spp. (альтернативная процедура)
9.6.1 Общие положения
Из видов Campylobacter spp., произрастающих при температуре 41,5 °С, чаще всего встречаются С. jejuni и С. coli. Вместе с тем были описаны другие виды (С. lari, С. upsaliensis и некоторые другие); характеристики, приведенные в таблице 2, позволяют провести их дифференциацию.
Таблица 2 - Характеристики видов Campylobacter spp.
Характеристика | С. jejuni | С. coli | С. lari | С. upsaliensis |
Каталаза (9.6.2) | + | + | + | отрицательная или в слабой форме |
Налидиксовая кислота (9.6.3) | ||||
Цефалотин (9.6.3) | ||||
Гидролиз гиппурата (9.6.4) | + | - | - | - |
Индоксилацетат (9.6.5) | + | + | - | + |
| ||||
| ||||
9.6.2 Обнаружение каталазы
Для каждой колонии, отобранной в соответствии с 9.5.2.2, наносят петлю культуры в каплю раствора пероксида водорода (5.4.4) на чистом предметном стекле.
Испытание считается положительным, если в течение 30 с появляются пузырьки.
Подтверждают результаты, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются Staphylococcus aureus NCTC 8532 (положительный контроль) и Enterococcus faecalis NCTC 775 (отрицательный контроль).
9.6.3 Определение чувствительности к налидиксовой кислоте и цефалотину
Для каждой колонии, отобранной в соответствии с 9.5.2.2, используют петлю (6.11) с целью приготовления суспензии в бульоне для бруцелл (5.4.2) плотностью 0,5 по шкале Мак Фарланда.
Разбавляют суспензию в соотношении 1:10 тем же бульоном.
Заливают суспензией поверхность слоя с 5% (объемная доля) кровяного агара Мюллера-Хинтона (5.4.6).
Выдерживают в течение 5 мин, затем сливают избыток суспензии.
Высушивают чашки в сушильном шкафу (6.2) при температуре 37 °С в течение 10 мин.
Помещают на поверхность агара диск с налидиксовой кислотой (5.4.7) и диск с цефалотином (5.4.7).
Инкубируют чашки крышками вверх при температуре 37 °С в течение (22±2) ч в микроаэробной атмосфере (6.14).
Интерпретируют результаты бактериального роста следующим образом:
- рост, который наблюдается при контакте с диском, классифицируется как устойчивый;
- при наличии зоны любых размеров, обусловленной ингибированием роста, он классифицируется как чувствительный.
9.6.4 Определение гидролиза гиппурата
Для каждой колонии, отобранной в соответствии с 9.5.2.2, используют петлю (6.11) с большим количеством инокулята с целью приготовления суспензии в пробирке для гемолиза (6.7), содержащей 0,4 см раствора гиппурата натрия (5.4.5), при этом обращают особое внимание, чтобы исключить попадание агара.
Встряхивают с целью тщательного перемешивания и инкубируют в течение 2 ч на водяной бане (6.4) при температуре 37 °С или в течение 4 ч в термостате при 37 °С.
Осторожно добавляют 0,2 см раствора нингидрина (5.4.5) на поверхность раствора гиппурата натрия. Избегают встряхивания.
Интерпретацию производят после дополнительного инкубирования в течение 10 мин на водяной бане (6.4) при 37 °С или в термостате при 37 °С.
Темно-фиолетовый цвет свидетельствует о положительной реакции.
Светло-фиолетовый цвет или отсутствие окраски свидетельствуют об отрицательной реакции.
Подтверждают результаты, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются С. jejuni NCTC 11351 (положительный контроль), С. coli NCTC 11366 (отрицательный контроль).
9.6.5 Определение гидролиза индоксилацетата
Помещают колонию, отобранную в соответствии с 9.5.2.2, на диск с индоксилацетатом (5.4.8) и добавляют каплю стерилизованной дистиллированной воды. Для проведения отчетливой реакции требуется полная петля материала колоний.
В случае гидролиза индоксилацетата в течение 5-10 мин наблюдается изменение цвета в сторону темно-синего. Отсутствие изменения цвета свидетельствует о том, что гидролиза не было.
Подтверждают результаты, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются С. jejuni NCTC 11351 (положительный контроль), С. lari NCTC 11352 (отрицательный контроль).
9.6.6 Интерпретация
Виды Campylobacter spp., показывающие рост при 41,5 °С, могут быть идентифицированы в соответствии с таблицей 2.
10 Расчет и выражение результатов
10.1 Метод расчета
Полуколичественный метод основан на количественном обнаружении в отобранных разведениях. Поэтому результат приводится в диапазонах, соответствующих таблице 3.
Таблица 3 - Диапазоны результатов для серии разбавлений
Количество, г | Рост подтвержденных Campylobacter spp. | ||||||
10 | - | + | + | + | + | + | + |
10 | - | - | + | + | + | + | + |
10 | - | - | - | + | + | + | + |
10 | - | - | - | - | + | + | + |
10 | - | - | - | - | - | + | + |
10 | - | - | - | - | - | - | + |
НВЧ/г | 0 | 0,23 | 2,3 | 23 | 230 | 2400 | |
0 | 0,019 | 0,19 | 1,9 | 19 | 190 | 580 | |
0,33 | 2,7 | 27 | 270 | 2700 | 30000 | ||
Если все испытания дали отрицательный результат, этот результат необходимо изложить как НВЧ = 0/г (верхний доверительный предел, | |||||||
Пуассоновское распределение используется для оценки диапазона концентраций, которые согласуются с серией результатов. Например, если истинная концентрация 0,005 КОЕ/г, то вероятность положительного результата для 10 разведения составляет 5%. Если истинная концентрация 3 КОЕ/г, то вероятность положительного результата для 10
разведения составляет 95%. Однако если для 10
разведения наблюдается положительный результат, а для 10
разведения и более высоких разведений - отрицательный результат, то истинная концентрация, вероятно, находится в диапазоне между 0,005 КОЕ/г и 3 КОЕ/г.
10.2 Прецизионность
Межлабораторное совместное испытание, включающее полуколичественное определение Campylobacter spp., как описано в настоящем стандарте, было организовано в 2005 году Нордическим комитетом по анализу пищевых продуктов (NMKL). Испытание проводилось в 14 европейских лабораториях на сыром курином мясе и молоке. Каждая из проб пищевых продуктов была проанализирована при различных уровнях загрязнения плюс отрицательный контроль. Специфичность полуколичественного метода составляла 100%. Общая чувствительность метода была 82,1%. Чувствительность обнаружения Campylobacter spp. в молоке была ниже, чем в курином мясе. Количественная оценка метода для Campylobacter spp. в курином мясе, полученная в этом совместном испытании, была совместима с диапазонами концентраций, приведенными в таблице 3.
11 Протокол испытания
Протокол испытания должен содержать по меньшей мере следующую информацию:
a) используемый метод отбора проб, если он известен;
b) используемый метод со ссылкой на настоящий стандарт;
c) используемая жидкая обогатительная среда;
d) используемая среда для изоляции;
e) выбранная температура инкубации;
f) полученные результаты испытаний;
g) все детали проведения испытаний, не установленные в настоящем стандарте или рассматриваемые в качестве альтернативных, вместе с информацией о любых факторах, которые могли повлиять на результаты испытаний;
h) всю информацию, необходимую для полной идентификации пробы.
Приложение А
(обязательное)
Диаграмма методики
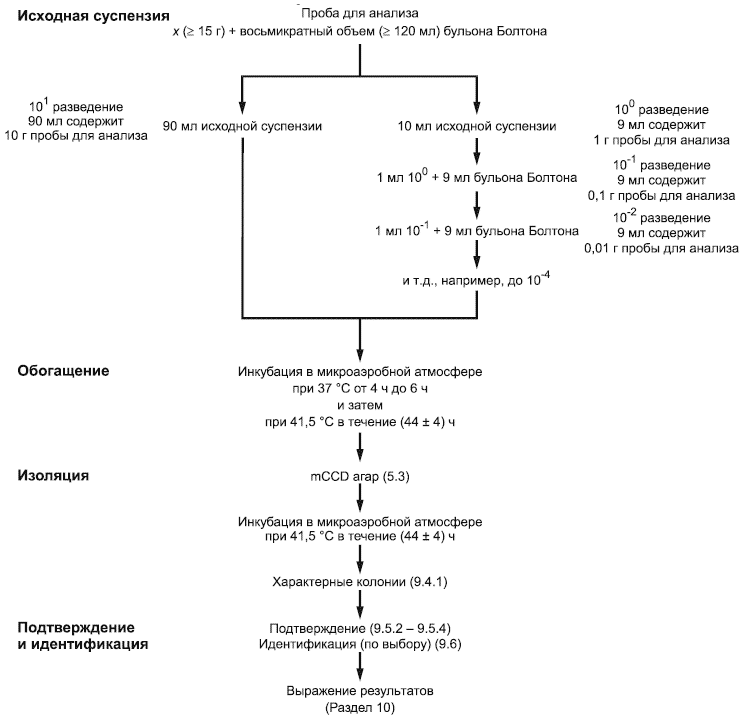
Рисунок А.1 - Диаграмма методики
Приложение В
(обязательное)
Состав и приготовление питательных сред и реактивов
В.1 Бульон Болтона
В.1.1 Базовая среда
В.1.1.1 Состав
Продукт ферментативного переваривания животных тканей | 10,0 г |
Гидролизат лактальбумина | 5,0 г |
Дрожжевой экстракт | 5,0 г |
Натрия хлорид | 5,0 г |
Натрия пируват | 0,5 г |
Натрия пиросульфит | 0,5 г |
Натрия карбонат | 0,6 г |
| 1,0 г |
Гемин [растворенный в 0,1% (массовая доля) гидроксиде натрия] | 0,01 г |
Вода | 1000 см |
В.1.1.2 Приготовление
Растворяют базовые компоненты или полную обезвоженную базовую среду в воде, при необходимости - путем нагрева. При необходимости корректируют рН, чтобы после стерилизации его значение для полной среды составляло 7,4±0,2 ед. рН при температуре 25 °С. Разливают базовую среду в колбы подходящей вместимости. Стерилизуют в автоклаве (6.1), установленном на температуру 121 °С, в течение 15 мин.
В.1.2 Стерильная лизированная дефибринированная кровь лошади
Используют кровь лошади, лизированную сапонином или замораживанием и последующим размораживанием.
В.1.3 Состав антибиотического раствора
Цефоперазон | 0,02 г |
Ванкомицин | 0,02 г |
Триметоприма лактат | 0,02 г |
Амфотерицин В | 0,01 г |
Смесь этанола и воды: 1+1 частей по объему | 5 см |
В.1.4 Приготовление
Растворяют компоненты в смеси этанола и воды (соотношение 1:1).
В.1.5 Полная среда
В.1.5.1 Состав
Базовая среда (В.1.1) | 1000 см |
Стерильная лизированная дефибринированная кровь лошади (В.1.2) | 50 см |
Антибиотический раствор (В.1.3) | 5 см |
В.1.5.2 Приготовление
К базовой среде при температуре ниже 50 °С в стерильных условиях добавляют кровь, затем антибиотический раствор и перемешивают. Соблюдая стерильность, разливают среду в пробирки или колбы подходящей вместимости (см. 9.2.2), чтобы приготовить порции, необходимые для испытания. Если обогатительную среду приготовляют заранее, ее надо хранить не более 4 ч при комнатной температуре или не более 7 дней в темном месте при (3±2) °С.
В.1.6 Эксплуатационное испытание
Эксплуатационные характеристики бульона Болтона (В.1.5.1) необходимо испытывать в соответствии с методами и критериями, описанными в ИСО/ТУ 11133-2. Примерами подходящих контрольных штаммов являются C.jejuni NCTC 11351 или АТСС 33291 со следующими критериями: >10 колоний на mCCD агаре (5.3) после инкубации в микроаэробных условиях при 41,5 °С в течение (44±4) ч.
В.2 Модифицированный агар с углем, цефоперазоном и дезоксихолатом (mCCD агар)
В.2.1 Базовая среда
В.2.1.1 Состав
Мясной экстракт | 10,0 г |
Продукт ферментативного переваривания животных тканей | 10,0 г |
Натрия хлорид | 5,0 г |
Древесный уголь | 4,0 г |
Продукт ферментативного переваривания казеина | 3,0 г |
Дезоксихолат натрия | 1,0 г |
Железа (II) сульфат | 0,25 г |
Натрия пируват | 0,25 г |
Агар | 8,0 г - 18,0 г |
Вода | 1000 см |
| |
В.2.1.2 Приготовление
Растворяют базовые компоненты или полную обезвоженную базовую среду в воде путем доведения до кипения. При необходимости корректируют рН, чтобы после стерилизации его значение составляло 7,4±0,2 ед. рН при температуре 25 °С. Разливают базовую среду в колбы подходящей вместимости. Стерилизуют в автоклаве (6.1), установленном на 121 °С, в течение 15 мин.
В.2.2 Антибиотический раствор
В.2.2.1 Состав
Цефоперазон | 0,032 г |
Амфотерицин В | 0,01 г |
Вода | 5 см |
В.2.2.2 Приготовление
Растворяют компоненты в воде. Стерилизуют путем фильтрации.
В.2.3 Полная среда
В.2.3.1 Состав
Базовая среда (В.2.1) | 1000 см |
Антибиотический раствор (В.2.2) | 5 см |
В.2.3.2 Приготовление
Добавляют антибиотический раствор к базовой среде, охлажденной до 47 °С - 50 °С, затем тщательно перемешивают. Разливают около 15 см полной среды по стерильным чашкам Петри. Дают затвердеть. Непосредственно перед применением тщательно высушивают слои агара, предпочтительно с открытыми крышками и поверхностью агара, направленной вниз, в сушильном шкафу (6.2) в течение 30 мин или до того момента, когда поверхность агара не будет содержать видимой влаги. Если они были приготовлены заранее, невысушенные агаровые слои следует хранить не более 4 ч при температуре окружающей среды или не более 7 сут в темноте при температуре (3±2) °С.
В.2.4 Эксплуатационное испытание
Для определения селективности или производительности см. ИСО/ТУ 11133-1. В отношении эксплуатационных критериев см. ИСО/ТУ 11133-2:2003, таблица В.5.
В.3 Колумбийский кровяной агар
В.3.1 Базовая среда
В.3.1.1 Состав
Продукт ферментативного переваривания животных тканей | 23,0 г |
Крахмал | 1,0 г |
Натрия хлорид | 5,0 г |
Агар | 8,0 г - 18,0 г |
Вода | 1000 см |
а) В зависимости от прочности геля агара. | |
В.3.1.2 Приготовление
Растворяют базовые компоненты или полную обезвоженную базовую среду в воде путем нагрева. При необходимости корректируют рН, чтобы после стерилизации его значение составляло 7,3±0,2 ед. рН при температуре 25 °С. Разливают базовую среду в колбы подходящей вместимости. Стерилизуют в автоклаве (6.1), установленном на температуру 121 °С, в течение 15 мин.
В.3.2 Стерильная дефибринированная баранья кровь
В.3.3 Полная среда
В.3.3.1 Состав
Базовая среда (В.3.1) | 1000 см |
Стерильная дефибринированная баранья кровь (В.3.2) | 50 см |
В.3.3.2 Приготовление
Добавляют кровь в стерильных условиях к базовой среде, охлажденной до температуры 47 °С - 50 °С, затем перемешивают. Разливают около 15 см полной среды по стерильным чашкам Петри. Дают затвердеть. Непосредственно перед применением тщательно высушивают слои агара, предпочтительно с открытыми крышками и поверхностью агара, направленной вниз, в сушильном шкафу (6.2) в течение 30 мин или до того момента, когда поверхность агара не будет содержать видимой влаги. Если они были приготовлены заранее, невысушенные агаровые слои следует хранить не более 4 ч при температуре окружающей среды или не более 7 сут при температуре (3±2) °С.
В.4 Бульон для бруцелл
В.4.1 Состав
Продукт ферментативного переваривания казеина | 10,0 г |
Продукт ферментативного переваривания животных тканей | 10,0 г |
Глюкоза | 1,0 г |
Дрожжевой экстракт | 2,0 г |
Натрия хлорид | 5,0 г |
Натрия гидросульфит | 0,1 г |
Вода | 1000 см |
В.4.2 Приготовление
Растворяют базовые компоненты или полную обезвоженную базовую среду в воде, при необходимости путем нагрева. При необходимости корректируют рН, чтобы после стерилизации его значение составляло 7,0±0,2 ед. рН при 25 °С. Разливают среду порциями по 10 см в пробирки подходящей вместимости. Стерилизуют в автоклаве (6.1), установленном на температуру 121 °С, в течение 15 мин.
В.5 Реактив для обнаружения оксидазы
В.5.1 Состав
| 1,0 г |
Вода | 100 см |
В.5.2 Приготовление
Растворяют компонент в воде непосредственно перед использованием.
В.6 Реактивы для обнаружения гидролиза гиппурата
В.6.1 Раствор гиппурата натрия
В.6.1.1 Состав
Натрия гиппурат | 10 г |
Фосфатно-буферный солевой раствор (PBS) | |
Натрия хлорид | 8,5 г |
Динатрия гидрофосфат дигидрат ( | 8,98 г |
Натрия дигидрофосфат моногидрат ( | 2,71 г |
Вода | 1000 см |
В.6.1.2 Приготовление
Растворяют гиппурат натрия в растворе PBS. Стерилизуют путем фильтрации. Разливают реактив в стерильных условиях порциями по 0,4 см в небольшие пробирки подходящей вместимости (6.7). Хранят при температуре примерно 20 °С.
В.6.2 Раствор нингидрина, 3,5% (масса на объем)
В.6.2.1 Состав
Нингидрин | 1,75 г |
Ацетон | 25 см |
Бутанол | 25 см |
В.6.2.2 Приготовление
Растворяют нингидрин в смеси ацетона и бутанола. Хранят раствор в холодильнике в темноте максимально в течение одной недели.
В.7 Кровяной агар Мюллера-Хинтона
В.7.1 Базовая среда
В.7.1.1 Состав
Продукт ферментативного переваривания животных тканей | 6,0 г |
Продукт ферментативного переваривания казеина | 17,5 г |
Крахмал, растворимый | 1,5 г |
Агар | 8,0 г - 18,0 г |
Вода | 1000 см |
| |
В.7.1.2 Приготовление
Растворяют базовые компоненты или полную обезвоженную базовую среду в воде путем доведения до кипения. При необходимости корректируют рН, чтобы после стерилизации его значение составляло 7,3±0,2 ед. рН при температуре 25 °С. Разливают базовую среду в колбы подходящей вместимости. Стерилизуют в автоклаве (6.1), установленном на температуру 121 °С, в течение 15 мин.
В.7.2 Стерильная дефибринированная баранья кровь
В.7.3 Полная среда
В.7.3.1 Состав
Базовая среда (В.7.1) | 1000 см |
Стерильная дефибринированная баранья кровь (В.7.2) | 50 см |
В.7.3.2 Приготовление
Добавляют кровь в стерильных условиях к базовой среде, охлажденной до температуры 47 °С - 50 °С, затем перемешивают. Разливают около 15 см полной среды по стерильным чашкам Петри. Дают затвердеть. Непосредственно перед применением тщательно высушивают слои агара, предпочтительно с открытыми крышками и поверхностью агара, направленной вниз, в сушильном шкафу (6.2) в течение 30 мин или до того момента, когда поверхность агара не будет содержать видимой влаги. Если они были приготовлены заранее, невысушенные агаровые слои следует хранить не более 4 ч при температуре окружающей среды или не более 7 сут при температуре (3±2) °С.
В.8 Диски с индоксилацетатом
В.8.1 Состав
Индоксилацетат | 0,1 г |
Ацетон | 1 см |
В.8.2 Приготовление
Растворяют индоксилацетат в ацетоне. Наносят от 25 мкл до 50 мкл этого раствора на чистые бумажные диски (диаметром от 6 мм до 12 мм). После высушивания при комнатной температуре хранят диски при температуре (3±2) °С в коричневых пробирках или бутылках в присутствии силикагеля.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов и документов ссылочным национальным стандартам Российской Федерации (и действующим в этом качестве межгосударственным стандартам)
Таблица ДА.1
Обозначение ссылочного международного стандарта, документа | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 6887 | - | * |
ИСО 7218:2007 | IDT | ГОСТ ISO 7218-2011 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
ИСО/ТУ 11133-1:2009 | IDT | ГОСТ ISO 11133-1-2011 "Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории" |
ИСО/ТУ 11133-2:2003 | IDT | ГОСТ ISO 11133-2-2011 "Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред" |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. | ||
Библиография
[1] | ISO 835 Посуда лабораторная стеклянная. Мерные градуированные пипетки |
[2] | ISO 7712 Посуда лабораторная стеклянная. Пипетки Пастера одноразового применения |
[3] | NKML Method No. 119, Thermotolerant Campylobacter - Detection, semi-quantitative and quantitative determination in foods and drinkinq water. Available (2009-06-09) from: //shop.nmkl.org/ |
[4] | Baylis, C.L., MacPhee, S., Martin, K.W., Humphrey, T.J., Betts, R.P. Comparison of three enrichment media for the isolation of Campylobacter spp. from foods. J. Appl. Microbiol. 2000, 89, pp. 884-891 |
[5] | Bolton, F.J., Hutchinson, D.N., Coates, D. Blood-free selective medium for isolation of Campylobacter jejuni from feces. J. Clin. Microbiol. 1984, 19, pp. 169-171 |
[6] | Bolton, F.J., Sails, A.D., Fox, A.J., Wareing, D.R., Greenway, D.L. Detection of Campylobacter jejuni and Campylobacter coli in foods by enrichment culture and polymerase chain reaction enzyme-linked immunosorbent assay. J. Food Prot. 2002, 65, pp. 760-767 |
[7] | Corry, J.E.L., Curtis, G.D.W., Baird, R.M., editors. Handbook of culture media for food microbiology. Elsevier, Amsterdam, 2003 (Progress in industrial microbiology, Vol. 37) |
[8] | Hutchinson, D.N., Bolton, F.J. Improved blood free selective medium for the isolation of Campylobacter jejuni from faecal specimens. J. Clin. Pathol. 1984, 37, pp. 956-957 |
[9] | Josefsen, M.H., |
[10] | Rosenquist, H., Bengtsson, A., Hansen, T.B. A collaborative study on a Nordic standard protocol for detection and enumeration of thermotolerant Campylobacter in food (NMKL119, 3. Ed., 2007). Int. J. Food Microbiol. 2007,118, pp. 201-213 |
Электронный текст документа
и сверен по:
, 2013

