ГОСТ Р ИСО 11133-2-2008
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ РУКОВОДЯЩИЕ УКАЗАНИЯ ПО ПРИГОТОВЛЕНИЮ И ПРОИЗВОДСТВУ КУЛЬТУРАЛЬНЫХ СРЕД
Часть 2
Практические руководящие указания по эксплуатационным испытаниям культуральных сред
Microbiology of food and animal feeding stuffs. Guidelines on preparation and production of culture media. Part 2. Practical guidelines on performance testing of culture media
ОКС 07.100.30
ОКСТУ 9209,
9210
Дата введения 2010-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным учреждением "Научно-исследовательский институт эпидемиологии и микробиологии имени почетного академика Н.Ф.Гамалеи" Российской академии медицинских наук на основе русской версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 18 декабря 2008 г. N 474-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11133-2:2000 "Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред" (ISO 11133-2:2000 "Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 2: Practical guidelines on performance testing of culture media")
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Важно, чтобы для проведения микробиологического анализа пищевых продуктов с большой степенью надежности использовались культуральные среды проверенного качества. Для всех сред, описанных в стандартизованных методах, является важным установить минимальные критерии приемлемости, требуемые для обеспечения надежности сред. Рекомендуется, чтобы при определении эксплуатационных характеристик культуральной среды проводились испытания, которые соответствуют настоящим техническим условиям. Это применяется:
1) к приготовленным на коммерческой основе обезвоженным средам, готовым к употреблению;
2) культуральным средам, приготовленным из основных компонентов в лаборатории пользователя.
Установление широко принятых минимальных критериев эксплуатации для сред должно привести к более однородному качеству продукции на коммерческой основе и тем самым сократить спектр испытаний, которые необходимо проводить в лаборатории пользователя.
Кроме того, минимальные критерии приемлемости, измеряемые методами, установленными в настоящем стандарте, могут использоваться всеми микробиологическими лабораториями для оценки свойств производительности, селективности и/или избирательности культуральной среды.
В микробиологическом анализе пищевых продуктов и кормов для животных требования настоящего стандарта являются приоритетными при оценке качества сред.
1 Область применения
Настоящий стандарт устанавливает критерии и методы эксплуатационных испытаний культуральных сред. Настоящий стандарт применяется:
- к коммерческим структурам, производящим и/или распространяющим готовые к употреблению или полуфабрикатные, восстановленные или обезвоженные среды для микробиологических лабораторий;
- некоммерческим структурам, поставляющим среды третьей стороне;
- микробиологическим лабораториям, осуществляющим приготовление культуральных сред для собственного использования и оценивание эксплуатационных характеристик этих сред.
2 Нормативные ссылки
В настоящем стандарте использована ссылка на следующий стандарт:
ИСО 11133-1:2000 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории
3 Термины и определения
В настоящем стандарте применены термины по ИСО 11133-1.
4 Критерии обычного контроля качества
4.1 Общие критерии качества
4.1.1 Качество культуральных сред
Качество культуральных сред зависит от качества основных компонентов, правильности состава, качества процедур приготовления, устранения загрязняющих микробных агентов и надлежащих условий упаковки и хранения (см. ИСО 11133-1).
Производитель или оператор в лаборатории должен действовать в соответствии с физико-химическими характеристиками культуральных сред, как это установлено в соответствующем стандарте. Кроме того, оценивание качества должно гарантировать, что культуральная среда соответствует установленным рекомендациям, включая следующие характеристики:
- нанесенное количество и/или толщину;
- внешний вид, цвет и гомогенность;
- однородность геля;
- содержание воды;
- значение рН;
- буферную емкость;
- микробное загрязнение.
Индивидуальные компоненты и любые питательные или селективные добавки также должны проходить надлежащие процедуры оценки качества.
4.1.2 Качество основных компонентов сред
Культуральные среды, которые описываются в международных стандартах, рассматриваются как удовлетворительные; вместе с тем, из-за непостоянства их качества для производителей сред может быть приемлемым изменение концентрации некоторых основных биологических компонентов, приведенных ниже:
- пептонов и мясных или дрожжевых экстрактов, питательные свойства которых непостоянны;
- агара, гелеобразующие свойства которого непостоянны;
- буферных веществ;
- желчных солей, желчного экстракта и дезоксихолата, антибактериальных красителей, в зависимости от их селективных свойств;
- антибиотиков, в зависимости от их активности.
4.2 Микробиологические критерии качества
4.2.1 Общие положения
Испытания микробиологических эксплуатационных характеристик следует проводить с использованием пробы, которая является представительной для партии конечного продукта.
4.2.2 Микробное загрязнение
Надлежащее количество, в зависимости от размера партии культуральной среды, должно быть испытано на микробное загрязнение путем инкубации в соответствующих условиях. Намеченные пределы количества загрязненных чашек или емкостей жидкой среды следует установить для каждой среды, или они должны быть установлены производителем. Производители должны составить технические условия, основываясь на компонентах сред, технологических ограничениях и типе упаковки.
Примечания
1 Пробы, которые подвергаются испытаниям, должны представлять собой по меньшей мере одну чашку или пробирку либо 1% чашек или пробирок от начала и одну чашку или пробирку, либо 1% чашек или пробирок от конца процесса разливки или распределения. Чашки или пробирки следует инкубировать по меньшей мере в течение 18 ч при 37 °С или в условиях инкубации, которые обычно применяются для данной среды в соответствии с конкретным стандартом.
2 Для плана статистической выборки см. ИСО 2859-1.
4.2.3 Рост
4.2.3.1 Общие положения
Для оценивания каждой партии культуральной среды в целом, питательных компонентов или добавок необходимо надлежащим образом оценить рост:
1) количественным или
2) полуколичественным или
3) качественным методом.
Количественное, полуколичественное или качественное определение проводят методами, описанными в настоящим стандарте, или другими общепринятыми методами. Для интерпретации результатов испытаний необходимо проводить сравнение величины роста в испытуемой среде с этой величиной для эталонной среды. Использование конкретной эталонной среды является обязательным для количественного метода (см. соответствующий стандарт или приложение В).
В случае полуколичественного или качественного метода использование конкретной эталонной среды (см. соответствующий стандарт или приложение В) или культуральной среды, дающей "положительную" реакцию, помогает интерпретировать результаты. Эталонная среда должна быть проверенного качества, отобранная из недавно выпущенных партий, или партии другого поставщика, или готовая к употреблению среда и т.п.
Помимо этого, рост целевых штаммов должен быть типичным в плане внешнего вида, размера и морфологии колоний, и рост нецелевых штаммов должен быть частично или полностью ингибирован.
4.2.3.2 Производительность
Твердые, полутвердые или жидкие культуральные среды должны быть инокулированы с использованием подходящего инокулята (см. 5.2.1.1) рабочей культуры каждого определенного тест-микроорганизма при помощи надлежащего устройства.
Производительность должна достичь установленного минимального предела (см. соответствующий стандарт или приложение В).
Для количественного метода коэффициент производительности вычисляют по формуле
![]() , (1)
, (1)
где - общее количество колоний, полученных на данной культуральной среде при испытании (полученных на одной или более чашках);
- общее количество колоний, полученных на определенной эталонной культуральной среде на одной или более чашках; оно должно быть
100 КОЕ (колониеобразующих единиц).
Примечание - Коэффициент производительности неселективной среды составляет по меньшей мере 0,7 для микроорганизмов, которые могут легко расти на этой среде. целевых микроорганизмов на селективной среде должен быть не менее 0,1. Обычно достигаются эти значения, вместе с тем для определенных комбинаций сред и тест-микроорганизмов могут быть приняты менее жесткие критерии (см. соответствующий стандарт или приложение В).
В случае полуколичественных методов результаты подсчета в последовательных секторах чашки с инокуляцией экометрическим методом суммируются для получения показателя роста , который варьируется в зависимости от культуральной среды. Таким образом, является существенным их сравнение с предыдущими показателями и/или с
эталонной среды и обеспечение того, что имеющиеся вариации не превышают норму. Ожидаемый диапазон вариаций для каждой культуральной среды также может быть установлен, как только будет наработан достаточный опыт применения метода.
Качественные определения проводят визуально путем локализации баллов, характеризующих рост.
4.2.3.3 Селективность
Для количественной оценки селективности селективные культуральные среды и эталонную среду инокулируют с использованием надлежащего инокулята (см. 4.2.1.2) определенного тест-микроорганизма при помощи надлежащего устройства. Селективность должна достичь определенных значений (см. соответствующий конкретный стандарт или приложение В).
Фактор селективности вычисляют по формуле
![]() , (2)
, (2)
где - наибольшее разбавление, демонстрирующее рост по меньшей мере 10 колоний на эталонной среде;
- наибольшее разбавление, демонстрирующее сопоставимый рост на испытуемой среде.
,
и
выражены в единицах
.
Примечание - нецелевых микроорганизмов на селективной среде должен быть не менее двух. Как правило, достигается это значение. Вместе с тем, для определенных комбинаций сред и тест-микроорганизмов могут быть приняты менее жесткие критерии (см. соответствующий стандарт или приложение В).
Для полуколичественных и качественных методов рост неселективного штамма(ов) должен быть частично или полностью ингибирован.
4.2.4 Биохимические и физиологические характеристики (селективность и специфичность)
Морфология колоний и диагностические особенности вместе со степенью селективности должны быть установлены с целью получения полной картины эксплуатационных характеристик среды.
Необходимо определить и достичь существенные характеристики специфичности. Для дифференциальных сред качество биохимических/физиологических характеристик целевого микроорганизма(ов) и степень ингибирования нецелевых микроорганизмов следует определить с использованием надлежащего набора испытательных штаммов.
4.2.5 Характеристики антимикробных испытаний
Антимикробное действие антибиотиков зависит от характеристик их диффузии в агаре и любых антагонистических влияний присутствующих компонентов. Среды для испытаний присутствия или отсутствия антимикробных веществ в пробах пищевых продуктов должны подходить для эталонных методов.
4.3 Оценивание эксплуатационных характеристик и интерпретация результатов
Партия культуральной среды демонстрирует удовлетворительные эксплуатационные характеристики, если все используемые тест-микроорганизмы ведут себя в соответствии с приведенными в настоящем стандарте. Она должна быть принята в случае, если соблюдаются общие и микробиологические критерии качества.
5 Методы использования эксплуатационных испытаний культуральных сред
5.1 Общие положения
Описаны примеры количественного, полуколичественного и качественного методов испытаний для твердых культуральных и жидких сред. В большинстве случаев полуколичественный и качественный методы, используемые в лаборатории пользователя, должны соответствовать требованиям к эксплуатационным испытаниям партии культуральной среды.
В особых случаях, например, при оценивании новой среды или нового производителя и т.п. количественные методы испытаний следует применять в лаборатории пользователя.
Предполагается, что общепринятые микробиологические методы известны и, следовательно, их полное изложение не приводится.
Релевантные тест-микроорганизмы приведены в приложении В (см. также ИСО 11133-1).
Примечание - В новые и пересматриваемые стандарты по определению или подсчету конкретных микроорганизмов или групп микроорганизмов следует включать описание релевантных тест-микроорганизмов, которые будут использоваться вместе с критериями приемлемости для каждой культуры в стандарте.
Для жидких сред взаимодействия, приводящие к успешному росту микроорганизмов, более сложные; таким образом, устанавливаемые методы эксплуатационных испытаний менее эффективны, чем для твердых сред.
Для успешной изоляции целевых микроорганизмов в многостадийном методе, например, определении Salmonella, на каждой стадии роста имеют место несколько сложных взаимодействий. В данном случае следует провести контрольное испытание с использованием надлежащих проб, культуры и эталонных веществ, чтобы продемонстрировать производительность или, соответственно, селективность всего метода. Кроме того, можно продемонстрировать, что каждый компонент среды соответствует целям.
5.2 Тест-микроорганизмы
Релевантные эталонные штаммы целевых (продуктивность) и нецелевых (селективность) микроорганизмов для каждой культуральной среды приведены в приложении В. Тест-микроорганизмы должны соответствовать требованиям, изложенным в ИСО 11133-1 (пункт 5.2.2), например, речь идет о жизнестойких, медленно растущих, биохимически неактивных или поврежденных штаммах, когда это целесообразно.
Методические указания по консервированию и сохранению эталонных штаммов приводятся в приложении В ИСО 11133-2.
5.2.1 Приготовление рабочей культуры
Рабочие культуры следует готовить как чистые культуры со стационарной фазой в неселективном бульоне из эталонных исходных культур.
Могут использоваться различные методы, но они должны гарантировать чистоту инокулята, а также его стандартизацию, которая позволит использовать его в последующей стадии.
Примечание - Замороженные инокуляты можно использовать, если будет показано, что данный микроорганизм способен выживать в течение выбранного периода.
5.2.1.1 Рабочая культура для испытаний на производительность
Для количественных испытаний чашечной среды для требуемых микроорганизмов используется инокулят, содержащий приблизительно 10 КОЕ.
Для полуколичественных или качественных испытаний чашечной среды необходим инокулят, содержащий 10-10
КОЕ.
Для испытаний на производительность жидких сред используется инокулят, содержащий 10-100 КОЕ.
5.2.1.2 Рабочая культура для испытаний на селективность
Для испытаний культуральных сред на селективность в чашку или в пробирку со средой инокулируют суспензию нецелевых микроорганизмов, содержащую от 10 до 10
КОЕ.
5.2.1.3 Условия инкубации
Инокулированные культуральные среды инкубируют с соблюдением условий, описанных в соответствующем стандарте и приведенных в соответствующих таблицах приложения В.
5.3 Методы, применяемые в отношении твердых культуральных сред
5.3.1 Метод количественного культивирования
5.3.1.1 Общие положения
Это обычный метод, пригодный для большинства твердых культуральных сред. Он может быть непригодным для испытаний некоторых видов плесневых грибов.
5.3.1.2 Процедура
Используют рабочие культуры в соответствии с 5.2.1.
Отбирают надлежащее число чашек, которые являются представительными для каждой партии, подлежащей испытаниям, и обеспечивают правильное высушивание поверхности каждой чашки. Чашки с эталонной средой готовят аналогичным образом.
По поверхности испытуемых и эталонных чашек распределяют инокулят разбавленной рабочей культуры с целью внесения количества, которое входит в рекомендуемые пределы, приведенные в 5.2.1.
Примечание - Может также использоваться чашечный метод для культуральных сред, обычно применяемых для подсчета таким образом.
Чашки инкубируют в соответствующих условиях, как это установлено в соответствующих стандартах.
Проводят подсчет колоний, присутствующих в каждой чашке или в каждой капле, по обстоятельствам. Оценивают размер и внешний вид колоний.
5.3.1.3 Расчеты
Исходя из объема, распределенного на чашках, и фактора разбавления, можно рассчитать среднее количество микроорганизмов в среде. В случае использования капельных методов необходимо принимать во внимание количество капель и их объем.
5.3.1.4 Интерпретация результатов
Для интерпретации результатов следует рассчитать коэффициент производительности (см. 5.2.3.2) или фактор селективности
(см. 5.2.3.3).
5.3.2 Полуколичественный метод штриховой разводки, основанный на экометрии
5.3.2.1 Общие положения
Метод штриховой разводки пригоден для эксплуатационных испытаний твердых и жидких культуральных сред, данный метод является только полуколичественным. Таким образом, показатели роста являются лишь ориентировочными, и он может рассматриваться только как дополнительное испытание твердых культуральных сред.
При использовании данного метода испытуемые культуральные среды необходимо высушить до одной и той же степени, и вся процедура должна быть стандартизирована, чтобы можно было сравнивать результаты, полученные для различных партий.
5.3.2.2 Процедура
Чашки с агаром готовят обычным способом, используя около 15 см агара. Среды, обычно используемые в чашечном методе, например агар с чашечным подсчетом, могут также подвергаться испытаниям поверхностным культивированием на затвердевших средах.
Используют рабочие культуры, как это описано в 5.2.1.
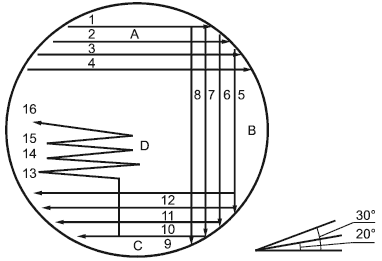
В чашки делают посев штрихом, как это показано на рисунке 1, используя петлю на 1 мкл. Проводят четыре параллельные линии петлей с интервалом приблизительно 0,5 см в секторе А. Штриховую разводку повторяют для секторов В и С и завершают в секторе D одной линией. Для помощи в выполнении точной штриховой разводки под чашкой можно использовать шаблон.
Рисунок 1 - Образец проведения инокуляции при помощи модифицированного метода штриховой разводки и угол наклона петли
Соблюдают время и температуру инкубации, установленные в стандартных методах.
Примечание - В культуру необходимо погружать только петлю, но не проволоку. Петля должна быть полностью заполнена культурой. Избыточную жидкость удаляют трехкратным нажатием на расширенную часть петли, используя край емкости. При нанесении штриховой разводки угол между петлей и поверхностью агара должен быть от 20 °С до 30 °С . Давление петли на поверхность агара и скорость проведения штриховой разводки должны быть всегда соразмерны. Следует избегать погружения петли в культуру, если на поверхности бульона имеются пена и/или пузыри.
Обычно для штриховой разводки всех секторов от А до D используют одну и ту же петлю без обработки в пламени между операциями посева штрихом. В некоторых случаях, когда более низкий показатель роста , как ожидается, должен продемонстрировать четко выраженные различия, могут быть уместными замена или стерилизация петли между операциями посева штрихом в секторах А и В.
5.3.2.3 Расчеты
После инкубации оценивают внешний вид, размер колоний и интенсивность роста и вычисляют показатель роста . Каждой линии посева, которая показывает рост, приписывают 1 балл. Максимальное количество баллов для чашки равно 16. Линии приписывают 0,5 баллов, если рост наблюдается только на половине ее длины. Линия, на которой роста нет или имеется ограниченный рост (менее половины длины), оценивается в 0 баллов. Баллы суммируют с целью получения
. Например, если рост наблюдается в секторах А и В и в половине сектора С,
будет равен 10.
5.3.2.4 Интерпретация результатов
Показатель роста , характеризующий целевой штамм, должен быть по меньшей мере равен 6, чтобы сделать выводы о приемлемости среды. В случае неселективных сред
обычно выше.
Кроме того, рост целевого штамма должен быть типичным, а рост нецелевых штаммов должен быть частично или полностью ингибирован.
5.3.3 Качественный метод штриховой разводки
5.3.3.1 Общие положения
Данный метод пригоден для дополнительных эксплуатационных испытаний твердых культуральных сред.
Данный метод является только качественным, и, таким образом, оценка дается только приблизительная.
5.3.3.2 Процедура
Чашки с агаром готовят обычным способом, используя около 15 см агара. Среды, обычно используемые в чашечном методе, например агар с чашечным подсчетом, могут также подвергаться испытаниям поверхностным культивированием на затвердевших средах.
Используют рабочие культуры, как это описано в 5.2.1.
Тест-микроорганизмы наносят прямыми параллельными линиями, используя петлю на 1 мкл, на поверхность испытуемой среды. В одной и той же чашке можно осуществлять посев штрихом нескольких тест-микроорганизмов, не смешивая их.
Примечание - Возможно применение других стандартизированных методов штриховой разводки.
5.3.3.3 Интерпретация результатов
Рост, наблюдаемый в чашках после инкубации, оценивается следующим образом:
- 0 соответствует нулевому росту,
- 1 соответствует слабому росту и
- 2 соответствует значительному росту.
Целевые микроорганизмы должны оцениваться в 2 балла и иметь типичный внешний вид, размер и морфологию колоний. Рост нецелевых микроорганизмов должен быть частично или полностью ингибирован (0 или 1).
5.4 Методы, применяемые в отношении жидких культуральных сред
5.4.1 Общие положения
Для определения производительности жидкой среды необходимо использовать подходящий инокулят. Количественный, полуколичественный и качественный методы, описанные ниже, позволяют оценить производительность и селективность. Предлагаемые методы регистрируют степень роста после надлежащей инкубации путем культивирования или штрихового посева из жидких сред на агаровые среды и подсчета колониеобразующих единиц (КОЕ) или вычисления баллов для жидкой среды. В случае качественных методов для жидких сред характеристические реакции оценивают визуально.
5.4.2 Количественный метод разбавления для целевых и нецелевых микроорганизмов
Данный метод также пригоден для оценивания новых культуральных сред или разбавителей.
5.4.2.1 Процедура
Отбирают нужное число пробирок или порций по 10 см каждой партии испытуемой жидкой среды.
Инокуляция целевых микроорганизмов: инокулируют испытуемый бульон и эталонный бульон, используя каждый тест-микроорганизм с малым содержанием (например, от 10 до 100 КОЕ в каждой пробирке; о приготовлении инокулята см. 5.2.1), и перемешивают.
Инокуляция нецелевых микроорганизмов: инокулируют испытуемый бульон и эталонный бульон, используя каждый тест-микроорганизм с более высоким содержанием (>1000 КОЕ в каждой пробирке; о приготовлении инокулята см. 5.2.1), и перемешивают.
Инокуляция целевых и нецелевых микроорганизмов как смешанной культуры: для испытаний смешанных культур в селективных средах инокулируют испытуемый бульон и эталонный бульон малым количеством целевых микроорганизмов (например, от 10 до 100 КОЕ на каждую пробирку; о приготовлении инокулята см. 5.2.1) и в ту же пробирку вносят значительное количество нецелевых микроорганизмов (>1000 КОЕ в каждую пробирку; о приготовлении инокулята см. 5.2.1), и перемешивают.
Инокуляция целевых и нецелевых микроорганизмов в разбавителях и транспортных средах: инокулируют разбавители тест-микроорганизмами (например, от 100 до 1000 КОЕ в каждую пробирку; о приготовлении инокулята см. 5.2.1) и перемешивают.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
Разбавители должны инкубироваться в течение 45 мин при комнатной температуре и затем быть разлиты по чашкам. Транспортные среды должны инкубироваться при соответствующей температуре и нужное время в соответствии с обычным использованием и затем быть разлиты по чашкам.
Берут аликвотный объем или, при необходимости, разбавление каждого бульона после инкубации и распределяют в чашке с неингибирующим агаром, как это описано в 5.3.1.
Примечание - Для испытаний смешанных культур необходимо проводить распределение, когда это возможно, на чашках с неселективным агаром, которое позволяет достичь дифференциации микроорганизмов в смешанной культуре (например, для подсчета видов Escherichia coli и Salmonella используется агар с чашечным подсчетом с MUG). В случае, когда невозможно различить смешанные культуры на неселективном агаре, следует использовать среды с селективным агаром при условии, что были предварительно испытаны их эксплуатационные характеристики.
5.4.2.2 Снятие результатов, расчеты и интерпретация
После инкубации проводят подсчет колоний целевых и нецелевых микроорганизмов, в случае, если в смешанных культурах можно различить разные типы. Расчеты и интерпретацию следует проводить с учетом цели исследования:
1) сравнительная интерпретация между эталонным и испытуемым бульонами, используя значения и
, как это описано в 4.2.3.2 и 4.2.3.3:
- для целевых микроорганизмов не должен быть <0,1 (разница в росте не превышает одного порядка величины);
- для нецелевых микроорганизмов должен достигать по меньшей мере 2;
- в смешанных культурах рост целевых микроорганизмов не должен ингибироваться нецелевыми микроорганизмами, т.е. целевые микроорганизмы должны всегда быть доминирующей популяцией;
2) в других случаях, когда достигается фиксированное минимальное количество целевых микроорганизмов и максимальное количество нецелевых микроорганизмов, более уместно, что:
- содержание целевых микроорганизмов должно достигать от 10 КОЕ/см
до 10
КОЕ/см
;
- содержание нецелевых микроорганизмов не должно превышать 10 КОЕ/см
в селективном бульоне;
3) в случае разбавителей и транспортных сред не требуется ни пониженное, ни повышенное количество целевых и/или нецелевых микроорганизмов. Число микроорганизмов после инкубации в данных средах должно быть в пределах ±50% от исходного количества.
Примечание - Качество жидкой среды в плане свойств оптимального роста проявляется наиболее обстоятельно на ранней стадии роста. Анализ продолжительности лог-фазы и роста в начале лог-фазы дает наиболее точную информацию относительно производительности и селективности целевых и нецелевых микроорганизмов соответственно в испытуемом и эталонном бульонах. Таким образом, если пытаются обнаружить только минимальные различия в качестве сред, следует провести штриховой посев из жидких сред в чашках после сокращенного периода инкубации продолжительностью, например, 6 или 12 ч.
5.4.3 Полуколичественный метод с одной пробиркой для целевых, нецелевых и смешанных микроорганизмов
5.4.3.1 Процедура
Отбирают нужное количество пробирок или порций по 10 мл каждой испытуемой партии.
Инокуляция целевых и нецелевых микроорганизмов как смешанной культуры: инокулируют одну пробирку испытуемого бульона примерно от 10 до 100 КОЕ целевых микроорганизмов и в ту же пробирку инокулируют повышенное число нецелевых микроорганизмов (>1000 КОЕ на каждую пробирку) и перемешивают.
Инокуляция нецелевых микроорганизмов: инокулируют одну пробирку испытуемого бульона микроорганизмами с повышенным содержанием (>1000 КОЕ) и перемешивают.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
Отбирают 10 мкл смешанной культуры и проводят штриховой посев в чашке с конкретной селективной средой для целевых микроорганизмов.
Отбирают одну петлю (10 мкл) культуры нецелевых микроорганизмов и проводят штриховой посев в чашке с неселективной средой (например с триптиказо-соевым агаром).
Инкубируют обе чашки в надлежащих условиях необходимое время, как это установлено в соответствующих стандартах.
5.4.3.2 Расчеты и интерпретация результатов
Производительность испытуемого жидкого бульона является удовлетворительной, если по меньшей мере 10 колоний целевых микроорганизмов выросли в чашке с селективным агаром.
Селективность испытуемого жидкого бульона является удовлетворительной, если не наблюдалось никакого роста (или менее 10 КОЕ) нецелевых микроорганизмов в чашке с неселективным агаром.
5.4.4 Качественный метод с одной пробиркой
5.4.4.1 Общие положения
Данный метод пригоден для эксплуатационных испытаний жидких культуральных сред. Метод является только качественным, и оценки, таким образом, приблизительные. Для испытания мутных сред, например тетратионатный бульон, этот метод не применим.
5.4.4.2 Процедура
Для эксплуатационных испытаний жидких культуральных сред рабочие культуры непосредственно инокулируют в испытуемую среду, используя петлю на 1 мкл.
Соблюдают время и температуру инкубации, установленные в стандартных методах.
5.4.4.3 Интерпретация результатов
Качественное определение следует проводить визуально путем определения баллов роста, например, от 0 до 2.
Для пробирок и бутылок
- 0 соответствует нулевой мутности;
- 1 соответствует очень слабой мутности;
- 2 соответствует удовлетворительной мутности.
Число баллов для целевых микроорганизмов должно быть равно 2.
Примечания
1 Иногда рост микроорганизмов можно наблюдать только как агрегацию, осаждение клеток на дне пробирки или бутылки. В этом случае оценивание и интерпретацию может улучшить тщательное встряхивание.
2 Данный метод позволяет также оценить другие характеристики, такие как образование газа, изменение цвета и т.п.
6 Документирование результатов испытаний
6.1 Информация, предоставляемая производителем
Производитель или поставщик культуральных сред должен по запросу предоставлять сведения о характеристиках конкретного микробиологического роста и общую информацию, касающуюся конкретной партии культуральной среды.
6.2 Прослеживаемость
Все данные обычных эксплуатационных испытаний должны быть задокументированы надлежащим образом и храниться в течение достаточного периода времени в соответствии с действующей системой качества. Рекомендуется использование контрольных листов для документирования и оценивания результатов испытаний (см. приложение А).
Приложение А
(рекомендуемое)
Пример таблицы регистрации результатов испытаний культуральных сред, приготовленных лабораторией пользователя
Таблица А.1 - Пример таблицы
Контрольная таблица для внутренних испытаний на качество культуральных сред | |||||
Культуральная среда: | Приготовленный объем: | Дата добавления: | Внутренний номер партии: | ||
Обезвоженная среда (и код): | Поставщик: | Партия | Количество: | Дата/подпись: | |
Добавка: | Поставщик: | Партия | Количество: | Дата/подпись: | |
Подробности процесса | |||||
Физический контроль качества | |||||
Ожидаемое значение рН: | Измеренный рН: | Качество подтверждено: да , нет | Дефекты: | Дата/подпись: | |
Ожидаемое заполняющее количество и/или толщина слоя: | Наблюдается: | Качество подтверждено: да | Дефекты: | Дата/подпись: | |
Ожидаемый цвет: | Наблюдается: | Качество подтверждено: да | Дефекты: | Дата/подпись: | |
Ожидаемая прозрачность/ присутствие оптических артефактов: | Наблюдается: | Качество подтверждено: да | Дефекты: | Дата/подпись: | |
Ожидаемые стабильность/ постоянство/влажность геля: | Наблюдается: | Качество подтверждено: да | Дефекты: | Дата/подпись: | |
Микробное загрязнение | |||||
Номера испытуемых чашек или пробирок: Инкубация: | Результат: | Качество подтверждено: да | Номера загрязненных чашек или пробирок | Дата/подпись: | |
Микробиологический рост - Производительность | Метод контроля: Количественный | ||||
Штаммы: Инкубация: Эталонная среда: | Критерии: | Результат: | Качество подтверждено: да | Дата/подпись: | |
Микробиологический рост - Селективность | Метод контроля: Количественный | ||||
Штаммы: Инкубация: Эталонная среда: | Критерии: | Результат: | Качество подтверждено: да | Дата/подпись: | |
Микробиологический рост - Специфичность | Метод контроля: Количественный | ||||
Штаммы: Инкубация: Эталонная среда: | Критерии: | Результат: | Качество подтверждено: да | Дата/подпись: | |
Выпуск партии | |||||
Подробности хранения | Выпуск партии да | Дата/подпись: | |||
Приложение В
(рекомендуемое)
Рекомендуемые тест-микроорганизмы для широко используемых культуральных сред (приводится информация о культуральных средах, условиях содержания сред, тест-микроорганизмах, номере коллекции культур тест-микроорганизмов и ожидаемых реакциях)
Таблицы В.1-В.6 составлены, принимая во внимание контрольные штаммы, используемые в Европейской фармакопее, и рекомендации фармакопеи, касающиеся микробиологии пищевых продуктов в отношении культуральных сред (Рабочая группа Международного комитета по микробиологии пищевых продуктов и гигиене). Данные критерии предстоит включить в соответствующие стандарты при их подготовке или пересмотре в будущем (новый стандарт или пересмотр). Утвержденная партия среды - это партия среды, которая показала удовлетворительные эксплуатационные характеристики. Допускается использование тех же штаммов из других эталонных коллекций (например, NCTC, CIP и др.). Все приводимые среды описаны в стандартах ЕН и ИСО.
Таблица В.1 - Селективные среды для подсчета микроорганизмов
Среда | Тип | Микроорганизмы | Обозначение стандарта | Функция | Инкубация | Контрольные штаммы | Эталонные среды | Метод контроля | Критерии | Характерная реакция |
Бэрда- Паркера | S | Коагулязопо- ложительные стафилококки | ЕН ИСО 6888-1 | Производи- тельность | 24-48 ч/37 °С | S. aureus АТСС 6538 S. aureus АТСС 25923 | Триптика- зосоевый агар (TSA) | Количест- венный | PR | Черные/серые колонии с четким ореолом (реакция просветления яичного желтка) |
Селектив- ность | 48 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Качественный | Полное ингиби- рование | - | ||||
Специфич- ность | 24-48 ч/37 °С | S. epidermidis ATCC 12228 | - | Качественный | - | Черные/серые колонии без реакции просветления яичного желтка | ||||
RPFA | S | Коагулязопо- ложительные стафилококки | ЕН ИСО 6888-2 | Производи- тельность | 24-48 ч/37 °С | S. aureus АТСС 6538 или 6538 Р S. aureus АТСС 25923 | TSA | Количест- | PR | Черные/серые колонии с темным ореолом |
Селектив- ность | 48 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Качественный | Полное ингиби- | - | ||||
Специфич- ность | 24-48 ч/37 °С | S. epidermidis ATCC 12228 | - | Качественный | - | Черные/серые колонии без темного ореола | ||||
Хлор-ам- феникол или OGA (OGY) | S | Дрожжи/плес- невые грибы | ИСО 7954 | Производи- тельность | 3-5 дней/25 °С | С. albicans АТСС 10231 A. niger ATCC 16404 P. cyclopium АТСС 16025 S. cerevisiae АТСС 9763 | SDA, OGA или хло- рамфени- | Количест- | PR | Характерные колонии в соответствии с каждым видом |
Селектив- ность | 3-5 дней/25 °С | E.coli ATCC 25922 или 8739 B. subtilis ATCC 6633 | - | Качественный | Полное ингиби- рование | - | ||||
MRS | S | Молочнокис- лые бактерии | ИСО 15214 | Производи- тельность | 72 ч/30 °С | L. sake АТСС 15521 Ped. damnosus АТСС 29358 Lc. lactis АТСС 19435 | Партия среды MRS, уже утверж- денная | Количест- венный | PR | Характерные колонии в соответствии с каждым видом |
Селектив- ность | 72 ч/30 °С | Е. col АТСС 25922 или 8739 | - | Качественный | Полное ингиби- рование | - | ||||
В. cereus АТСС 11778 | ||||||||||
MYP | S | Bacillus cereus | EН ИCO 7932 | Производи- тельность | 24-48 ч/30 °С | В. cereus АТСС 11778 | TSA | Количест- венный | PR | Розовые колонии с ореолом осадка |
Селектив- ность | 48 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Качественный | Полное ингиби- рование | - | ||||
Специфич- ность | 48 ч/37 °С | В. subtilis АТСС 6633 | - | - | - | Желтые колонии без ореола осадка | ||||
Oxford | S | Listeria mono- cytogenes | EН ИCO 11290 | Производи- тельность | 48 ч/37 °С | L. mono 1/2a АТСС 19111 | TSA | Количест- | PR | Черно-серые колонии с черным ореолом |
L. mono 4b АТСС 13932 | ||||||||||
Селектив- ность | 48 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Качественный | Полное ингиби- | - | ||||
Е. faecalis АТСС 29212 или 19433 | ||||||||||
С. albicans АТСС 10231 | ||||||||||
PALCAM | S | Listeria monocytoge- nes | EН ИCO 11290 | Производи- тельность | 48 ч/37 °С | L. mono 1/2a АТСС 19111 | TSA | Количест- | PR | Серо-зеленые и черные колонии с черным ореолом |
Селектив- ность | 72 ч/30 °С | L. mono 4b АТСС 13932 | - | Качественный | Полное ингиби- | - | ||||
Е. coli АТСС 25922 или 8739 | ||||||||||
Е. faecalis АТСС 29212 или 19433 | ||||||||||
TS(C) | S | Clostridium perfringens | ЕН ИСО 7937 | Производи- тельность | 20 ч/37 °С (анаэробная атм.) | Cl. perfringens АТСС 13124 | Партия среды TS(C), уже утверж- | Количест- | PR | Черные колонии |
Cl. perfringens АТСС 12916 | ||||||||||
Селектив- ность TSC | 20 ч/37 °С (анаэробная атм.) | Е. coli АТСС 25922 или 8739 | - | Количест- | - | Полное ингибирование | ||||
Специфич- ность TS | - | Количест- | - | Белые колонии | ||||||
VRBG | S | Enterobacteria-ceae | ИСО 7402, ИСО 8523 | Производи- тельность | 24 ч/ 37 °С | Е. coli АТСС 25922 или 8739 | TSA | Количест- | PR | Розово-красные колонии с ореолом или без ореола осадка |
S. typhimurium АТСС 14028 | ||||||||||
Селектив- ность | 24 ч/37 °С | Е. faecalis АТСС 29212 или 19433 | - | Качественный | Полное ингиби- рование | - | ||||
VRBL | S | Coliforms | ИСО 4832 | Производи- тельность | 24 ч/30 °С | Е. coli АТСС 25922 или 8739 | TSA | Количест- венный | PR | Пурпурные колонии с ореолом или без ореола осадка |
Селектив- ность | 24 ч/30 °С | Е. faecalis АТСС 29212 или 19433 | - | Качественный | Полное ингиби- рование | - | ||||
Специфич- ность | 24 ч/30 °С | Ps. aeruginosa АТСС 27853 | - | Качественный | - | Бесцветные или бежевые колонии | ||||
CT-SMAC | S | Escherichia coli О157 | ИСО 16654 | Производи- тельность | 24 ч/37 °С | E.coli O 157:H7 АТСС 43894 или 43895 | TSA | Количест- венный | PR | Прозрачные колонии с бледной желтовато-коричневой окраской и диаметром около 1 мм |
Селектив- ность | 24 ч/37 °С | S. aureus АТС 6538 или 25923 | - | Качественный | Полное ингиби- рование | - | ||||
Специфич- ность | 24 ч/37 °С | Е. coli АТСС 11775 или 25922 | - | Качественный | - | Розовые колонии | ||||
BGBLB | L | Coliforms | ИСО 4831 | Производи- тельность | 24-48 ч/30 °С | Е. coli АТСС 25922 или 8739 С. freundii АТСС 43864 | - | Полуколи- чественный | Мутность 2 + газ в 1/3 пробирки Дюрхэма | Образование газа и мутность |
Селектив- ность | 24-48 ч/30 °С | Е. faecalis АТСС 29212 или 19433 | - | Качественный | Отсутствие роста | - | ||||
LST | L | Coliforms | ИСО 4831 | Производи- тельность | 24-48 ч/30 °С | Е. coli АТСС 25922 или 8739 С. freundii АТСС 43864 | - | Полуколи- чественный | Мутность 2 + газ в 1/3 пробирки Дюрхэма | Образование газа и мутность |
Селектив- ность | Е. faecalis АТСС 29212 или 19433 | - | Качественный | Отсутствие роста | - | |||||
EC | L | Escherichia coli | ИСО 7251 | Производи- тельность | 24-48 ч/44 °С | Е. coli АТСС 25922 или 8739 | - | Полуколи- чественный | Мутность 2 + газ в 1/3 пробирки Дюрхэма | Образование газа и мутность |
Селектив- ность | 24-48 ч/44 °С | Ps. aeruginosa АТСС 27853 | - | Качественный | Отсутствие роста | - | ||||
Примечание - Для твердых культуральных сред возможно также использование полуколичественного метода культивирования. | ||||||||||
Таблица В.2 - Неселективные среды для подсчета микроорганизмов
Среды | Тип | Микро- | Стан- | Функция | Инкубация | Контрольные штаммы | Эта- | Метод контроля | Критерии | Характерис- |
РСА | S | Общая флора | ИСО 4833 | Произво- | 72 ч/30 °С | Е. coli АТСС 25922 или 8739 | TSA | Коли- | PR | - |
S. aureus АТСС 6538 или 6538 Р | ||||||||||
В. Subtilis АТСС 6633 | ||||||||||
| ||||||||||
Таблица В.3 - Обогатительные селективные среды
Среда | Тип | Микро- | Обозначение стандарта | Функция | Инкубация | Контрольные штаммы | Эталон- | Метод контроля | Критерии | Характерная реакция целевых микроорганизмов |
ЕЕ | L | Enterobacteria сеае | ИСО 7402 ИСО 8523 | Производи- тельность | 24 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Полуколи- чественный | Более 10 колоний на VRGB | Розово-красные колонии с или без ореола осадка |
Селектив- ность | 24 ч/37 °С | + Е. faecalis АТСС 29212 или 19433 | - | Полуколи- чественный | Полное ингиби- рование | |||||
Half-Fraser | L | Listeria mono- cytogenes | EN ИСО 11290-1 | Производи- тельность | 24 ч/30 °С | L. mono 1/2a АТСС 19111 | - | Полуколи- чественный | >10 колоний на Oxford или PALCAM | Серо-черные колонии с черным ореолом |
или L. mono 4b АТСС 13932 | ||||||||||
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ Е. faecalis АТСС 29212 или 19433 | ||||||||||
Селектив- ность | 24 ч/30 °С | Е. coli АТСС 25922 или 8739 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
Е. faecalis АТСС 29212 или 19433 | <100 колоний на TSA | |||||||||
Fraser | L | Listeria mono- cytogenes | EH ИСО 11290-1 | Производи- тельность | 48 ч/37 °С | L. mono 1/2a АТСС 19111 | - | Полуколи- чественный | >10 колоний на Oxford или PALCAM | Серо-черные колонии с черным ореолом |
или L. mono 4b АТСС 13932 | ||||||||||
+ E. coli ATCC 25922 или 8739 | ||||||||||
+ E. faecalis ATCC 29212 или 19433 | ||||||||||
Селектив- ность | 24-48 ч/37 °С | E. coli ATCC 25922 или 8739 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
E. faecalis ATCC 29212 или 19433 | <100 коло- ний на TSA | |||||||||
ITC | L | Yersinia ente- rocolitica | ИСО 10273 | Производи- тельность | 48 ч/25 °С | Y. enterocolitica ATCC 23715 или 9610 | - | Полуколи- чественный | <10 колоний на CIN или SSDC | Характерные колонии согласно каждой среде (см. стандарт) |
+ E. coli ATCC 25922 или 8739 | ||||||||||
+ Ps. aeruginosa ATCC 27853 | ||||||||||
Селектив- ность | 48 ч/25 °С | Ps. aeruginosa ATCC 27853 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
P. mirabilis ATCC 29906 | ||||||||||
Park & San ders | L | Campylobacter | ИСО 10272 | Производи- тельность | См. стандарт | С. coli АТСС 43478* | - | Полуколи- чественный | <10 колоний на среде Karmali или любой дру- гой среде по выбору | Характерные колонии согласно каждой среде (см. стандарт) |
или С. jejuni АТСС 33291 или 29428* | ||||||||||
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ P. mirabilis АТСС 29906 | ||||||||||
Селектив- ность | См. стандарт | + Е. coli АТСС 25922 или 8739 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
P. mirabilis АТСС 29906 | ||||||||||
Preston | L | Campylobacter | ИСО 10272 | Производи- тельность | 18ч/42 °С | С. coli АТСС 43478 | - | Полуколи- чественный | < 10 колоний на среде Karmali или любой дру- гой среде по выбору | Характерные колонии согласно каждой среде (см. стандарт) |
или С. jejuni АТСС 33291 или 29428 | ||||||||||
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ P. mirabilis АТСС 29906 | ||||||||||
Селектив- ность | 18ч/42°С | Е. coli АТСС 25922 или 8739 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
P. mirabilis АТСС 29906 | ||||||||||
PSB | L | Yersinia ente- rocolitica | ИСО 10273 | Производи- тельность | 3-5 дней/25 °С | Y. enterocolitica АТСС 23715 или 9610 | - | Полуколи- чественный | >10 колоний на CIN или SSDC | Характерные колонии согласно каждой среде (см. стандарт) |
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ Ps. aeruginosa АТСС 27853 | ||||||||||
Селектив- ность | 3-5 дней/25 °С | Ps. aeruginosa АТСС 27853 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
P. mirabilis ATCC 29906 | ||||||||||
MKTTn | L | Salmonella | ИСО 6579 | Производи- тельность | 24 ч/37 °С | S. typhimurium ATCC 14028 | - | Полуколи- чественный | >10 колоний нa XLD или другой среде по выбору | Характерные колонии согласно каждой среде (см. стандарт) |
или S. enteritidis ATCC 13076 | ||||||||||
+ E. coli ATCC 25922 или 8739 | ||||||||||
+ Ps. aeruginosa АТСС 27853 | ||||||||||
Селектив- ность | 24 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Полуколи- чественный | Полное ингибирова- ние на TSA | - | ||||
Е. faecalis АТСС 29212 или 19433 | - | - | <10 коло- | - | ||||||
Rappaport Vassiliadis | L | Salmonella | EH 12824 | Производи- тельность | 24 ч/41,5 °С | S. typhimurium АТСС 14028 | - | Полуколи- чественный | <10 колоний на BGA или другой среде по выбору | Характерные колонии согласно каждой среде (см. стандарт) |
или S. enteritidis АТСС 13076 | - | - | - | - | ||||||
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ Ps. aeruginosa АТСС 27853 | ||||||||||
Селектив- ность | 24 ч/41,5 °С | Е. coli АТСС 25922 или 8739 | Полуколи- чественный | Полное ингибирова- ние на TSA | - | |||||
Е. faecalis АТСС 29212 или 19433 | - | - | <10 коло- ний на TSA | - | ||||||
RVS | L | Salmonella | ИСО 6579 | Производи- тельность | 24 ч/41,5 °С | S. typhimurium АТСС 14028 | - | Полуколи- | >10 колоний нa XLD или другой среде по выбору | Характерные колонии согласно каждой среде (см. стандарт) |
или S. enteritidis ATCC 13076 | ||||||||||
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ Ps. aeruginosa АТСС 27853 | - | - | - | - | ||||||
Селектив- ность | 24 ч/41,5 °С | Е. coli АТСС 25922 или 8739 | - | Полуколи- | Полное ингибирова- | - | ||||
Е. faecalis АТСС 29212 или 19433 | - | - | <10 коло- | - | ||||||
Selenite- | L | Salmonella | EH 12894 | Производи- тельность | 24 ч/37 °С | S. typhimurium АТСС 14028 | - | Полуколи- | <10 колоний на BGA или другой среде по выбору | Характерные колонии согласно каждой среде (см. стандарт) |
или S. enteritidis ATCC 13076 | ||||||||||
+ Е. coli АТСС 25922 или 8739 | ||||||||||
+ Ps. aeruginosa АТСС 27853 | ||||||||||
Селектив- ность | 24 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Полуколи- | <100 колоний на TSA | - | ||||
Е. faecalis АТСС 29212 или 19433 | ||||||||||
| ||||||||||
Таблица В.4 - Обогатительные неселективные среды
Среда | Тип | Микро- | Обозначение стандарта | Функция | Инкубация | Контрольные штаммы | Эталон- | Метод контроля | Критерии | Характерная реакция |
BHI | L | Staphylococcus | ИСО 6888 | Производи- тельность | 24 ч/37 °С | S. aureus АТСС 25923 | - | Качест- | Мутность 1-2 | - |
Brucella | L | Campylobacter | ИСО 10272 | Производи- тельность | 2-5 дней/25 °С | С. coli АТСС 43478 | - | Качест- | Мутность 1-2 | - |
С. jejuni АТСС 33291 или 29428 | ||||||||||
Peptone- salt (пеп- тоновая соль) | L | Dilution liquids (разбавитель) | ИСО 6787 | Раство- ритель | 45 мин/20 °С-25 °С | Е. coli АТСС 25922 или 8739 | TSA | Количест- | +/-50% кол. к (+/-50% изначального подсчета) | - |
S. aureus АТСС 25923 | - | - | - | - | ||||||
Thioglycol- late | L | Clostridium perfringens | ИСО 3937 | Производи- тельность | 24 ч/37 °С | Cl. perfringens ATCC 13124 | - | Качест- | Мутность 1-2 | - |
TSYEB | L | Listeria mono- cytogenes | ИСО 11290 | Производи- тельность | 24 ч/25 °С | L. mono 1/2a АТСС 19111 | - | Качест- | Мутность 1-2 | - |
L. mono 4b ATCC 13932 | - | - | - | - | ||||||
| ||||||||||
Таблица В.5 - Селективные разделительные среды
Среда | Тип | Микро- | Обозначение стандарта | Функция | Инкубация | Контрольные штаммы | Эталонные среды | Метод контроля | Критерии | Характерные реакции |
Модифици- рованная среда Butzler | S | Campylobacter | ИСО 10272 | Производи- тельность | 24-72 ч/ 42 °С | С. coli АТСС 43478 | - | Качест- венный | Хороший рост (2) | Характерные колонии соглас- но каждой среде (см. стандарт) |
CCDA | - | - | - | - | - | - | - | - | - | - |
Karmali | - | - | - | - | - | С. jejuni АТСС 33291 или 29428 | - | - | - | - |
Preston | - | - | - | - | - | - | - | - | - | - |
Skirrow | - | - | - | Селектив- | 24-72 ч/42 °С | Е. coli АТСС 25922 или 8739 | - | Качест- венный | Полное или частичное ингибиро- вание (0-1) | Не обнаружи- вается никаких характерных колоний |
S. aureus АТСС 25923 | - | - | Полное ингибиро- вание (0) | - | ||||||
CIN | S | Yersinia entero- | ИСО 10273 | Производи- | 24 ч/30 °С | Y. enterocolitica АТСС 23715 или 9610 | - | Качест- венный | Хороший рост (2) | Характерные колонии соглас- но каждой среде (см. стандарт) |
SSDC | - | - | - | - | - | - | - | - | - | - |
Селектив- ность | 24 ч/30 °С | Е. coli АТСС 25922 или 8739 | - | Качест- венный | Полное или частичное ингибиро- вание (0-1) | Не обнаружи- вается никаких характерных колоний | ||||
S. aureus АТСС 25923 | - | - | Полное ингибиро- вание (0) | - | ||||||
Агар с бриллиан- товым зеленым (BGA) | S | Salmonella | EH 12824/ ИСО 6579 | Производи- тельность | 24-48 ч/37 °С | S. typhimurium АТСС 14028 | - | Качест- | Хороший рост (2) | Характерные колонии соглас- но каждой среде (см. стандарт) |
S. enteritidis АТСС 13076 | - | - | - | - | ||||||
XLD | - | - | - | Селектив- ность | 24-48 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Качест- | Полное ингиби- рование или мед- ленный рост (0-1) | Не обнаружи- вается никаких характерных колоний |
Е. faecalis АТСС 29212 или 19433 | - | - | Полное ингибиро- вание (0) | - | ||||||
| ||||||||||
Таблица В.6 - Неселективные разделительные среды
Среда | Тип | Микроорганизмы | Обозначение стандарта | Функция | Инкубация | Контрольные штаммы | Эталонные среды | Метод контроля | Критерии | Характерная реакция |
Питательный агар | S | Enterobacteria- сеае | ИСО 7402, ИСО 8523 | Производи- тельность | 24 ч/37 °С | Е. coli АТСС 25922 или 8739 | - | Качест- | Хороший рост (2) | - |
- | - | Salmonella | EH 12824, ИСО 6579 | 24 ч/37 °С | S. typhimurium АТСС 14028 | - | - | - | - | |
- | - | Yersinia enterocolitica | ИСО 10273 | 24 ч/30 °С | Y. enterocolitica АТСС 23715 или 9610 | - | - | - | - | |
Агар TSYEA | S | Listeria monocytogenes | EH ИСО 11290 | Производи- | 24 ч/37 °С | L. mono 1/2a АТСС 19111 или L. mono 4b АТСС 13932 | - | Качест- | Хороший рост (2) | - |
| ||||||||||
Библиография
[1] | EН ИСО 6887-1 | Микробиология пищевых продуктов и кормов для животных. Приготовление испытательных образцов, исходных суспензий и десятичных разведений для микробиологического исследования. Часть 1. Общие правила для подготовки исходных суспензий и десятичных разведений (ИСО 6887-1:1999) |
[2] | EH ИСО 8261 | Молоко и молочные продукты. Общие руководящие указания по приготовлению проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований (ИСО 8261:2001) |
[3] | EН ИСО 6887-2 | Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 2. Специальные правила для приготовления мяса и мясных продуктов (ИСО/FDIS 6887-2:2003) |
[4] | пр. EH ИСО 6887-3 | Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов (ИСО/FDIS 6887-3:2003) |
[5] | пр. ЕН ИСО 6887-4 | Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов (ИСО/FDIS 6887-4:2003) |
[6] | ИСО 7218:1996 | Микробиология пищевых продуктов и кормов для животных. Общие правила микробиологических исследований |
[7] | ИСО 2859-1:1999 | Процедуры выборочного контроля по альтернативному признаку. Часть 1. Планы выборочного контроля с указанием приемлемого уровня качества (AQL) для последовательного контроля партий |
[8] | Corry JEL, Curtis GDW, Baird RM, 1995, Культуральные среды для микробиологии пищевых продуктов. Лондон: Elsevier Science, Том 34 | |
[9] | Anon. 1998., Int. J. Food Microbiol. 45, 65 | |
[10] | ИСО 11133-1:2000 | Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории (ИСО/ТО 11133-1:2000) |
Электронный текст документа
и сверен по:
, 2010