ГОСТ 33486-2015
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ, КОМБИКОРМА, ОБЪЕКТЫ БИОЛОГИЧЕСКИЕ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
Метод определения содержания -адреностимуляторов с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием
Food products, mixed feeds, biological objects of animal origin. Method for determination of (-agonists by high performance liquid chromatography - mass spectrometry
МКС 65.120
67.050
67.120
Дата введения 2017-01-01
Предисловие
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 октября 2015 г. N 81-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 ноября 2015 г. N 1809-ст межгосударственный стандарт ГОСТ 33486-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2017 г.
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНЫ: поправка, опубликованная в ИУС N 7, 2017 год; поправка, опубликованная в ИУС N 4, 2020 год
Поправки внесены изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и непереработанную пищевую продукцию животного происхождения в части мяса и мякотных субпродуктов (печень, почки), в том числе птицы, комбикорма, а также биологические объекты животного происхождения в части шерсти, мочи, сетчатки глаз и устанавливает метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (далее - ВЭЖХ-МС/МС) для определения содержания -адреностимуляторов в диапазоне измерений:
- для гидроксиметилклен-бутерола, кленбутерола - от 0,1 до 50,0 мкг/кг;
- рактопамина, зилпатерола, бромбутерола, мабутерола, мапентерола, тулобутерола - от 0,1 до 100,0 мкг/кг;
- ритодрина, фенотерола, тербуталина, циматерола - от 0,5 до 50,0 мкг/кг;
- кленпентерола, кленпроперола, цимбутерола, изоксисуприна, сальбутамола - от 0,5 до 100,0 мкг/кг.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 3117-78 Реактивы. Аммоний уксуснокислый. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ ИСО 5725-6-2003* Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
_______________
* В Российской Федерации действует ГОСТ Р ИСО 5725-6-2002 "Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике".
ГОСТ ISO 6497-2014* Корма для животных. Отбор образцов
_______________
* В Российской Федерации действует ГОСТ Р ИСО 6497-2011 "Корма для животных. Отбор проб".
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 6995-77 Реактивы. Метанол-яд. Технические условия
ГОСТ 7269-79 Мясо. Методы отбора образцов и органолептические методы определения свежести
ГОСТ 9805-84 Спирт изопропиловый. Технические условия
ГОСТ 21239-93 (ИСО 7741-86) Инструменты хирургические. Ножницы. Общие требования и методы испытаний
ГОСТ 22300-76 Реактивы. Эфиры этиловый и бутиловый уксусной кислоты. Технические условия
ГОСТ 24104-2001* Весы лабораторные. Общие технические требования
_______________
* В Российской Федерации действует ГОСТ Р 53228-2008 "Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания".
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 31467-2012 Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Методы отбора проб и подготовка их к испытаниям
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Сущность метода
Количественное определение содержания -адреностимуляторов проводят методом внутреннего стандарта по площадям пиков идентифицированных соединений с помощью градуировочной характеристики высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием в режиме мониторинга выбранных реакций (MRM).
4 Требования безопасности и условия выполнения измерений
4.1 Применяемые в работе реактивы относятся к веществам 1-го и 2-го класса опасности по ГОСТ 12.1.007, при работе с ними необходимо соблюдать требования безопасности, установленные для работ с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.1.005.
4.2 Помещения, в которых проводят анализ и подготовку проб, должны быть оборудованы приточно-вытяжной вентиляцией.
4.3 Приготовление градуировочных растворов проводят под тягой в вытяжном шкафу.
4.4 К выполнению измерений методом ВЭЖХ-МС/МС допускаются лица, владеющие техникой ВЭЖХ-МС/МС и изучившие инструкции по эксплуатации применяемой аппаратуры.
4.5 При выполнении измерений соблюдают следующие условия:
- температура окружающего воздуха | от 15°С до 30°С; |
- атмосферное давление | от 84 до 106 кПа; |
- относительная влажность воздуха | от 20% до 80%. |
(Поправка. ИУС N 7-2017).
5 Средства измерений, аппаратура, материалы, посуда и реактивы
5.1 Для определения содержания -адреностимуляторов применяют следующие средства измерений, аппаратуру, посуду и материалы:
- весы специального или высокого класса точности с действительной ценой деления 0,1 мг по ГОСТ OIML R 76-1 или весы лабораторные по ГОСТ 24104 специального или высокого класса точности, с ценой поверочного деления не более 1,0 мг;
- масс-спектрометр с гибридным квадрупольным анализатором с диапазоном измерений от 5 до 1200 атомных единиц массы (а.е.м.), массовым разрешением не менее 1200, точностью измерения массы не менее 0,5 а.е.м., с режимом получения и анализа фрагментных ионов (режим МС/МС);
- рН-метр или универсальный иономер диапазоном измерения от 4 до 9 ед. рН с погрешностью измерения ±0,05 ед. рН;
- баню водяную лабораторную;
- баню ультразвуковую с рабочей частотой не менее 20 Гц и объемом не менее 1 дм;
- встряхиватель (шейкер) вибрационный для пробирок орбитального типа движения с амплитудой встряхивания 3 мм и диапазоном скоростей от 150 до 2000 об/мин;
- измельчитель-гомогенизатор лабораторный;
- камеру лабораторную морозильную с цифровым контроллером температуры и рабочим диапазоном температур от минус 30°С до минус 40°С;
- колонку хроматографическую длиной 150 мм и диаметром 2 мм с сорбентом на основе силикагеля с привитыми октадецильными группами, диаметром частиц сорбента не более 5 мкм;
- компьютер с установленным программным обеспечением для управления масс-спектрометром и обработки результатов измерений;
- модуль термостатируемый нагревательный с системой отдувки растворителей инертным газом и максимальной температурой термостатирования 250°С;
- систему высокоэффективную жидкостную хроматографическую, состоящую из бинарного насоса со смесителем, системы фильтрования и дегазации подвижных фаз, термостата хроматографической колонки, обеспечивающего температуру нагрева до (50±1)°С;
- систему получения деионизованной воды высокой чистоты с удельным сопротивлением 18 МОм·см;
- систему упаривания растворителей закрытого типа, обеспечивающую поддержание температуры до 50°С;
- устройство вакуумное для твердофазной экстракции;
- холодильник бытовой с цифровым контроллером температуры и рабочим диапазоном температур от 0°С до 5°С;
- центрифугу лабораторную рефрижераторную со скоростью вращения не менее 4000 об/мин и диапазоном температур от 4°С до 20°С;
- шкаф сушильный лабораторный с рабочим диапазоном температур от 50°С до 200°С;
- картриджи для твердофазной экстракции вместимостью не менее 15 см, заполненные 0,5 г сорбента на основе силикагеля с привитыми октиловыми и бензолсульфоновыми группами с диаметром частиц сорбента от 40 до 60 мкм;
- ножницы по ГОСТ 21239;
- пробы контрольные с установленным значением содержания определяемого -адреностимулятора;
- пробы, не содержащие -адреностимуляторов, проанализированные ранее в соответствии с требованиями раздела 7, в зависимости от типа исследуемой матрицы ("чистые" пробы).
Примечание - Срок хранения "чистых" проб при температуре от минус 20°С до минус 40°С - не более трех мес;
- фильтры нейлоновые мембранные с размером диаметра пор не более 0,2 мкм;
- виалы (флаконы) стеклянные вместимостью 2, 15 и 50 см с завинчивающимися крышками;
- колбы 1-25(100, 1000)-2 по ГОСТ 1770;
- колбы конические Кн-1-250-29/32 ТС по ГОСТ 25336;
- пипетки 2-2-1-5(10, 25) по ГОСТ 29227;
- пипетки одноканальные переменной вместимости 5-25, 20-100 и 200-1000 мм с допустимой относительной погрешностью дозирования по метанолу и ацетонитрилу не более ±1%;
- пробирки П-2-10-14/23ХС по ГОСТ 1770;
- пробирки полипропиленовые вместимостью 15 см с завинчивающимися крышками;
- цилиндры 1-25(50, 1000)-1 по ГОСТ 1770.
(Поправка. ИУС N 4-2020).
5.2 При определении содержания -адреностимуляторов применяют следующие реактивы:
- аммоний уксуснокислый по ГОСТ 3117, х.ч.;
- аммония гидроксида водный раствор с массовой долей основного вещества не менее 28%;
- ацетон по ГОСТ 2603;
- воду деионизованную для ВЭЖХ, полученную с использованием системы производства ультрачистой воды из дистиллированной воды по ГОСТ 6709;
- дигидрофосфат калия по ГОСТ 4198, ч.д.а.;
- изопропанол абсолютированный по ГОСТ 9805;
- калия гидроокись по ГОСТ 24363, х.ч.;
- кальций хлористый двухводный, ч.д.а.;
- кислоту соляную по ГОСТ 3118, х.ч.;
- кислоту уксусную по ГОСТ 61, х.ч.;
- метанол по ГОСТ 6995, х.ч.;
- натрия ацетат по ГОСТ 199, ч.д.а.;
- натрия гидроокись по ГОСТ 4328, х.ч.;
- н-гексан, х.ч.;
- протеазу из стрептомицетов Streptomyces griseus Тип XIV активностью протеазы 3,5 ед./мг;
- сок пищеварительный виноградной улитки Helix pomatia, х.ч.;
- трис(гидроксиметил)-аминометан, ч.д.а.;
- этанол абсолютный, х.ч.;
- этилацетат по ГОСТ 22300, ч.д.а.;
- эфир метил-третбутиловый для хроматографии.
5.3 При определении содержания -адреностимуляторов в качестве стандартных веществ применяют следующие
-адреностимуляторы:
5.3.1 Для приготовления исходных растворов с массовой долей основного вещества:
- бромбутерол гидрохлорид - не менее 99,8%;
- гидроксиметилкленбутерол - не менее 99,9%;
- зилпатерол - не менее 90,0%.
- изоксисуприн гидрохлорид - не менее 99,0%;
- кленбутерол гидрохлорид - не менее 99,0%;
- кленпентерол гидрохлорид - не менее 99,9%;
- кленпроперол - не менее 99,2%;
- мабутерол гидрохлорид - не менее 99,9%;
- мапентерол гидрохлорид - не менее 99,9%;
- рактопамин гидрохлорид - не менее 95,9%;
- ритодрин гидрохлорид - не менее 99,9%;
- сальбутамол - не менее 99,7%;
- тербуталин полусульфат - не менее 99,6%;
- тулобутерол гидрохлорид - не менее 99,5%;
- фенотерол гидробромид - не менее 98,0%;
- циматерол - не менее 99,9%;
- цимбутерол - не менее 99,4%.
5.3.2 Для приготовления исходных растворов внутренних стандартов с массовой долей основного вещества:
- зилпатерол-D7 - не менее 95,0%;
- кленбутерол-D9 гидрохлорид - не менее 99,9%;
- мабутерол-D9 гемифумарат - не менее 99,9%;
- мапентерол-D11 гемифумарат - не менее 99,9%;
- рактопамин-D5 гидрохлорид - не менее 99,9%;
- сальбутамол-D6 - не менее 99,9%;
- циматерол-D7 гемифумарат - не менее 99,9%;
- цимбутерол-D9 полугидрат - не менее 99,9%.
5.4 Допускается применение других средств измерений и посуды, не уступающих вышеуказанным по метрологическим и техническим характеристикам и обеспечивающих необходимую точность измерения, а также аппаратуры, реактивов и материалов по качеству не хуже вышеуказанных.
6 Подготовка к проведению измерений
6.1 Подготовка лабораторной посуды и реактивов
6.1.1 Мойку и сушку посуды проводят в отдельном помещении, оборудованном приточно-вытяжной вентиляцией. Для сушки лабораторной посуды и подготовки реактивов необходимо использовать отдельные сушильные шкафы.
6.1.2 Стеклянную посуду подвергают стандартной процедуре очистки лабораторной посуды с последующей последовательной промывкой органическими растворителями: этилацетатом (однократно), ацетоном (дважды).
6.1.3 Процедуру промывки органическими растворителями следует проводить в вытяжном шкафу. Рекомендуется на стадиях промывки использовать ультразвуковую баню. Окончательную сушку посуды проводят в сушильном шкафу, установленном в вытяжном шкафу, при температуре от 105°С до 110°С.
6.1.4 Каждую новую партию реактивов проверяют на отсутствие контаминации анализируемыми соединениями путем проведения холостого опыта в соответствии с процедурой анализа.
6.2 Приготовление растворов
6.2.1 Приготовление растворов элюентов
6.2.1.1 Подвижная фаза А
Для приготовления подвижной фазы А в мерную колбу вместимостью 1000 см приливают 1000 см
деионизованной воды, добавляют 0,77 г аммония уксуснокислого и перемешивают в ультразвуковой бане в течение 5 мин. Измеряют рН и устанавливают его значение до (4,2±0,1) концентрированной уксусной кислотой.
Срок хранения подвижной фазы А при комнатной температуре - не более 1 мес.
6.2.1.2 Подвижная фаза Б
В качестве подвижной фазы Б используют метанол.
6.2.2 Приготовление ацетатного буферного раствора молярной концентрации 0,2 моль/дм и рН 5,0
В мерную колбу вместимостью 1000 см вносят 16,4 г ацетата натрия, приливают 900 см
деионизованной воды, перемешивают. Измеряют рН, устанавливают его значение до (5,0±0,1) концентрированной уксусной кислотой и доводят объем раствора до метки деионизованной водой.
6.2.3 Приготовление фосфатного буферного раствора молярной концентрации 0,1 моль/дм и рН 5,0
В мерную колбу вместимостью 1000 см вносят 13,6 г дигидрофосфата калия, приливают 900 см
деионизованной воды, перемешивают. Измеряют рН, устанавливают его значение до (5,0±0,1) раствором гидроокиси калия и доводят объем раствора до метки деионизованной водой.
6.2.4 Приготовление фосфатного буферного раствора молярной концентрации 0,1 моль/дм и рН 6,0
В мерную колбу вместимостью 1000 см вносят 13,6 г дигидрофосфата калия, приливают 900 см
деионизованной воды, перемешивают. Измеряют рН, устанавливают его значение до (6,0±0,1) раствором гидроокиси калия и доводят объем раствора до метки деионизованной водой.
6.2.5 Приготовление раствора уксусной кислоты молярной концентрации 1 моль/дм
В мерную колбу вместимостью 1000 см вносят 900 см
деионизованной воды и 57 см
концентрированной уксусной кислоты, перемешивают, после чего доводят объем раствора до метки деионизованной водой.
6.2.6 Приготовление раствора соляной кислоты молярной концентрации 0,1 моль/дм
В мерную колбу вместимостью 100 см вносят 90 см
деионизированной воды, 0,86 см
концентрированной соляной кислоты, перемешивают и доводят объем раствора до метки деионизированной водой.
6.2.7 Приготовление раствора соляной кислоты молярной концентрации 1 моль/дм
В мерную колбу вместимостью 100 см вносят 90 см
деионизированной воды, 8,6 см
концентрированной соляной кислоты, перемешивают и доводят объем раствора до метки деионизированной водой.
6.2.8 Приготовление 25%-ного раствора соляной кислоты
В мерную колбу вместимостью 100 см вносят 44 см
деионизированной воды, затем осторожно вносят 56 см
концентрированной соляной кислоты.
6.2.9 Приготовление раствора соляной кислоты в этиловом спирте молярной концентрации 0,05 моль/дм
В мерную колбу вместимостью 100 см вносят 90 см
этилового спирта, 0,43 см
концентрированной соляной кислоты, перемешивают и доводят объем раствора до метки этиловым спиртом.
6.2.10 Приготовление трис-буферного раствора молярной концентрации 0,2 моль/дм и рН 8,2
В мерную колбу вместимостью 1000 см вносят 24,2 г трис(гидроксиметил)-аминометана и 14,7 г кальция хлорида дигидрата, приливают 900 см
деионизованной воды, перемешивают. Измеряют рН, устанавливают его значение до (8,2±0,1) раствором соляной кислоты (см. 6.2.7), после чего доводят объем раствора до метки деионизованной водой.
6.2.11 Приготовление раствора гидроокиси натрия молярной концентрации 1 моль/дм
В мерную колбу вместимостью 100 см вносят 90 см
деионизированной воды, 4 г гидроокиси натрия, перемешивают и доводят объем раствора до метки деионизированной водой.
6.2.12 Приготовление раствора гидроокиси натрия молярной концентрации 10 моль/дм
В мерную колбу вместимостью 1000 см вносят 400 г гидроокиси натрия и 600 см
деионизированной воды, перемешивают и доводят объем раствора до метки деионизированной водой.
6.2.13 Приготовление раствора гидроокиси калия молярной концентрации 1 моль/дм
В мерную колбу вместимостью 100 см вносят 90 см
деионизированной воды, 5,6 г гидроокиси калия, перемешивают и доводят объем раствора до метки деионизированной водой.
Срок хранения растворов по 6.2.2-6.2.13 при температуре от 2°С до 4°С - не более 1 мес.
6.2.14 Приготовление элюирующего раствора
В конической колбе вместимостью 100 см смешивают 97 см
этилацетата и 3 см
водного раствора гидроксида аммония. Полученный раствор встряхивают на шейкере в течение 10 мин.
Срок хранения раствора при температуре от 2°С до 4°С - не более 1 сут.
6.2.15 Приготовление раствора метанола в деионизированной воде в соотношении 50:50
В мерной колбе вместимостью 1000 см смешивают 500 см
метанола и 500 см
деионизированной воды.
Срок хранения раствора при комнатной температуре - не более 3 мес.
6.2.16 Приготовление раствора этилацетата с изопропанолом в соотношении 2:3
В мерной колбе вместимостью 100 см смешивают 40 см
этилацетата и 60 см
изопропанола.
Раствор используют свежеприготовленным.
6.3 Приготовление градуировочных растворов
6.3.1 Приготовление исходных растворов С
-адреностимуляторов
Для приготовления исходных растворов С с концентрацией 200 мкг/см
взвешивают по 5,0 мг кленпроперола, циматерола, сальбутамола, гидроксиметилкленбутерола, цимбутерола; 5,5 мг бромбутерола гидрохлорида; по 5,6 мг мапентерола гидрохлорида, мабутерола гидрохлорида, кленпентерола гидрохлорида, ритодрина гидрохлорида, зилпатерола; по 5,7 мг изоксисуприна гидрохлорида, кленбутерола гидрохлорида; по 5,8 мг тулобутерола гидрохлорида, рактопамина гидрохлорида; 6,1 мг тербуталина полусульфата; 6,5 мг фенотерола гидробромида и переносят каждое вещество по отдельности в мерные колбы вместимостью 25 см
, доводят до метки раствором метанола (см. 6.2.15), перемешивают и помещают в ультразвуковую баню на 1 мин.
Срок хранения растворов при температуре от минус 30°С до минус 40°С - не более одного года. -адреностимулятора*
_____________________
* Текст документа соответствует оригиналу. - .
Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 30 мин.
6.3.2 Приготовление рабочих растворов С, С
, С
, С
Рабочие растворы С-С
готовят в мерных пробирках вместимостью 10 см
в соответствии с рисунком 1.
Рисунок 1 - Приготовление рабочих растворов C(1)-С(4)
Рабочий раствор С | Рабочий раствор С | Рабочий раствор С | Рабочий раствор С | |||
Берут по 0,25 см | Берут 2,0 см | Берут 1,0 см | Берут 0,5 см | |||
Доводят до метки раствором метанола (см. 6.2.15), перемешивают | ||||||
Помещают в ультразвуковую баню на 1 мин |
Рисунок 1 - Приготовление рабочих растворов C-С
Растворы C-С
хранят при температуре от минус 20°С до минус 40°С. Срок хранения раствора C
- не более 3 мес, С
- не более 1 мес, С
и С
- не более двух недель.
Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 30 мин.
6.3.3 Приготовление исходных растворов D внутренних стандартов
Для приготовления исходных растворов внутренних стандартов D с концентрацией 200 мкг/см
взвешивают 5,0 мг сальбутамола-D6; 5,2 мг цимбутерола-D9 полугидрата; по 5,6 мг кленбутерола-D9 гидрохлорида, рактопамина-D5 гидрохлорида; по 5,9 мг мапентерола-D11 гемифумарата, мабутерола-D9 гемифумарата; 6,1 мг зилпатерола-D7; 6,3 мг циматерола-D7 гемифумарата и переносят каждое вещество по отдельности в мерные колбы вместимостью 25 см
. Доводят до метки раствором метанола (см. 6.2.15), перемешивают и помещают в ультразвуковую баню на 1 мин.
Срок хранения растворов при температуре от минус 30°С до минус 40°С - не более одного года.
Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 30 мин.
Внутренние стандарты для -адреностимуляторов выбирают в соответствии с таблицей 1.
Таблица 1 - Соответствие между анализируемыми -адреностимуляторами и внутренними стандартами
Наименование определяемого | Наименование внутреннего стандарта определяемого |
Сальбутамол | Сальбутамол-D6 |
Тербуталин | |
Зилпатерол | Зилпатерол-D7 |
Циматерол | Циматерол-D7 |
Цимбутерол | Цимбутерол-D9 |
Фенотерол | Рактопамин-D5 |
Ритодрин | |
Изоксисуприн | |
Рактопамин | |
Кленпроперол | Кленбутерол-D9 |
Гидроксиметилкленбутерол | |
Тулобутерол | |
Кленбутерол | |
Бромбутерол | |
Кленпентерол | |
Мабутерол | Мабутерол-D9 |
Мапентерол | Мапентерол-D11 |
6.3.4 Приготовление рабочих растворов D, D
Рабочие растворы D, D
готовят в мерных пробирках вместимостью 10 см
в соответствии с рисунком 2.
Рисунок 2 - Приготовление рабочих растворов D(1), D(2)
Рабочий раствор D | Рабочий раствор D | |
Берут по 0,1 см | Берут 1,25 см | |
Доводят до метки раствором метанола (см. 6.2.15), перемешивают | ||
Помещают в ультразвуковую баню на 1 мин |
Рисунок 2 - Приготовление рабочих растворов D, D
Растворы хранят при температуре от минус 30°С до минус 40°С.
Срок хранения раствора D - не более одного года, раствора D
- не более 3 мес.
Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 30 мин.
6.3.5 Приготовление матричных градуировочных растворов G-G
Матричные градуировочные растворы G-G
готовят в виалах или пропиленовых пробирках вместимостью 15 см
путем обработки "чистых" проб согласно разделу 7, в которые одновременно с добавлением раствора внутренних стандартов D
вносят рабочие растворы определяемых
-адреностимуляторов С
-С
в соответствии с таблицами 2-4.
6.3.5.1 Для приготовления матричных градуировочных растворов из проб мяса, субпродуктов, кормов и мочи в соответствующие гомогенизированные "чистые пробы" массой 1,0 г или объемом 1 см вносят растворы в соответствии с таблицей 2.
Таблица 2 - Приготовление матричных градуировочных растворов G-G
из проб мяса, субпродуктов, кормов и мочи
Наименование и массовая концентрация приготовляемого матричного градуировочного раствора | Вносимый объем рабочего раствора, см | |||
С | С | С | D | |
G | 0,10 | - | - | 0,02 |
G | 0,05 | - | - | 0,02 |
G | - | 0,10 | - | 0,02 |
G | - | 0,05 | - | 0,02 |
G | - | - | 0,20 | 0,02 |
G | - | - | 0,10 | 0,02 |
G | - | - | 0,02 | 0,02 |
6.3.5.2 Для приготовления матричных градуировочных растворов из проб шерсти в соответствующие гомогенизированные "чистые пробы" массой 0,5 г вносят растворы в соответствии с таблицей 3.
Таблица 3 - Приготовление матричных градуировочных растворов G-G
из проб шерсти
Наименование и массовая концентрация приготовляемого матричного градуировочного раствора | Вносимый объем рабочего раствора, см | |||
С | С | С | D | |
G | 0,05 | - | - | 0,02 |
G | 0,025 | - | - | 0,02 |
G | - | 0,05 | - | 0,02 |
G | - | 0,025 | - | 0,02 |
G | - | - | 0,10 | 0,02 |
G | - | - | 0,05 | 0,02 |
G | - | - | 0,01 | 0,02 |
6.3.5.3 Для приготовления матричных градуировочных растворов из проб сетчатки в соответствующие гомогенизированные с фосфатным буфером (см. 7.2.3.) "чистые пробы" объемом 1 см вносят растворы в соответствии с таблицей 4.
Таблица 4 - Приготовление матричных градуировочных растворов G-G
из проб сетчатки
Наименование и массовая концентрация приготовляемого матричного градуировочного раствора | Вносимый объем рабочего раствора, см | |||
С | С | С | D | |
G | 0,005 | - | - | 0,02 |
G | 0,0025 | - | - | 0,02 |
G | - | 0,005 | - | 0,02 |
G | - | 0,0025 | - | 0,02 |
G | - | - | 0,01 | 0,02 |
G | - | - | 0,005 | 0,02 |
G | - | - | 0,001 | 0,02 |
Виалы (пробирки) встряхивают в шейкере в течение 1 мин и проводят дальнейшую обработку проб в зависимости от используемой пробы согласно разделу 7.
Раствор G используют свежеприготовленным.
Срок хранения растворов G-G
при температуре от 2°С до 4°С - не более 1 сут.
7 Отбор и подготовка проб
7.1 Отбор проб
7.1.1 Отбор проб мяса - по ГОСТ 7269.
7.1.2 Отбор проб мяса птицы, печени, почек - по ГОСТ 31467.
7.1.3 Объем отбираемых проб мочи должен быть не менее 40 см.
7.1.4 Масса отбираемых проб пигментированной шерсти - не менее 10 г.
7.1.5 Отбор проб комбикормов - по ГОСТ ISO 6497.
7.1.6 Пробы, отобранные по 7.1.1 и 7.1.2, при отсутствии возможности проведения анализа в день отбора замораживают и хранят при температуре минус 25°С до проведения испытания, но не более 90 сут.
7.2 Подготовка проб
7.2.1 Подготовка проб мяса, включая мясо птицы, мясных продуктов
Мышечную ткань предварительно очищают от грубой соединительной ткани и измельчают на гомогенизаторе. Далее обработку пробы проводят в соответствии с рисунком 3.
Рисунок 3 - Подготовка проб мяса, включая мясо птицы, мясных продуктов
Взвешивают 1,00 г (результат взвешивания записывают с точностью до второго десятичного знака) гомогенизированной мышечной ткани и помещают анализируемую пробу в виалу или полипропиленовую пробирку вместимостью 15 см |
Вносят 20 мм |
Приливают 5 см |
Центрифугируют при 4000 об/мин в течение 20 мин при температуре 4°С |
Полученный экстракт очищают методом твердофазной экстракции (ТФЭ) по 7.3 |
Рисунок 3 - Подготовка проб мяса, включая мясо птицы, мясных продуктов
7.2.2 Подготовка проб субпродуктов, включая субпродукты птицы
100 г печени или почек измельчают на гомогенизаторе. Далее обработку пробы проводят в соответствии с рисунком 4.
Рисунок 4 - Подготовка проб субпродуктов, включая субпродукты птицы
Взвешивают 1,00 г (результат взвешивания записывают с точностью до второго десятичного знака) гомогенизированной ткани и помещают анализируемую пробу в виалу или полипропиленовую пробирку вместимостью 15 см |
Вносят 20 мм |
Приливают 5 см |
Гидролизат охлаждают до комнатной температуры, измеряют рН и, при необходимости, доводят его значение до (6,0±0,1) с помощью раствора гидроокиси калия (см. 6.2.13) |
Центрифугируют при 4000 об/мин в течение 20 мин при температуре 4°С |
Полученный гидролизат очищают методом твердофазной экстракции (ТФЭ) по 7.3 |
Рисунок 4 - Подготовка проб субпродуктов, включая субпродукты птицы
7.2.3 Подготовка проб сетчатки
Сетчатку отделяют от глазного яблока, далее обработку пробы проводят в соответствии с рисунком 5.
Рисунок 5 - Подготовка проб сетчатки
Сетчатку взвешивают (результат взвешивания записывают с точностью до второго десятичного знака) и помещают в виалу или полипропиленовую пробирку вместимостью 50 см |
На каждые 50 мг сетчатки приливают 1 см |
В виалу или полипропиленовую пробирку вместимостью 15 см |
Гидролизат охлаждают до комнатной температуры, измеряют рН и, при необходимости, доводят его значение до (6,0±0,1) с помощью раствора гидроокиси натрия (см. 6.2.12) |
Центрифугируют при 4000 об/мин в течение 10 мин при температуре 4°С |
Полученный гидролизат очищают методом твердофазной экстракции (ТФЭ) по 7.3 |
Рисунок 5 - Подготовка проб сетчатки
7.2.4 Подготовка проб мочи
Обработку пробы мочи проводят в соответствии с рисунком 6.
Рисунок 6 - Подготовка проб мочи
В виалу или полипропиленовую пробирку вместимостью 15 см |
Приливают 2 см |
Пипеточным дозатором вносят 20 мм |
Гидролизат охлаждают до комнатной температуры, измеряют рН и, при необходимости, доводят его значение до (6,0±0,1) с помощью раствора гидроокиси калия (см. 6.2.13) и очищают методом твердофазной экстракции (ТФЭ) по 7.3 |
Рисунок 6 - Подготовка проб мочи
7.2.5 Подготовка проб шерсти животных
7.2.5.1 Подготовка проб шерсти животных с использованием щелочного гидролиза
Пробу шерсти промывают деионизованной водой, а затем раствором соляной кислоты в этиловом спирте (см. 6.2.9), высушивают в сушильном шкафу при температуре 40°С и измельчают ножницами на отрезки размером от 1 до 2 мм, далее обработку пробы проводят в соответствии с рисунком 7.
Рисунок 7 - Подготовка проб шерсти животных с использованием щелочного гидролиза
Взвешивают 0,50 г пробы шерсти (результат взвешивания записывают с точностью до второго десятичного знака) и помещают анализируемую пробу в виалу или полипропиленовую пробирку вместимостью 50 см |
Вносят 20 мм |
Приливают 10 см |
Пробу охлаждают до комнатной температуры, добавляют 10 см |
Центрифугируют при 4000 об/мин в течение 5 мин при температуре 4°С и собирают эфирную фракцию в виалу или полипропиленовую пробирку вместимостью 50 см |
К водной фракции добавляют 10 см |
Центрифугируют при 4000 об/мин в течение 5 мин при температуре 4°С и собирают экстракт в виалу или полипропиленовую пробирку вместимостью 50 см |
Экстракты объединяют и упаривают досуха на ротационном испарителе при температуре не более 40°С |
К сухому остатку приливают 10 см |
Полученный экстракт очищают методом твердофазной экстракции (ТФЭ) по 7.3 |
Рисунок 7 - Подготовка проб шерсти животных с использованием щелочного гидролиза
7.2.5.2 Подготовка проб шерсти животных с использованием ферментного гидролиза
Пробу шерсти промывают, высушивают и измельчают ножницами по 7.2.6.1, далее обработку пробы проводят в соответствии с рисунком 8.
Рисунок 8 - Подготовка проб шерсти животных с использованием ферментного гидролиза
Взвешивают 0,50 г пробы шерсти (результат взвешивания записывают с точностью до второго десятичного знака) и помещают анализируемую пробу в виалу или полипропиленовую пробирку вместимостью 15 см |
Вносят 20 мм |
Приливают 5 см |
Гидролизат охлаждают до комнатной температуры, приливают 2 см |
Центрифугируют при 4000 об/мин в течение 20 мин при температуре 4°С |
Гидролизат переносят в виалу вместимостью 15 см |
Рисунок 8 - Подготовка проб шерсти животных с использованием ферментного гидролиза
7.2.6 Подготовка проб комбикормов
100 г комбикорма измельчают на гомогенизаторе, далее обработку пробы проводят в соответствии с рисунком 9.
Рисунок 9 - Подготовка проб комбикормов
Взвешивают 1,0 г гомогенизированной пробы и помещают анализируемую пробу в виалу или полипропиленовую пробирку вместимостью 50 см |
Вносят 20 мм |
Приливают 15 см |
Центрифугируют при 4000 об/мин течение 10 мин при температуре 4°С |
Надосадочный слой переносят в виалу или полипропиленовую пробирку вместимостью 50 см |
Измеряют рН водного остатка и, при необходимости, доводят с помощью раствора гидроокиси натрия (см. 6.2.12) его значение до (6,0±0,1) ед. рН |
Центрифугируют при 4000 об/мин течение 10 мин при температуре 4°С |
Полученный экстракт очищают методом твердофазной экстракции (ТФЭ) по 7.3 |
Рисунок 9 - Подготовка проб комбикормов
7.2.7 Приготовление "холостой пробы"
Приготовление "холостой пробы" проводят в условиях подготовки проб, где вместо матрицы используют 1,0 см деионизованной воды.
7.3 Очистка подготовленных проб методом ТФЭ
Картриджи для твердофазной экстракции кондиционируют на вакуумном устройстве для ТФЭ, пропуская последовательно 6 см метанола, 1 см
деионизованной воды, 3 см
фосфатного буферного раствора (см. 6.2.4). Затем пропускают через картридж пробу, полученную в соответствии с 7.2.1-7.2.7. Промывают картридж последовательно два раза 2 см
фосфатного буферного раствора (см. 6.2.4), 1 см
раствора уксусной кислоты (см. 6.2.5), 1,5 см
метанола и сушат в вакууме водоструйного насоса в течение 10 мин. Элюируют определяемые вещества 8 см
элюирующего раствора (см. 6.2.14) в новую виалу. Упаривают элюат досуха на системе упаривания растворителей при температуре не более 40°С. Остаток перерастворяют в 1 см
подвижной фазы А (см. 6.2.1.1), помещают в ультразвуковую баню при комнатной температуре на 1 мин, затем фильтруют через мембранный фильтр в виалу вместимостью 2 см
и используют для ВЭЖХ-МС/МС анализа.
8 Порядок выполнения анализа
8.1 Условия хроматографических измерений
8.1.1 Хромато-масс-спектрометр включают в соответствии с руководством (инструкцией) по эксплуатации и устанавливают параметры, рекомендуемые изготовителем хроматографических колонок. Например, для колонки диаметром 2 мм, длиной 150 мм, с обращенно-фазным сорбентом С18 с размером частиц 5,0 мкм, применяют следующие хроматографические условия:
- температура колонки - 40°С
- скорость потока подвижной фазы - 0,2 см/мин
- объем вводимой пробы - 50 мм.
8.1.2 Разделение проводят в режиме градиентного элюирования (приготовление растворов элюентов по 6.2.1) в соответствии с таблицей 5.
Таблица 5 - Условия хроматографического разделения
Время, мин | Подвижная фаза А, % | Подвижная фаза Б, % |
0,0 | 95 | 5 |
35,0 | 10 | 90 |
35,1 | 95 | 5 |
45,0 | 95 | 5 |
8.1.3 Параметры воздействия на ионы в режиме мониторинга нескольких реакций (MRM) приведены в таблице 6.
Таблица 6 - Параметры воздействия на ионы в режиме MRM и условиях электрораспыления с регистрацией положительных ионов
| Ион-предшественник, mlz | Ион-продукт, mlz | Потенциал декластеризации, В | Энергия соударений, эВ | Ускоряющее напряжение на выходе из ячейки столкновений, В |
Циматерол-D7* | 227,4 | 209,4 | 40 | 15,7 | 12,6 |
Циматерол-D7* | 227,4 | 161,3 | 40 | 25,3 | 8,9 |
Циматерол | 220,3 | 202,3 | 38 | 13,9 | 11,9 |
Циматерол | 220,3 | 160,2 | 38 | 23,2 | 9,0 |
Тербуталин | 226,3 | 152,3 | 53 | 22,6 | 8,0 |
Тербуталин | 226,3 | 125,3 | 53 | 33,4 | 6,2 |
Сальбутамол-D6* | 246,3 | 228,4 | 58 | 16 | 14,0 |
Сальбутамол-D6* | 246,3 | 148,3 | 58 | 26,7 | 8,0 |
Сальбутамол | 240,4 | 222,3 | 49 | 15,4 | 13,3 |
Сальбутамол | 240,4 | 148,3 | 49 | 26,3 | 8,0 |
Зилпатерол | 262,1 | 244,3 | 60 | 19,2 | 15,3 |
Зилпатерол | 262,1 | 185,1 | 60 | 33 | 10,6 |
Зилпатерол-D7* | 269,2 | 251,2 | 60 | 20 | 17,0 |
Зилпатерол-D7* | 269,2 | 185,2 | 60 | 39 | 25,0 |
Цимбутерол-D9* | 243,4 | 225,4 | 49 | 14,7 | 14,0 |
Цимбутерол-D9* | 243,4 | 161,4 | 49 | 21,3 | 9,0 |
Цимбутерол | 234,3 | 216,3 | 36 | 14 | 13,0 |
Цимбутерол | 234,3 | 160,3 | 36 | 20,9 | 8,8 |
Фенотерол | 304,2 | 107,1 | 63 | 42,8 | 14,0 |
Фенотерол | 304,2 | 135,1 | 63 | 26 | 15,7 |
Ритодрин | 288,1 | 121,1 | 59 | 31,3 | 15,0 |
Ритодрин | 288,1 | 270,1 | 59 | 18,6 | 25,0 |
Гидроксиметил- | 293,2 | 275,3 | 43 | 18 | 27,6 |
Гидроксиметил- | 293,2 | 203,2 | 43 | 26 | 12,4 |
Кленпроперол | 263,0 | 245,2 | 48 | 15,7 | 15,5 |
Кленпроперол | 263,0 | 203,2 | 48 | 26,8 | 12,0 |
Рактопамин-D5* | 307,1 | 289,3 | 51 | 17,4 | 19,1 |
Рактопамин-D5* | 307,1 | 167,4 | 51 | 23,9 | 9,2 |
Рактопамин | 302,2 | 284,4 | 59 | 16,0 | 18,4 |
Рактопамин | 302,2 | 121,3 | 59 | 33,0 | 20,0 |
Рактопамин | 302,2 | 164,2 | 59 | 22,9 | 9,0 |
Кленбутерол-D9* | 286,1 | 268,4 | 50 | 16,5 | 16,8 |
Кленбутерол-D9* | 286,1 | 204,3 | 50 | 24,0 | 12,0 |
Кленбутерол | 277,0 | 259,3 | 56 | 16,0 | 16,2 |
Кленбутерол | 277,0 | 203,3 | 56 | 23,5 | 11,8 |
Тулобутерол | 228,3 | 154,3 | 52 | 22,3 | 8,3 |
Тулобутерол | 228,3 | 119,3 | 52 | 42,0 | 5,8 |
Бромбутерол | 367,0 | 349,2 | 56 | 16,8 | 23,2 |
Бромбутерол | 367,0 | 293,0 | 56 | 26,8 | 17,8 |
Мабутерол-D9* | 320,2 | 302,3 | 59 | 17,2 | 19,4 |
Мабутерол-D9* | 320,2 | 238,2 | 59 | 25,9 | 14,2 |
Мабутерол | 311,2 | 293,3 | 49 | 16,8 | 19,0 |
Мабутерол | 311,2 | 237,3 | 49 | 23,8 | 14,4 |
Кленпентерол | 290,9 | 203,1 | 50 | 22,6 | 18,0 |
Кленпентерол | 290,9 | 273,1 | 50 | 15,3 | 26,0 |
Мапентерол-D11* | 336,2 | 318,2 | 56 | 17,4 | 21,7 |
Мапентерол-D11* | 336,2 | 238,2 | 56 | 25,3 | 14,0 |
Мапентерол | 325,1 | 237,2 | 53 | 23,4 | 14,3 |
Мапентерол | 325,1 | 217,2 | 53 | 36,3 | 12,7 |
Изоксисуприн | 302,1 | 284,2 | 58 | 20,0 | 25,0 |
Изоксисуприн | 302,1 | 150,1 | 58 | 30,6 | 18,0 |
* Внутренний стандарт. |
Примечание - Приведенные параметры хроматографического разделения и масс-спектрометрического детектирования могут отличаться в зависимости от используемого оборудования.
8.1.4 Параметры источника ионизации и квадрупольного анализатора:
- напряжение на распыляющем капилляре (IS) 5500 В при регистрации положительных ионов;
- разрешение квадруполей Q1/Q3 - единичное;
- давление газа для фрагментации (CAD) - 41 кПа.
8.1.5 Контроль чувствительности хромато-масс-спектрометра осуществляют введением 50 мм градуировочного раствора G
(см. 6.3.5) в инжектор хроматографа. Полученное соотношение сигнал/шум для каждого
-адреностимулятора должно быть не менее 10.
8.2 Построение градуировочной характеристики
Построение и расчет градуировочной характеристики проводят в каждой серии анализов с помощью программного обеспечения хромато-масс-спектрометра.
8.2.1 Проводят измерения не менее трех градуировочных растворов, приготовленных по 6.3.5, в порядке возрастания их концентраций. Каждый градуировочный раствор измеряют два раза.
8.2.2 Вычисление площади пика проводят для каждого иона-продукта анализируемых -адреностимуляторов и их внутренних стандартов. Допускается проведение количественных измерений по одному, наиболее интенсивному, иону-продукту. Для подтверждения наличия
-адреностимуляторов рассчитывают отношения площади пика двух ионов-продуктов для каждого соединения в градуировочном растворе.
8.2.3 При построении градуировочной характеристики используют линейную регрессию вида y=ax, при этом коэффициент корреляции должен быть не менее 0,98.
8.2.4 Построение линейного градуировочного графика и расчет концентрации -адреностимуляторов в анализируемых пробах выполняется системой обработки данных в автоматическом режиме.
8.3 ВЭЖХ-МС/МС измерение
8.3.1 Для определения содержания -адреностимуляторов проводят ВЭЖХ-МС/МС измерение в соответствии с руководством (инструкцией) по эксплуатации применяемого оборудования.
8.3.2 ВЭЖХ-МС/МС анализ выполняют в виде серии измерений, включающей следующие образцы:
- образец подвижной фазы А;
- "холостую пробу" (см. 7.2.8);
- "чистую пробу";
- градуировочные растворы (см. 6.3.5);
- экстракты анализируемых проб, приготовленных по 7.2.
8.3.3 В инжектор хроматографа вводят 50 мм пробы, подготовленной по разделу 7, и проводят измерения.
8.3.4. Определяют и регистрируют на хроматограмме время удерживания пиков двух ионов-продуктов каждого -адреностимулятора, соответствующее времени удерживания, найденному при измерении градуировочных растворов по 8.1.1.
8.3.5 Отклонения относительных ионных интенсивностей в анализируемой пробе от относительных ионных интенсивностей, полученных при анализе градуировочных растворов, не должны превышать значений, указанных в таблице 7.
Таблица 7 - Допустимые отклонения относительных ионных интенсивностей
Относительная ионная интенсивность, % от основного пика | Максимально допустимые отклонения для ВЭЖХ-МС/МС детектирования, % |
Св. 50 | ±20 |
Св. 20 до 50 включ. | ±25 |
Св. 10 до 20 включ. | ±30 |
Менее 10 включ. | ±50 |
9 Обработка результатов измерений
9.1 В соответствии с данными, полученными при анализе градуировочных растворов, проводят количественную обработку хроматограмм с использованием программного обеспечения, получая значения концентрации -адреностимуляторов в анализируемой пробе.
9.2 Содержание i-го -адреностимулятора
, мкг/кг, вычисляют по формуле
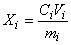 , (1)
, (1)
где - концентрация
-адреностимулятора в анализируемой пробе, найденная по градуировочному графику, нг/см
;
- объем, до которого разбавлена проба, см
;
- масса анализируемой пробы, г.
9.3 За окончательный результат содержания -адреностимуляторов принимают среднеарифметическое значение результатов вычислений двух параллельных измерений, выполненных в условиях повторяемости, округленное до первого десятичного знака и выраженное в микрограммах на килограмм (мкг/кг).
10 Метрологические характеристики
Установленный в настоящем стандарте метод обеспечивает выполнение измерений содержания -адреностимуляторов с расширенной неопределенностью результатов аналитических измерений при коэффициенте охвата k=2, указанной в таблице 8.
Таблица 8 - Показатели точности методики при проведении измерений содержания -адреностимуляторов
| Диапазон измерений содержания | Значение относительной расширенной неопределенности, U | Предел повторяемости, r, % (при Р =0,95, n =2) |
Бромбутерол | От 0,10 до 0,5 включ. | 40 | 11 |
Св. 0,5 до 100,0 включ. | 25 | 20 | |
Гидроксиметил- | От 0,10 до 0,50 включ. | 35 | 17 |
Св. 0,50 до 50,0 включ. | 27 | 14 | |
Зилпатерол | От 0,10 до 0,5 включ. | 30 | 20 |
Св. 0,50 до 5,0 включ. | 24 | 14 | |
Св. 5,0 до 10,0 включ. | 14 | 7 | |
Св. 10,0 до 100,0 включ. | 11 | 7 | |
Изоксисуприн | От 0,50 до 1,00 включ. | 36 | 14 |
Св. 1,00 до 10,0 включ. | 27 | 17 | |
Св. 10,0 до 100,0 включ. | 20 | 11 | |
Кленбутерол | От 0,10 до 0,50 включ. | 67 | 11 |
Св. 0,50 до 5,0 включ. | 46 | 8 | |
Св. 5,0 до 10,0 включ. | 37 | 11 | |
Св. 10,0 до 50,0 включ. | 11 | 7 | |
Кленпентерол | От 0,50 до 100,0 включ. | 28 | 20 |
Кленпроперол | От 0,5 до 5,0 включ. | 40 | 14 |
Св. 5 до 100 включ. | 25 | 20 | |
Мабутерол | От 0,10 до 0,50 включ. | 45 | 14 |
Св. 0,50 до 10,0 включ. | 28 | 11 | |
Св. 10,0 до 100 включ. | 18 | 11 | |
Мапентерол | От 0,10 до 5,00 включ. | 25 | 11 |
Св. 5,00 до 100 включ. | 20 | 14 | |
Рактопамин | От 0,10 до 0,50 включ. | 30 | 11 |
Св. 0,50 до 10,0 | 18 | 11 | |
Св. 10,0 до 100,0 включ. | 10 | 7 | |
Ритодрин | От 0,50 до 1,0 включ. | 50 | 25 |
Св. 1,0 до 10 включ. | 30 | 20 | |
Св. 10 до 50 включ. | 18 | 11 | |
Сальбутамол | От 0,50 до 5,00 включ. | 35 | 8 |
Св. 5,00 до 100 включ. | 20 | 14 | |
Тербуталин | От 0,50 до 50 включ. | 50 | 36 |
Тулобутерол | От 0,10 до 100 включ. | 24 | 17 |
Фенотерол | От 0,50 до 50 включ. | 36 | 25 |
Циматерол | От 0,5 до 5 включ. | 20 | 14 |
Св. 5 до 50,0 включ. | 11 | 8 | |
Цимбутерол | От 0,50 до 1,00 включ. | 28 | 20 |
Св. 1,00 до 10,0 включ. | 17 | 7 | |
Св. 10,0 до 100 включ. | 12 | 8 |
11 Оформление результатов измерений
Содержание i-го -адреностимулятора, мкг/кг, представляют в виде:
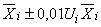 , (2)
, (2)
где - среднеарифметическое значение вычислений двух параллельных измерений содержания i-го
-адреностимулятора в анализируемой пробе по 9.2, мкг/кг;
- значение относительной расширенной неопределенности содержания i-го
-адреностимулятора для соответствующего диапазона измерений, % (в соответствии с таблицей 8).
12 Контроль правильности результатов измерений
12.1 Для соблюдения требований настоящего стандарта рекомендуется в ходе анализа каждой серии проб проводить анализ контрольных проб с установленным значением содержания определяемого -адреностимулятора с использованием стандартной процедуры подготовки проб (см. раздел 7).
12.2 Результаты измерений признают удовлетворительными при выполнении следующего неравенства:
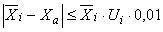 , (3)
, (3)
где - среднеарифметическое значение содержания i-го определяемого
-адреностимулятора в анализируемой пробе, мкг/кг;
- установленное значение содержания определяемого
-адреностимулятора в контрольной пробе, мкг/кг;
- значение относительной расширенной неопределенности содержания определяемого
-адреностимулятора для соответствующего диапазона измерений, % (в соответствии с таблицей 6).
12.3 Контроль стабильности результатов измерений в лаборатории при реализации методики осуществляют по ГОСТ ИСО 5725-6, используя контроль стабильности стандартного отклонения промежуточной прецизионности рутинного анализа с изменяющимися факторами "время" и "оператор" с использованием контрольных карт Шухарта.
УДК 637,638:614.3:006.354 | МКС | 65.120 | |
67.050 | |||
67.120 | |||
Ключевые слова: пищевые продукты, биологический материал животного происхождения, комбикорма, |
Редакция документа с учетом
изменений и дополнений подготовлена

