ГОСТ Р 55576-2013
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
КОРМА И КОРМОВЫЕ ДОБАВКИ
Метод качественного определения регуляторных последовательностей в геноме сои и кукурузы
Feed and feed additives. Method for determining quality of regulatory sequences in the genomes of soybean and corn
ОКС 65120*
________________
* Вероятно, ошибка оригинала. Следует читать: 65.120,
здесь и далее. - .
Дата введения 2015-07-01
Предисловие
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 454 "Охрана жизни и здоровья животных и ветеринарно-санитарная безопасность продуктов животного происхождения и кормов"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 06 сентября 2013 г. N 851-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие Приказом Федерального агентства по техническому регулированию и метрологии от 17.10.2016 N 1416-ст c 01.07.2017
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 1, 2017 год
1 Область применения
1 Область применения
Настоящий стандарт распространяется на корма, кормовые добавки и сырье для их производства и устанавливает скрининговый метод качественного определения регуляторных последовательностей в геноме генетически модифицированной сои (далее - ГМ сои) и генетически модифицированной кукурузы (далее - ГМ кукурузы) методом полимеразной цепной реакции (далее - ПЦР) с гибридизационно-флюоресцентной детекцией в режиме реального времени (Real Time PCR).
(Измененная редакция, Изм. N 1).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 5962-2013 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ ISO 6497-2014 Корма. Отбор проб
ГОСТ ISO 7218-2015 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 31719-2012 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р 51848-2001 Продукция комбикормовая. Термины и определения
ГОСТ Р 52173-2003 Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
(Измененная редакция, Изм. N 1).
3 Термины и определения
3.1 В настоящем стандарте приведены термины по ГОСТ Р 51848, а также следующие термины с соответствующими определениями:
3.1.1
генетически модифицированный организм: Организм или несколько организмов, любые неклеточные, одноклеточные или многоклеточные образования, способные к воспроизводству или передаче наследственного генетического материала, отличные от природных организмов, полученные с применением методов генной инженерии и содержащие генно-инженерный материал, в том числе гены, их фрагменты или комбинацию генов. |
3.1.2 генетически модифицированные источники; ГМИ: Корма, кормовые добавки и сырье для их производства, полученные из генетически модифицированных организмов, используемые в натуральном или переработанном виде в пищу животным.
3.1.3
полимеразная цепная реакция; ПЦР: Циклический ферментативный процесс, результатом которого является получение многочисленных копий определенного участка молекулы ДНК. |
3.1.4
полимеразная цепная реакция в режиме реального времени: Полимеразная цепная реакция, проводимая по специальной технологии, которая позволяет регистрировать накопление ПЦР-продуктов в процессе амплификации. |
3.1.5
амплификация: Образование дополнительных копий хромосомных последовательностей дезоксирибонуклеиновой кислоты ДНК. |
3.1.6 промотор: Последовательность нуклеотидов в молекуле ДНК, ответственная за начало транскрипции.
3.1.7 терминатор: Последовательность нуклеотидов в молекуле ДНК, ответственная за прекращение транскрипции.
3.1.8 рекомбинантная ДНК: Молекула ДНК, полученная в результате объединения in vitro чужеродных (в природе никогда вместе не существующих) фрагментов ДНК с использованием методов генной инженерии.
3.1.9 праймеры: Искусственно синтезируемые короткие последовательности нуклеотидов, комплементарные определенному участку искомой ДНК, используемые в полимеразной цепной реакции.
3.1.10 генетическая конструкция: Генно-инженерная последовательность ДНК, вносимая в геном растения, представляющая один или несколько генов, маркерные гены и регуляторные последовательности (промотор и терминатор).
3.2 В настоящем стандарте использованы следующие сокращения:
НК - нуклеиновые кислоты;
ОКО - отрицательный контрольный образец;
ОК - отрицательный контроль.
4 Условия выполнения испытаний и требования безопасности
4.1 Условия выполнения испытаний
4.1.1 Общие требования к помещениям - по ГОСТ ISO 7218, [1] и в соответствии с приложением А.
4.1.2 Требования к персоналу - по ГОСТ ISO 7218, ГОСТ ИСО/МЭК 17025.
4.1.2.1 Персонал должен быть обучен работе методом ПЦР и ознакомлен с правилами проведения работ в ПЦР-лабораториях.
4.1.2.2 Персонал должен быть обеспечен лабораторной одеждой для каждой зоны ПЦР-лаборатории. Первичную обработку и подготовку проб проводят в специально предназначенной для этого лабораторной одежде, используя новые перчатки для каждой пробы (исключают использование перчаток, обсыпанных пудрой, в том числе кукурузным крахмалом).
4.2 Требования безопасности
4.2.1 При выполнении всех работ необходимо соблюдать требования техники безопасности при работе с химическими реактивами в соответствии с ГОСТ 12.1.007.
4.2.2 Помещение должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021. Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
4.2.3 При работе с электроустановками требования к безопасности должны соответствовать ГОСТ Р 12.1.019.
4.2.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и быть оснащено средствами пожаротушения по ГОСТ 12.4.009.
5 Оборудование, материалы, реагенты
5.1 Требования к оборудованию - по ГОСТ ИСО/МЭК 17025.
5.2 При проведении испытаний применяют оборудование и материалы по ГОСТ 31719, а также следующие реагенты:
- комплект реагентов для выделения ДНК*:
_______________
* Данный комплект реагентов является рекомендуемым и приведен для удобства пользователей настоящего стандарта.
буфер для лизирующего реагента, содержащий гуанидин хлорид, 1мМ Трис-HCI, 12мМ ЭДТА;
лизирующий реагент: протеиназа К;
раствор для отмывки 1: гуанидин тиоционат, 1мМ Трис-HCI, 12мМ ЭДТА;
раствор для отмывки 2: 50%-ный этиловый спирт;
сорбент универсальный: диоксид кремния с примесями оксидов алюминия, кальция, железа, натрия и калия, HCI;
буфер для элюции ДНК: ТЕ-буфер с рН 8,0 ед.рН;
- ПЦР-комплект для выявления ДНК генетически модифицированной сои:
ПЦР-смесь-1: смесь специфичных праймеров и флуоресцентных зондов согласно таблице, 0,4-0,6мМ дНТФ, кратность смеси 2,5х;
ПЦР-буфер: 0,3М Трис-HCI (рН 8,3 ед.рН), 30-180мМ 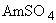 , 10-25мМ
, 10-25мМ 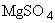 , глицерин;
, глицерин;
полимераза (TaqF): полимераза (TaqF) химически модифицированная для обеспечения горячего старта;
положительный контрольный образец (ПКО ГМ соя), состоящий из участков последовательности регуляторных конструкций и содержащий места посадки праймеров и флуоресцентных зондов ПЦР-смеси-1. Положительный контроль ПЦР должен давать положительный сигнал по всем используемым каналам флуоресцентной детекции;
отрицательный контрольный образец (ОКО): ТЕ-буфер для элюции ДНК. Отрицательный контроль экстракции не должен давать положительный сигнал по всем используемым каналам флуоресцентной детекции;
- "ПЦР-комплект" для выявления ДНК генетически модифицированной кукурузы:
ПЦР-смесь-1: смесь специфичных праймеров и флуоресцентных зондов согласно таблице, 0,4-0,6мМ дНТФ, кратность смеси 2,5х;
ПЦР-буфер: 0,3М Трис-HCI (рН 8,3 ед.рН), 30-180мМ 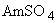 , 10-25 мМ
, 10-25 мМ 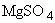 , глицерин;
, глицерин;
полимераза (TaqF): полимераза (TaqF) химически модифицированная для обеспечения горячего старта;
положительный контрольный образец (ПКО ГМ кукуруза), состоящий из участков последовательности регуляторных конструкций и содержащий места посадки праймеров и флуоресцентных зондов ПЦР-смеси-1. Положительный контроль ПЦР должен давать положительный сигнал по всем используемым каналам флуоресцентной детекции;
отрицательный контрольный образец (ОКО): ТЕ-буфер для элюции ДНК. Отрицательный контроль экстракции не должен давать положительный сигнал по всем используемым каналам флуоресцентной детекции.
(Измененная редакция, Изм. N 1).
5.3 Допускается использование другого оборудования с метрологическими характеристиками, а также материалов с техническими характеристиками не хуже указанных выше.
6 Сущность метода
Сущность скринингового метода качественного определения регуляторных последовательностей в геноме ГМ сои и ГМ кукурузы методом ПЦР с гибридизационно-флюоресцентной детекцией в режиме реального времени (Real Time PCR) заключается в проведении нескольких ПЦР в одной пробирке с использованием специфичных праймеров и зондов, меченных флюоресцентными красителями с целью выявления последовательности ДНК-мишеней, специфичных для ГМИ, и амплификацией эндогенного контроля специфичного для сои или кукурузы.
7 Отбор проб
7.1 При отборе и подготовке проб для испытаний необходимо соблюдать меры, предупреждающие их обсеменение из внешней среды.
7.2 Отобранная проба должна быть репрезентативной.
7.3 Каждую пробу отбирают набором стерильных инструментов (одноразовые или фламбированные, выдержанные в 96%-ном этиловом спирте по ГОСТ 5962 и обожженные в пламени газовой горелки) или стерильной перчаткой с удлиненной крагой.
(Измененная редакция, Изм. N 1).
7.4 Пробы комбикорма для животных и племенной птицы, сухие корма для непродуктивных животных, а также соевую муку-сырье, шрот, концентрат соевого белка и продукты, изготовленные из сои, кукурузы и продукты ее переработки, находящиеся в мешках или небольших насыпях на складе, отбирают по ГОСТ ISO 6497.
(Измененная редакция, Изм. N 1).
7.5 Отбор проб консервированных кормов для непродуктивных животных, расфасованных в жестяную, стеклянную или пластиковую тару
7.5.1 От партии до 500 шт. отбирают 3% общего количества в партии, но не менее 5 шт.
7.5.2 От партии свыше 500 шт. - 2% общего количества в партии.
7.6 Отбор проб от партии корма, кормовой добавки или сырья для их производства
7.6.1 Отбор проб от каждой новой партии проводят с использованием одноразовых перчаток.
7.6.2 От испытуемой партии отбирают из различных мест не менее 10 точечных проб массой 200 г в чистый полиэтиленовый пакет и перемешивают, формируя объединенную пробу массой 2 кг.
7.6.2.1 Из объединенной пробы отбирают лабораторную пробу массой 200 г и делят ее на две равные части. Одну часть помещают в чистый герметичный пакет из полиэтилена, опечатывают и отправляют на испытание, вторую половину лабораторной пробы помещают в чистый сухой флакон с притертой крышкой или герметичный пакет из полиэтилена, опечатывают и хранят не менее одного месяца.
7.6.3 От каждой партии сухих и консервированных кормов в упаковке производителя на испытание направляют упаковки массой:
- до 200 г - 3 шт.;
- от 200 г до 1500 г - 2 шт.;
- от 1,5 кг до 10 кг - 1 шт.;
- более 10 кг - пробы отбирают в соответствии с 7.5 и 7.6.
7.7 Условия хранения
Лабораторные пробы хранят согласно условиям, указанным производителем. Скоропортящиеся пробы хранят в замороженном состоянии при температуре не выше минус 16°С.
7.8 Условия транспортирования
Транспортирование осуществляют при температуре, рекомендованной для хранения производителем.
8 Подготовка анализируемой пробы
8.1 Каждую анализируемую пробу подготавливают в одноразовых перчатках.
8.2 Для подготовки анализируемых проб используют ступки и пестики, предварительно обработанные хромовой смесью, и инструменты, выдержанные в 96%-ном этиловом спирте и обожженные в пламени газовой горелки.
8.3 От лабораторной пробы отбирают в ступку 5-10 г сухого гранулированного или консервированного корма. Гранулированный или консервированный корм растирают пестиком до гомогенного состояния.
8.4 Гомогенат массой от 10 до 30 мг переносят в одноразовую полипропиленовую микропробирку вместимостью 1,5 см и направляют для выделения ДНК.
8.5 После отбора анализируемой пробы рабочую поверхность обрабатывают дезинфицирующим раствором, дистиллированной водой и подвергают ультрафиолетовому излучению в течение 15 мин.
9 Экстракция ДНК
9.1 Экстракцию ДНК проводят по ГОСТ Р 52173 или по 9.2 с использованием комплекта реагентов для выделения ДНК по 5.2.
9.2 Буфер для лизирующего реагента и раствор для отмывки 1 (если они хранились при температуре от 2°С до 8°С) прогревают при температуре 64°С до полного растворения кристаллов.
Пробирки с анализируемыми пробами ставят в штатив и добавляют еще одну пробирку для отрицательного контроля выделения (на каждые 10 проб не менее одного отрицательного контроля выделения). В пробирку отрицательного контроля выделения (ОК) вносят 100 мм ОКО.
Наконечниками с аэрозольным барьером вносят в каждую пробирку по 400 мм буфера для лизирующего реагента и по 17 мм
лизирующего реагента. Тщательно перемешивают содержимое пробирок на встряхивателе.
Пробирки инкубируют в термостате при температуре 64°С в течение 1 ч, периодически встряхивая на встряхивателе (пять раз через каждые 10-12 мин).
Нерастворенные частицы анализируемой пробы осаждают центрифугированием при 12-14 тыс. об/мин в течение 5 мин.
Надосадочную жидкость в объеме 200-350 мм очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отбирают отдельными наконечниками с аэрозольными барьерами и переносят в новые пробирки.
Пробирки с надосадочной жидкостью прогревают в течение 5 мин в термостате при температуре 64°С, перемешивают и центрифугируют в течение 5 с при 5 тыс. об/мин на микроцентрифуге для сброса капель с крышки пробирки.
В каждую пробирку отдельным наконечником добавляют по 25 мм сорбента, предварительно ресуспендированного на встряхивателе. Перемешивают на встряхивателе и инкубируют при комнатной температуре в течение 10-15 мин, перемешивая через каждые 2 мин. Сорбент осаждают центрифугированием при 5 тыс. об/мин в течение 30 с. Надосадочную жидкость удаляют, используя вакуумный отсасыватель с колбой-ловушкой и отдельный наконечник для каждой пробы.
В пробирки добавляют по 300 мм раствора для отмывки 1. Перемешивают на встряхивателе до полного ресуспензирования сорбента. Сорбент осаждают центрифугированием при 5 тыс. об/мин на микроцентрифуге в течение 30 с. Удаляют надосадочную жидкость, используя вакуумный отсасыватель с колбой-ловушкой и отдельный наконечник для каждой пробы.
Процедуру отмывки повторяют дважды, используя по 500 мм раствора для отмывки 2, и центрифугируют в течение 30 с при 10 тыс. об/мин на микроцентрифуге, удаляют надосадочную жидкость полностью.
Пробирки с отмытым сорбентом помещают в термостат при температуре 64°С на 5-10 мин для подсушивания сорбента. При этом крышки пробирок должны быть открыты.
В пробирки добавляют по 50 мм ТЕ-буфера для элюции ДНК и перемешивают на встряхивателе. Помещают в термостат при температуре 64°С на 5-8 мин и периодически (один раз в минуту) встряхивают на встряхивателе.
Пробирки центрифугируют при 12-16 тыс. об/мин на микроцентрифуге в течение 1 мин.
Надосадочная жидкость содержит очищенную ДНК, которую затем используют для постановки ПЦР и проведения амплификации в соответствии с разделом 10.
10 Постановка ПЦР и проведение амплификации с гибридизационно-флюоресцентной детекцией в режиме реального времени (Real Time PCR)
_______________
* Слова "Real Time PCR" в наименовании раздела 10 в бумажном оригинале выделены курсивом. - .
10.1 Для выявления ГМ сои и ГМ кукурузы методом Real Time PCR используют "ПЦР-комплект" по 5.2.
10.1.1 Постановка ПЦР
Размораживают необходимое количество пробирок с ПЦР-смесью-1 (ГМ соя/ГМ кукуруза). Перемешивают на встряхивателе и сбрасывают капли с помощью кратковременного центрифугирования в течение 1-3 с.
Для проведения одной реакции в пробирку вносят 10 мм ПЦР-смеси-1, 5 мм
ПЦР-буфера и 0,5 мм
полимеразы (TaqF). Смесь перемешивают на встряхивателе, осаждая кратковременным центрифугированием, затем вносят по 15 мм
смеси в микропробирки вместимостью 0,2 см
. Используя наконечник с аэрозольным барьером, в подготовленные пробирки добавляют по 10 мм
ДНК испытуемых образцов, избегая попадания универсального сорбента в реакционную смесь.
Ставят контрольные реакции амплификации:
- отрицательный контрольный образец (К-) - вместо ДНК-пробы вносят в пробирку 10 мм ТЕ-буфера;
- положительный контрольный образец (К+) - вносят в пробирку 0,01 см ПКО ГМ соя/ПКО ГМ кукуруза.
Общий объем реакции - 25 мм, объем ДНК-пробы - 10 мм
.
(Измененная редакция, Изм. N 1).
10.1.2 Проведение амплификации и детекции флюоресцентного сигнала
Программа амплификации:
- денатурация первичная 95°С - 15 мин;
- циклирование 95°С - 10 с, 59°С - 60 с.
Цикл повторяют 40 раз.
Флюоресценцию для определения ГМ сои измеряют при температуре 59°С на запрограммированных на приборе каналах FAM/Green, JOE/Yellow, ROX/Orange, Cy5/Red согласно инструкции по эксплуатации.
Флюоресценцию для определения ГМ кукурузы измеряют при температуре 59°С на запрограммированных на приборе каналах FAM/Green, JOE/Yellow, ROX/Orange прибора согласно инструкции по эксплуатации.
10.2 Анализ результатов амплификации
10.2.1 Режим анализа результатов амплификации приведен в таблице 1.
Таблица 1
Прог- | FAM/Green | JOE/Yellow | ROX/Orange | Cy5/Red | ||||||||
Коррек- | Устра- | Порог | Коррек- | Устра- | Порог | Коррек- | Устра- | Порог | Коррек- | Устра- | Порог | |
ГМ соя | 35S | Эндогенный контроль соя | NOS | FMV | ||||||||
+ | 10% | 0,05 | + | 10% | 0,2 | + | 10% | 0,05 | + | 10% | 0,05 | |
ГМ кукуруза | 35S | Эндогенный контроль кукуруза | NOS | - | ||||||||
+ | 10% | 0,05 | + | 10% | 0,05 | + | 10% | 0,05 | ||||
Примечание - На всех каналах, за исключением Cy5/Red, следует исключить циклы до десятого. |
Полученные в ходе испытания данные - кривые накопления флюоресцентного сигнала - анализируют по нескольким каналам детекции с помощью программного обеспечения прибора.
10.2.2 Результаты интерпретируют на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на соответствующем уровне пороговой линией на графике зависимости интенсивности флюоресценции от количества циклов, что соответствует значениям порогового цикла "Ct".
Учет результатов испытания следует начинать с результатов амплификации ДНК контрольных образцов.
Для положительного контроля амплификации по каналам FAM/Green, JOE/Yellow, ROX/Orange и Cy5/Red для ГМ сои и по каналам FAM/Green, JOE/Yellow, ROX/Orange для ГМ кукурузы должны присутствовать значения порогового цикла "Ct".
Для отрицательного контрольного образца и отрицательного контроля амплификации значения порогового цикла "Ct" по всем каналам должны отсутствовать.
В образце обнаружена ДНК сои/кукурузы, если по каналу JOE/Yellow для него определено значение порогового цикла "Ct"35. При получении значения "Ct"
35 для анализируемой пробы требуется повторное испытание данной пробы, начиная с первого этапа анализа (экстракция ДНК). При повторном получении аналогичного результата образец считать не подлежащим анализу из-за низкого содержания в нем ДНК сои/кукурузы.
В образце обнаружен промотор 35S, если по каналу FAM/Green для него определено значение порогового цикла "Ct".
В образце обнаружен терминатор NOS, если по каналу ROX/Orange для него определено значение порогового цикла "Ct".
В образце обнаружен промотор FMV, если по каналу Cy5/Red для него определено значение порогового цикла "Ct".
10.3 Возможные ошибки
Появление любого значения "Ct" для отрицательного контрольного образца (на любом из каналов) и отрицательного контроля ПЦР (ТЕ-буфер) (на любом из каналов) свидетельствует о наличии контаминации реактивов. В этом случае результаты анализа по всем пробам считаются недействительными.
Требуется повторить испытания всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Приложение А (справочное). Требования к ПЦР-лаборатории
Приложение А
(справочное)
А.1 Лаборатория должна быть разделена на зоны (отдельные комнаты или помещения) для каждой из стадий ПЦР-диагностики.
А.2 Рабочая зона ПЦР-лаборатории в соответствии с этапами ПЦР-испытания должна включать следующий минимальный набор изолированных помещений:
- приема и регистрации лабораторной пробы;
- первичной обработки лабораторной пробы, подготовки анализируемой пробы (I зона, отдельный ламинар);
- выделения НК из анализируемой пробы (I зона, отдельный ламинар).
Примечание - Помещения, где проводят работы по выделению и амплификации НК, располагают как можно дальше от помещения для детекции и учета результатов ПЦР с целью исключения движения воздушного потока и предотвращения контаминации продуктами амплификации (ампликонов), поскольку в процессе ПЦР фрагменты ДНК накапливаются в огромных количествах и являются идеальными продуктами для реамплификации;
- приготовления реакционных смесей, постановки ПЦР (II зона);
- гибридизационно-флюоресцентной детекции и учета результатов испытания методом Real Time PCR (III зона).
Рисунок 1 - Схема ПЦР-лаборатории
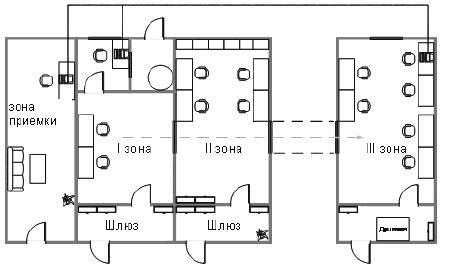
Рисунок 1 - Схема ПЦР-лаборатории
А.3 Работа в ПЦР-лаборатории должна быть организована в одном направлении: от зон выделения и амплификации НК к зоне детекции и учета результатов ПЦР. В разных зонах лаборатории должны работать разные сотрудники.
А.4 Не допускается выполнение ПЦР-испытаний в помещениях для проведения работ другими лабораторными и генно-инженерными методами (клонирование, секвенирование, рестрикционный анализ).
Все работы по подготовке испытуемых проб и выделению НК проводят в ламинарном боксе II, III классов защиты.
А.5 Каждая рабочая зона должна иметь свой набор лабораторной мебели, оборудования, реагентов, автоматических пипеток, расходных материалов, лабораторной посуды, защитной одежды, обуви, уборочного инвентаря и др. Имущество должно иметь маркировку, использование его в других помещениях или для проведения других работ запрещено.
А.6 Для проведения ПЦР-испытаний необходимо использовать только одноразовые микропробирки и наконечники. Для предотвращения аэрозольного загрязнения автоматических пипеток используют наконечники с антиаэрозольным фильтром. Пробирки и наконечники для автоматических пипеток используют однократно. При переходе от одной пробы к другой обязательно меняют наконечники с целью предотвращения перекрестной контаминации в процессе выделения ДНК, РНК или при раскапывании реакционной смеси.
А.7 Работы по подготовке реакционной смеси для ПЦР, внесению выделенных НК в ПЦР-смесь проводят в ПЦР-боксах, оснащенных ультрафиолетовыми лампами.
Регулярно следует проводить мониторинг помещений, оборудования, рабочих поверхностей, дверных ручек на наличие продуктов амплификации.
Библиография
[1] | МУ 1.3.2569-2009 | Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности |
__________________________________________________________________________
УДК 636.086.15:636.086.006.034 ОКС 65120
Ключевые слова: корма, кормовые добавки, генетически модифицированная соя, генетически модифицированная кукуруза, регуляторные последовательности в геноме, полимеразная цепная реакция, скрининговый метод, термины и определения, условия выполнения испытаний и требования безопасности, оборудование, материалы, реагенты, сущность метода, отбор проб, подготовка анализируемой пробы, экстракция ДНК, постановка ПЦР и проведение амплификации с гибридизационно-флюоресцентной детекцией в режиме реального времени (Real Time PCR)
__________________________________________________________________________
Электронный текст документа
и сверен по:
официальное издание
М.: Стандартинформ, 2014
Редакция документа с учетом
изменений и дополнений подготовлена

