ГОСТ 32371-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Кожно-резорбтивное действие: метод in vivo
Methods of testing the chemicals of health hazard. Skin absorption: in vivo method
МКС 71.040.50
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным бюджетным учреждением здравоохранения "Российский регистр потенциально опасных химических и биологических веществ" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУЗ "Российский регистр потенциально опасных химических и биологических веществ" Роспотребнадзора), Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 775-ст межгосударственный стандарт ГОСТ 32371-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 427:2004* "Кожно-резорбтивное действие: метод in vivo" ("Skin Absorption: In Vivo Method", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
В настоящий стандарт внесено следующее редакционное изменение: раздел "Термины и определения" из приложения перенесен в текст стандарта (раздел 2) для удобства пользования
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Многие химические вещества в производственных и бытовых условиях попадают на кожу и могут проникать через нее, в то время как в большинстве токсикологических исследований на лабораторных животных используется пероральный путь введения. Исследования абсорбции веществ через кожу в опытах in vivo позволяют установить связь между результатами исследований, полученными при пероральном введении и оценке безопасности воздействия на кожу.
Вещество должно проникнуть через большое число клеточных слоев кожи, прежде чем попадет в организм. Проникновение вещества в организм через кожу зависит от его липофильности и толщины внешнего слоя эпидермиса, а также от таких факторов, как молекулярная масса и концентрация вещества.
Кожа крыс и кроликов более проницаема, чем кожа человека, в то время как проницаемость кожи морских свинок, свиней и обезьян более близка к проницаемости кожи человека.
Методы для оценки способности химических веществ проникать через кожу делятся на две категории: in vivo и in vitro. В последнее время разработаны методы in vitro, которые описаны в Руководящих документах ОЭСР по изучению абсорбции кожи. Руководящий документ ОЭСР [2] позволяет выбрать наиболее подходящий метод: in vivo либо in vitro.
Метод in vivo позволяет получить полную информацию о кожно-резорбтивном действии с использованием различных лабораторных животных, а также определить степень проникновения исследуемого вещества через кожу в организм.
Преимуществом методов in vivo является то, что они используют физиологически и метаболически интактную систему, а также стандартные виды животных, для проведения испытаний по определению токсичности и могут быть модифицированы с учетом использования других видов.
Недостатками является использование теплокровных животных, необходимость применения радиоактивной метки для получения достоверных результатов, а также сложности в определении ранней фазы абсорбции и различия в проницаемости кожи предпочтительных видов лабораторных животных (крыс) и человека.
Главное правило проведения данного испытания в том, что едкие/коррозионные вещества не должны тестироваться на животных.
1 Область применения
Настоящий стандарт устанавливает процедуру испытания кожно-резорбтивного действия химической продукции методом in vivo.
Исключением являются едкие/коррозионные вещества, которые не должны тестироваться на животных.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 исследуемое вещество: материал, чьи абсорбционные характеристики должны быть изучены. В идеальном случае, вещество должно быть с радиоактивной меткой.
2.2 непоглощенная доза (unabsorbed dose): вещество, смытое с поверхности кожи после экспозиции или присутствующее на негерметичной повязке, а также количество вещества, которое испарилось с кожи во время экспозиции.
2.3 поглощенная доза (in vivo) (absorbed dose): вещество, присутствующее в моче, смывах из клетки, экскрементах, выдыхаемом воздухе (в случае проведения замеров), крови, тканях (при сборе образцов) и остатках тела, после удаления кожи в месте нанесения вещества.
2.4 поглощаемая доза (in vivo) (the absorbable dose): вещество, присутствующее на или в коже после промывки.
2.5 продолжительность экспозиции: временной интервал между нанесением и удалением исследуемой пробы путем промывки кожи.
3 Принцип метода проведения испытаний
Исследуемое вещество, как правило, с радиоактивной меткой, наносят на подготовленный участок кожи животных одно- или многократно в репрезентативной для использования форме. Тестируемое вещество оставляют на поверхности кожи в течение определенного периода времени под соответствующей повязкой (негерметичной, полугерметичной и герметичной) для предотвращения слизывания вещества животными. По окончании времени экспозиции повязку удаляют, и кожу очищают подходящим моющим средством. Повязку и моющие средства сохраняют для анализа, и накладывают свежую повязку. До, во время и после экспозиции животных содержат в индивидуальных клетках (для исследования метаболизма), их выделения и выдыхаемый воздух собирают для анализа. Сбор выдыхаемого воздуха может не производиться, когда существует достаточно информации, что вещество содержится в выдыхаемом воздухе в небольшом количестве или образуется нелетучий радиоактивный метаболит. В каждом исследовании, как правило, используют несколько групп животных, которым наносится исследуемое вещество. Одну группу по окончании периода экспозиции умерщвляют. Другие группы животных умерщвляют в определенные временные интервалы после экспозиции. По окончании времени проведения наблюдений оставшихся животных умерщвляют, их кровь собирают для анализа, место нанесения пробы также удаляют для дальнейшего анализа, а остатки тела животного анализируют на наличие невыделенного вещества. Образцы анализируют соответствующими способами и оценивают степень перкутанной абсорбции.
4 Описание метода проведения испытаний
4.1 Выбор экспериментальных видов
Наиболее часто используемым видом являются крысы, но могут использоваться безволосые группы животных и виды, имеющие скорость абсорбции вещества кожей близкую к скорости абсорбции человеческой кожей. Необходимо использовать молодые, взрослые, здоровые особи одного пола (по умолчанию мужские) обычно используемых лабораторных видов. На начальной стадии испытания различия в массе тела животных не должны превышать ±20% от средней массы.
Пример - Самцы крыс массой тела 200-250 г, предпочтительны с большей массой в данном диапазоне.
4.1.1 Количество и пол животных
Для каждого исследования и для каждого момента умерщвления должна использоваться группа, как минимум, из четырех животных одного пола. Каждую группу животных умерщвляют в различных временных интервалах.
Пример - По окончании периода экспозиции (6 или 24 ч) и последующие периоды (например, 48 и 72 ч).
Если существуют данные, демонстрирующие значительные различия в кожной токсичности у женских и мужских особей, для исследования должны быть выбраны животные наиболее чувствительного пола. Если таких данных не существует, тогда может использоваться любой пол.
4.1.2 Условия содержания и кормления
Температура в лабораторной комнате для животных должна составлять (22±3)°С.
Относительная влажность должна составлять как минимум 30% и не превышать 70%, за исключением времени уборки комнаты. Оптимальное значение относительной влажности составляет 50-60%. Освещение должно быть искусственным в последовательности 12 часов - свет, 12 часов - темнота. Громкие кратковременные шумы должны быть минимизированы. При кормлении может быть использована обычная лабораторная диета с неограниченным количеством питьевой воды. Во время испытания, а также во время адаптации, животные должны содержаться в индивидуальных клетках. Утечка воды или еды, которая может повлиять на результаты, должна быть минимизирована.
4.1.3 Подготовка животных
Животных помечают для индивидуальной идентификации и содержат в клетках в течение, как минимум, пяти дней до начала испытания для адаптации к лабораторным условиям.
Вслед за периодом адаптации, приблизительно за 24 ч до начала эксперимента, у каждого животного должен быть выстрижен участок кожи в области плеч и спины. Поскольку проницаемость поврежденной и неповрежденной кожи различна, необходимо избегать повреждений кожи. После того, как выстрижен участок кожи, приблизительно за 24 ч до нанесения исследуемого вещества, поверхность кожи должна быть обработана ацетоном для удаления кожного жира. Дополнительное мытье мылом и водой не рекомендуется, поскольку любые мыльные остатки могут стимулировать абсорбцию вещества. Область кожи должна быть достаточной для достоверного вычисления поглощенного количества исследуемого вещества на 1 см кожи, предпочтительно, как минимум, 10 см
. Данная площадь используется для крыс массой 200-250 г. После обработки животных возвращают в клетки.
4.1.4 Подготовка исследуемого вещества
Проба исследуемого вещества (например, чистый, разбавленный или смешанный препарат, содержащий исследуемое вещество, который будет наноситься на кожу) должна быть такой же, какой человек или другие потенциальные целевые виды могут подвергаться в реальных условиях воздействия. Любые отклонения в составе исследуемой пробы должны быть обоснованы. При необходимости исследуемое вещество растворяют или суспендируют в подходящем растворителе. Для растворителей (в случае, если это не вода) должны быть известны абсорбционные характеристики и возможность потенциального взаимодействия с исследуемым веществом.
4.1.5 Нанесение исследуемого вещества
На поверхности кожи выбирают место определенной площади для нанесения исследуемого вещества. Известное количество исследуемого вещества равномерно наносят на выстриженный участок кожи. Количество нанесенного вещества должно соответствовать потенциальной экспозиции для человека, обычно 1-5 мг/см твердого вещества или до 10 мкл/см
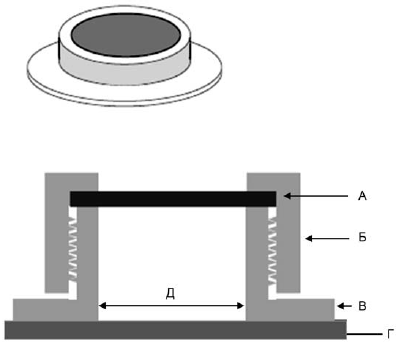
жидкости. Любые другие количества должны быть обоснованы ожидаемыми условиями использования, целью эксперимента или физическими характеристиками пробы. После нанесения вещества обработанное место должно быть защищено от слизывания. Пример типичного устройства приведен на рисунке.
|
А - фильтр из активированного угля или марлевая повязка; Б - насадка с резьбой; В - основа с резьбой; Г - кожа; Д - цианоакрилатный клей
Рисунок 1 - Пример стандартного устройства, используемого для ограничения и защиты места нанесения вещества во время исследований перкутанной абсорбции in vivo
Место нанесения защищается негерметичной повязкой (например, проницаемой нейлоновой марлевой повязкой).
При неограниченном числе нанесений вещества место нанесения должно герметично закрываться. В случае испарения полулетучего исследуемого вещества его уровень воздействия (проникновения) снижается в недопустимой степени, поэтому необходимо улавливать испаряющееся вещество угольными фильтрами, покрывающими устройство для нанесения вещества (рисунок).
Используемые приборы не должны повреждать кожу, поглощать или реагировать с исследуемой пробой.
После эксперимента животных возвращают в индивидуальные клетки для сбора выделений.
4.1.6 Продолжительность экспозиции и подготовки образцов
Продолжительность экспозиции должна соответствовать ожидаемому периоду воздействия на человека (например, 6 или 24 ч).
После периода экспозиции животных помещают в индивидуальные клетки вплоть до момента умерщвления. Животных необходимо осматривать на появление признаков токсичности (аномальных реакций) регулярно через определенные интервалы времени в течение всего периода проведения эксперимента. По окончании периода экспозиции обработанную кожу необходимо осматривать на видимые признаки раздражения.
Клетки должны предусматривать раздельный сбор мочи и фекалий во время эксперимента, сбор диоксида углерода и летучих углеродных смесей, которые необходимо анализировать при получении в количестве >5%. Моча, фекалии и уловленные жидкости и газы должны индивидуально собираться от каждой группы животных во время периода наблюдений. Если имеются данные о том, что образуются летучие радиоактивные метаболиты в небольшом количестве или не образуются, могут быть использованы открытые клетки.
Выделения собираются во время периода экспозиции, до 24 часов после первоначального контакта вещества с кожей, а затем ежедневно до окончания эксперимента. В обычном случае достаточным может быть трехразовый сбор экскрементов, некоторые задачи, связанные с особенностями тестируемой пробы или существующие кинетические данные могут потребовать другие или дополнительные временные точки для исследования.
По окончании периода экспозиции с каждого животного удаляют защитную повязку, которую сохраняют отдельно для анализа. Обработанную кожу всех животных промывают как минимум три раза с моющим веществом и подходящей щеткой. Необходимо не допускать загрязнения других частей тела животного. Моющее вещество должно быть стандартным, используемым для обычной гигиены (например, мыльный раствор в воде).
В конечном итоге кожа должна быть высушена. Все щетки и моющие приборы должны быть сохранены для анализа. Свежая повязка должна быть наложена для защиты обработанного места у тех животных, из которых формируется более поздняя временная группа, до их помещения в клетки.
4.2 Процедура умерщвления животных
Каждую группу животных необходимо умерщвлять в установленное время, а их кровь должна собираться для анализа. Защитное устройство или повязку сохраняют для дальнейшего анализа. Кожа с места нанесения вещества и такое же количество необработанной кожи каждого животного собирают отдельно для анализа. Место нанесения вещества может быть отпрепарировано с выделением отдельно рогового слоя и нижележащего эпидермиса для получения большей информации о распространении исследуемого вещества. Выявление распространения вещества в течение времени после периода экспозиции должно показывать изменение исследуемого вещества в роговом слое. Для облегчения фракционирования кожи (после последней промывки кожи и умерщвления животного) снимают каждый защитный слой.
Кожу, с места нанесения вещества, срезают с животного кольцеобразным срезом окружающей кожи и закрепляют на доске. Полоску клеящейся ленты накладывают на поверхность кожи легким надавливанием, а затем ленту удаляют вместе с частью рогового слоя. Последующие полоски ленты накладывают до тех пор, пока лента не перестанет приклеиваться к поверхности кожи, что свидетельствует об удалении рогового слоя полностью. Для каждого животного, все полоски собираются в один контейнер, куда добавляется дигестант для растворения рогового слоя. Все потенциальные целевые ткани могут быть удалены для проведения отдельных измерений до того, как остатки тела животного будут исследованы на остаточную дозу. Остатки тел всех животных сохраняют для анализа. Обычно, достаточно проведения общего анализа. Органы-мишени также могут быть извлечены для проведения отдельного анализа (при наличии показаний других исследований). Моча, присутствующая в мочевом пузыре в момент умерщвления животного, должна быть добавлена к предыдущему сбору. После сбора экскреций из метаболических клеток в момент умерщвления, все клетки и их ловушки следует промыть соответствующим растворителем. Прочее потенциально загрязненное оборудование должно быть исследовано таким же образом.
4.3 Проведение анализа
Во всех исследованиях должны быть получены адекватные результаты, то есть средние значения радиоактивной метки (уровень проникновения) должно составлять (100±10)%. Результаты, не попадающие в данный диапазон, следует обосновать. Количество дозы в каждом образце следует проанализировать с помощью соответствующей обоснованной процедуры.
5 Данные
Для каждого животного должны быть проведены следующие измерения (для каждого периода времени каждого тестируемого вещества и/или метаболита):
- количество вещества, полученное с защитной повязки;
- количество вещества, которое может быть получено с кожи;
- количество вещества на или в коже, которое не может быть смыто;
- количество вещества в анализе крови;
- содержание вещества в выделениях и выдыхаемом воздухе (при необходимости);
- вещество, оставшееся в тканях или органах, оставленных для отдельного анализа.
В дополнение к индивидуальным данным, должны быть представлены средние значения по всей группе отбора образцов.
Содержание исследуемого вещества и/или метаболитов в выделениях, выдыхаемом воздухе, крови и в тканях позволяет определить полное количество поглощенного вещества в определенное время. Должно быть рассчитано количество исследуемого вещества, поглощенного 1 см кожи, подвергаемой воздействию исследуемого вещества за период экспозиции.
6 Отчет о проведении испытания
Отчет о проведении испытания должен содержать требования, обусловленные протоколом испытания, включая обоснование используемой экспериментальной схемы, и должен содержать следующее:
Исследуемое вещество:
- идентификационные данные (например, номер CAS, если известно, источник, чистота (радиохимическая чистота), известные примеси, номер партии);
- физические свойства, физико-химические свойства (например, рН, летучесть, растворимость, стабильность, молекулярная масса, logPow).
Подготовка исследуемого вещества:
- состав и обоснование использования;
- описание подготовки пробы, наносимого количества, достигаемые концентрации, растворитель, стабильность и гомогенность.
Экспериментальные животные:
- используемая группа/вид;
- количество, возраст и пол животных;
- источник животных, условия содержания, диета и т.д.;
- индивидуальная масса тела животных в начале испытания.
Условия проведения испытания:
- описание нанесения тестовой пробы (место нанесения, экспериментальные методы, наличие или отсутствие повязки, объем, экстракция, определение);
- информация о качестве воды и пищи.
Результаты:
- любые признаки токсичности;
- данные об абсорбции, представленные в таблице (выраженные в виде степени, количества или в процентном соотношении);
- полные результаты эксперимента;
- интерпретация результатов, сравнение с любыми доступными данными о перкутанной абсорбции исследуемого вещества.
Обсуждение результатов.
Выводы.
Библиография
[1] | OECD, Test N 427 "Skin Absorption: In Vivo Method" |
[2] | OECD, "Guidance Document N 28 for the Conduct of Skin Absorption Studies" |
[3] | D (2004). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
[4] | ECETOC (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20. |
[5] | Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. 8 (5), 829-835. |
[6] | Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA. |
[7] | EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment. |
[8] | EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pesticides, and Toxic Substances, |
[9] | Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in rhesus monkeys and humans. Fd. Chem. Toxic. 28, 369-373. |
[10] | Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest. Dermatol. 54, 399-404. |
УДК 658.382.3:006.354 | МКС 71.040.50 |
Ключевые слова: химическая продукция, воздействие на организм человека, метод испытаний, кожно-резорбтивное действие | |
Электронный текст документа
и сверен по:
, 2019