ГОСТ 34557-2019
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Испытания по оценке острой токсичности при внутрижелудочном поступлении. Метод "вверх и вниз"
Methods of testing the chemicals of human hazard. Testing of acute oral toxicity by intragastric admission. Up-and-down method
МКС 75.080
11.020
11.120.01
Дата введения 2020-06-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены".
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия" (ФГУП "") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июля 2019 г. N 120-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 8 августа 2019 г. N 475-ст межгосударственный стандарт ГОСТ 34557-2019 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2020 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD, Test N 425:2008* "Руководство по испытанию острой пероральной токсичности химических веществ. Метод "вверх и вниз" ["OECD Guidelines for the testing of chemicals acute oral toxicity. Up-and-down-procedure (UDP)", MOD] путем:
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
- включения в текст стандарта дополнительного раздела, который выделен курсивом;
- изменения структуры документа для приведения в соответствие с правилами, установленными ГОСТ 1.5 (подразделы 4.2 и 4.3).
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа приведено в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Руководства OECD по испытаниям химических веществ периодически пересматриваются с учетом научного прогресса или изменения норм оценивания. Концепция подхода к исследованию "доза-ответ" (UDP) впервые описана У.Дж.Диксоном и А.М.Мудом [1]-[4]. Для определения острой токсичности химических веществ в 1985 г. Р.Д.Брюсом предложена процедура "вверх и вниз" [5]. Существует несколько вариантов экспериментальной процедуры "вверх и вниз" для оценки 50%-ной летальной дозы (LD50). В настоящем документе использована методика Р.Д.Брюса, принятая Американским обществом по испытанию материалов (ASTM) в 1987 г. [6] и пересмотренная в 1990 г. Исследование, сравнивающее результаты, полученные с помощью UDP традиционным способом измерения LD50 и методом фиксированной дозы FDP (см. руководство OECD 420), опубликовано в 1995 г. [7]. После появления ранних работ У.Дж.Диксона и А.М.Муда в биометрической и прикладной литературе опубликованы работы, посвященные улучшению условий использования предложенного подхода [8]-[11]. В соответствии с рекомендациями нескольких заседаний экспертов в 1999 г. проведен пересмотр метода, основа которого - следующие положения OECD: наличие согласованных пороговых значений LD50 для классификации химических веществ; достаточность использования для исследований животных одного пола (как правило, самок); оценка доверительных интервалов (CI), необходимая для признания обоснованности результатов точечной оценки.
Процедура испытания, приведенная в настоящем документе, минимизирует количество животных, необходимых для оценки острой пероральной токсичности химического вещества. В дополнение к оценке LD50 и доверительных интервалов испытание позволяет наблюдать признаки токсичности. Пересмотр руководства по испытаниям 425 проводился одновременно с пересмотром руководств по испытаниям 420* и 423**.
________________
* Действует ГОСТ 32296-2013 "Методы испытаний по воздействию химической продукции на организм человека. Основные требования к проведению испытаний по оценке острой токсичности при внутрижелудочном поступлении методом фиксированной дозы".
** Действует ГОСТ 32644-2014 "Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность - метод определения класса острой токсичности".
Рекомендации для выбора наиболее подходящего метода испытаний представлены в руководстве по исследованию острой оральной токсичности [12], в котором также содержится дополнительная информация о проведении испытания и интерпретации результатов руководства 425.
1 Область применения
Настоящий стандарт устанавливает требования к исследованию острой токсичности при внутрижелудочном поступлении химических веществ методом "вверх и вниз".
Настоящий стандарт позволяет установить значение LD50 и доверительного интервала, наблюдать за признаками токсичности, а результаты исследований дают возможность определить категорию и классифицировать вещество в соответствии с Согласованной на глобальном уровне системой классификации и маркировки химических веществ (СГС).
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 острая оральная токсичность (acute oral toxicity): Токсические эффекты, проявляющиеся в течение 24 ч после одно- или многократного перорального введения дозы исследуемого вещества.
2.2 замедленная смерть (delayed death): Гибель или агония животного, наступающая позднее 48 ч после воздействия исследуемого вещества, но в течение 14-дневного периода наблюдения.
2.3 доза (dose): Количество вводимого исследуемого вещества, выраженное отношением единицы массы исследуемого вещества на единицу массы тела подопытного животного, мг/кг.
2.4 коэффициент прогрессии дозы (dose progression factor): Коэффициент интервала дозы относится к кратному числу, на которое увеличивают дозу (прогрессия дозы) в случае выживания животного или уменьшают дозу (делитель), если животное умирает.
Примечание - Коэффициент прогрессии дозы должен быть антилогарифмом 1/(расчетный наклон кривой зависимости "доза-ответ"). По умолчанию рекомендуется использовать коэффициент прогрессии дозы 3,2=antilog 0,5=antilog 1/2.
2.5 согласованная на глобальном уровне система классификации опасности и маркировки химической продукции; СГС (GHS): Система, разработанная Организацией экономического сотрудничества и развития (ОЭСР), Подкомитетом экспертов по перевозке опасных грузов Экономического и социального сотрудничества ООН и Международной организацией труда (ILO, техническая координация) и функционирующая в рамках Межорганизационной программы по безопасному обращению с химическими веществами (IOMC).
2.6 неминуемая смерть (impending death): Наличие клинических симптомов, указывающих на то, что гибель животного может наступить ранее запланированного времени наблюдения.
Примечание - Симптомами подобного состояния у грызунов могут быть конвульсии, лежачее положение, в т.ч. на боку, и тремор. Более подробная информация приведена в методическом документе по гуманной конечной точке [13].
2.7 50%-ная летальная доза; LD50: Статистически установленная разовая доза вещества, которая при пероральном введении приведет к смерти у 50% животных.
Примечание - LD50 выражают отношением массы исследуемого вещества на единицу массы подопытного животного, мг/кг.
2.8 предельная доза (limit dose): Верхнее ограничение дозы при исследовании (2000 или 5000 мг/кг).
2.9 агония (moribund status): Состояние умирания или невозможности выжить, несмотря на предпринятое лечение.
Примечание - Более подробная информация приведена в методическом документе по гуманной конечной точке [13].
2.10 номинальный размер выборки (nominal sample size): Общее число подопытных животных, на единицу меньшее числа подобных ответов в начале серии, или число подопытных животных, за исключением первого из двух животных, после которого происходит первое реверсирование.
Примечание - Например, для серии, где X и O - противоположные результаты для животных (например, X: "животное погибает в течение 48 ч", и O: "животное выживает") в схеме: OOOXXOXO общее количество подопытных животных (или размер выборки) равно восьми, а номинальный размер выборки равен шести. В этом примере показаны четыре животных после реверсирования. Важно отметить, к чему относится число - к номинальному размеру выборки или к общему количеству подопытных животных; например, максимальное фактическое количество подопытных животных равно 15. Когда исследование останавливают на основе этого максимального числа, номинальный размер выборки будет менее или равен 15. Животные номинальной выборки начинаются с (r-1)-го животного (перед вторым животным, после которого происходит реверсия).
2.11 предсказуемая смерть (predictable death): Наличие клинических признаков, указывающих на то, что смерть может наступить ранее запланированного окончания испытания, например вследствие невозможности дотянуться до воды или пищи.
Примечание - Более подробная информация о гуманной конечной точке приведена в методическом документе [13].
2.12 пробит (probit): Модель зависимости "доза-ответ", позволяющая анализировать стандартное нормальное распределение (то есть центрированное относительно среднего и масштабированное по его стандартному отклонению ) ожидаемых ответов на дозы (как правило, по логарифмической шкале), представленных в виде прямой линии с наклоном, обратным
.
Примечания
1 Пробит (probit) - термин, образованный при сокращении слов "probability integral transformation".
2 Стандартное нормальное распределение летальности симметрично, следовательно, его среднее значение также является истинным значением LD50 или средним ответом.
2.13 реверсирование (reversal): Реверсирование создается парными ответами: при определенной дозе препарата реакция отсутствует и наблюдается при следующей испытуемой дозе или наоборот (то есть ответ, за которым следует отсутствие ответа).
Примечание - Первый парный ответ наблюдается у животных с номерами r-1 и r.
2.14 : Стандартное отклонение кривой логарифмически нормального распределения, описывающее диапазон допустимой дозы химического вещества для испытуемых субъектов (когда предполагается, что субъект способен реагировать, если доза химического вещества превышает терпимость субъекта).
Примечание - Вычисленное значение дает оценку вариации ответа подопытных животных на полный диапазон доз (см. наклон и пробит).
2.15 наклон (кривой зависимости "доза-ответ") [slope (of the dose-response curve)]: Положительное значение угла наклона кривой "доза-ответ" к оси дозы: при анализе по шкале пробит-анализа, когда ответы в зависимости от дозы анализируют по логарифмической шкале, кривая зависимости будет прямой, а ее наклон будет величиной, обратной , то есть среднеквадратическим отклонением допускаемой погрешности для испытуемого объекта, для которого предполагается нормальное распределение (см. пробит и
).
2.16 правило остановки (stopping rule): В настоящем стандарте используется в качестве синонима:
- конкретного критерия остановки и
- совокупности всех критериев, определяющих завершение последовательности исследования, в частности: для основного испытания правило остановки использовано в настоящем стандарте (3.3) для обозначения критерия, который основан на сравнении соотношения с критическим значением.
3 Основные положения
3.1 До проведения испытаний следует проанализировать информацию в отношении исследуемого вещества, которая должна включать сведения о составе и химическом строении вещества, его физико-химических свойствах, результатах токсикологических испытаний in vivo и in vitro, а также токсикологические данные по структурно родственным веществам и предполагаемые пути введения вещества. Полученная информация подтверждает необходимость проведения исследований и обеспечивает выбор адекватной начальной дозы.
3.2 Настоящий метод позволяет оценивать LD50 с доверительной вероятностью, а результаты дают возможность ранжировать и классифицировать вещество в соответствии с СГС, как вызывающее острую токсичность [14].
3.3 При отсутствии предварительной информации о значении LD50 и наклоне кривой зависимости "доза-ответ" исследования начинают с дозы 175 мг/кг, которая, как правило, ниже предполагаемого значения LD50, и увеличивают каждую последующую дозу на коэффициент 3,2 (половину логарифмической единицы), что обеспечивает более эффективное использование животных и повышает точность прогнозирования значения LD50. Начальная доза должна быть изменена, если вещество является крайне токсичным. Так как метод основан на выборе начальной дозы, необходимо, чтобы начальная доза находилась ниже значения LD50 (см. 7.4.2 и приложение A в отношении обсуждения последовательности доз и начальных значений). При изучении летальности химических веществ с большой вариабельностью пологие наклоны кривой зависимости "доза-ответ" могут иметь смещения, приводящие к значительной статистической погрешности при оценке летальности LD50 и характерные для других методов определения острой токсичности. Во избежание сходных погрешностей основное исследование включает "правило остановки", соответствующее критериям остановки, а не фиксированному количеству наблюдений за процессом испытаний (см. 7.4.3).
3.4 Метод применяют к химическим веществам, вызывающим гибель животных в течение одного или двух дней. Метод не пригоден для химических веществ с предполагаемым эффектом замедленной смерти (гибель через 5 дней или более после введения препаратов).
3.5 Для облегчения расчетов по результатам исследований используются компьютерные программы, устанавливающие последовательность испытания и окончательные оценки (см. [15], [16]).
3.6 Исследуемые вещества не следует вводить в дозах, которые приводят к выраженным болевым ощущениям и недомоганиям, оказывая разъедающее или сильно раздражающее действие. Агонизирующие животные, животные, испытывающие непереносимую боль или находящиеся в безнадежном физическом состоянии, должны быть умерщвлены гуманным способом в соответствии с [13] и учтены при интерпретации результатов исследования точно так же, как и животные, погибшие во время исследования.
3.7 Для исследования химических веществ, которые могут иметь низкую токсичность, может быть эффективно проведено испытание предельной дозы.
4 Правила исследования предельной дозы
Исследование предельной дозы - это последовательное испытание, в котором используют не более пяти животных с предельной дозой препаратов 2000 мг/кг или в исключительных случаях 5000 мг/кг. Методы испытаний для данных доз отличаются (см. 7.3.1.1-7.3.1.3 для предельной дозы 2000 мг/кг и 7.3.2.1-7.3.2.5 для предельной дозы 5000 мг/кг). Выбор плана последовательного испытания повышает статистическую точность и принят с целью преднамеренного отказа от испытания предельной дозы для веществ с LD50 вблизи предельной дозы, для того чтобы не допустить ошибку с точки зрения безопасности. Как и в других испытаниях на предельное содержание, вероятность корректной классификации соединения уменьшается с приближением значения LD50 к предельной дозе.
5 Правила основного исследования
5.1 Основное исследование состоит из упорядоченной последовательности доз, которые вводят животным однократно с интервалами не менее 48 ч. Первое животное получает дозу на ступень ниже уровня наиболее точной оценки значения LD50. Если животное выживает, дозу для следующего животного увеличивают в 3,2 раза от начальной дозы; если погибает - дозу для следующей особи снижают в 3,2 раза.
Примечание - Значение 3,2 является коэффициентом по умолчанию, соответствующим коэффициенту прогрессии дозы на половину логарифмической единицы. Дополнительные указания по выбору коэффициента интервала дозы приведены в 7.4.2.
За каждым животным следует внимательно наблюдать в течение 48 ч перед принятием решения о введении дозы другому животному и ее уровне. Данное решение принимают на основе 48-часовой схемы выживания всех животных к окончанию установленного срока (см. 7.4.1 и 7.4.5 о выборе интервалов между дозами). Правило остановки используют для обеспечения минимального количества экспериментальных животных при соблюдении схемы введения доз с целью снижения эффекта неправильной начальной дозы или низкого наклона кривой зависимости "доза-ответ" (см. 7.4.4). Введения доз прекращают при соответствии одному из критериев остановки (см. 7.4.3 и 9.2.1), затем вычисляют значение LD50 и доверительный интервал исходя из состояния всех животных во время остановки. В большинстве случаев достаточным является использование четырех животных, и испытание завершают после первого реверсирования результатов. Значение LD50 вычисляют с использованием метода максимального правдоподобия [14], [15] (см. 9.2.1 и 9.2.3).
5.2 Результаты основного исследования служат отправной точкой для алгоритма вычисления доверительного интервала (CI), при возможности (определение CI см. в 9.3.1).
6 Сущность метода
6.1 Выбор вида животных
6.1.1 Наиболее предпочтительным видом грызунов при проведении испытаний является крыса, вместе с тем можно использовать и другие виды грызунов (обычно используют самок крыс [12]). Это обусловлено тем, что, согласно литературным обзорам стандартных исследований LD50, показано, что чувствительность животных разного пола незначительно отличается, и самки, как правило, более чувствительны [7]. Однако если токсикологические или токсикокинетические данные для структурно родственных химических веществ показывают, что самцы являются более чувствительными, тогда следует использовать мужских особей. Проведение испытаний с использованием мужских особей должно быть научно обоснованным.
6.1.2 В экспериментах следует использовать здоровых молодых половозрелых особей обычно используемых лабораторных линий. Самки не должны быть беременными и рожавшими. Возраст каждого животного на момент начала эксперимента должен быть от 8 до 12 нед, а его масса должна составлять ±20% от средней массы животных, использованных ранее при введении доз.
6.2 Условия содержания и кормления
Температура в лабораторной комнате должна составлять (22±3)°С. Относительная влажность должна быть не менее 30% и не превышать 70%, за исключением времени уборки комнаты; оптимальное значение - от 50% до 60%. Освещение должно быть искусственным с определенной последовательностью: 12 ч - свет, 12 ч - темнота. Животных размещают индивидуально. При кормлении используют обычную лабораторную диету с неограниченным количеством питьевой воды.
6.3 Подготовка животных
Животных отбирают методом случайной выборки, маркируют для обеспечения индивидуальной идентификации и до введения исследуемого вещества содержат в клетках не менее пяти дней для акклиматизации к лабораторным условиям. Как и в других схемах последовательных испытаний, следует обеспечить наличие достаточного числа животных соответствующей массы тела и возраста для проведения всего испытания.
6.4 Подготовка доз
Вводят фиксированный объем исследуемого вещества во всем диапазоне доз путем изменения концентрации вводимого вещества. В некоторых случаях при испытании жидкого продукта или смеси целесообразно вводить исследуемое вещество без разбавления, то есть с постоянной концентрацией, что может быть важным для последующей оценки общего риска этого вещества и являться требованием со стороны регулирующих органов. В любом случае объем вводимой дозы не должен превышать максимальный объем жидкости, которую можно вводить за один раз в соответствии с массой подопытного животного. Для грызунов объем дозы, как правило, не должен превышать 1 см/100 г массы тела или 2 см
/100 г массы тела для водных растворов. Предпочтительно использовать водные растворы/суспензии/эмульсии химических веществ, для не растворимых в воде веществ применяют масляные растворы/суспензии/эмульсии (например, в кукурузном масле), затем рассматривают возможность использования других растворителей (носителей) с известными токсикологическими характеристиками. Дозы должны быть приготовлены незадолго до их введения с учетом стабильности изучаемого вещества в период исследования.
7 Проведение испытаний
7.1 Введение доз
7.1.1 Исследуемое вещество вводят однократной дозой через зонд: желудочную трубку или интубационную канюлю. Если в силу чрезвычайных обстоятельств введение однократной дозы невозможно, доза может быть введена частями в период, не превышающий 24 ч.
7.1.2 Перед введением дозы животных ограничивают в пище (например, крыс не следует кормить на ночь накануне введения дозы, но при этом не ограничивают прием воды; мышей следует кормить не менее чем за 3-4 ч до введения дозы, но им можно пить). После голодания животных взвешивают, затем вводят исследуемое вещество. Определяют массу тела каждого голодного животного и рассчитывают дозу в соответствии с массой тела. После введения препарата крыс не кормят 3-4 ч, мышей - 1-2 ч. При введении дозы порционно в зависимости от установленного периода животным может потребоваться пища и вода.
7.2 Испытание предельной дозы и основной дозы
Испытание предельной дозы используют в основном в тех ситуациях, когда экспериментатор обладает информацией, указывающей на то, что исследуемое химическое вещество нетоксично, то есть его токсичность ниже нормативных предельных доз. Информация о токсичности исследуемого вещества может быть получена из источников об аналогичных исследуемых веществах, или аналогичных проверенных смесях веществ, или продуктах с учетом идентичности и процентного содержания компонентов, токсичность которых известна. В тех ситуациях, когда информации о токсичности химического вещества мало или она отсутствует, следует выполнить основное испытание.
7.3 Испытание предельной дозы
7.3.1 Испытание предельной дозы 2000 мг/кг
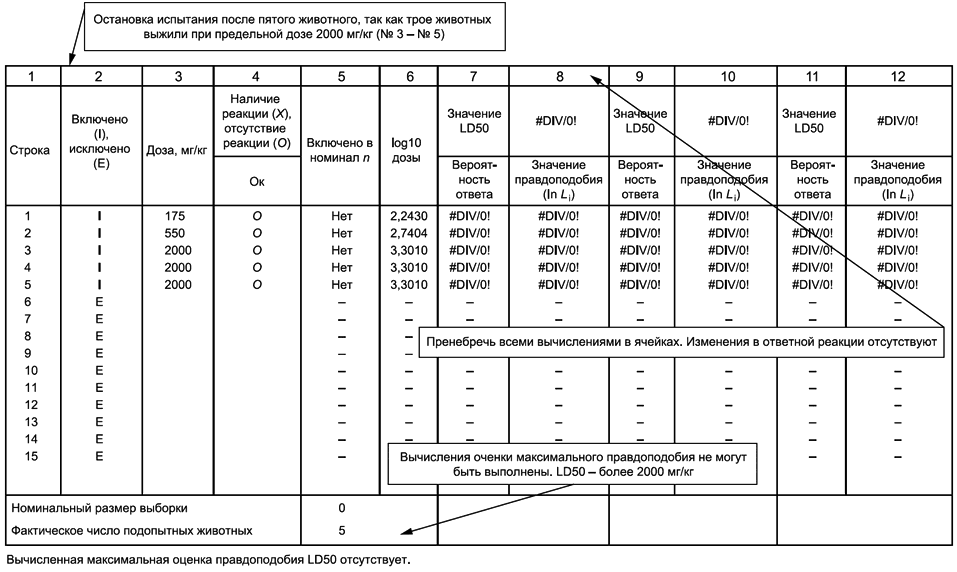
7.3.1.1 Исследуемую дозу вводят одному животному, при его гибели для определения значения LD50 проводят основное испытание. Если животное выживает - дозу вводят последовательно еще четырем животным, для того чтобы в итоге были исследованы пять животных. При гибели трех животных испытание предельной дозы прекращают и выполняют основное испытание. Значение LD50 принимают более 2000 мг/кг, если выживают трое животных или более. Если животное неожиданно погибает в конце исследования, а остальные выживают, введение вещества прекращают и наблюдают за выжившими животными в течение аналогичного периода времени (см. 7.4 о периоде первоначального наблюдения). Случаи смерти в поздний период следует учитывать точно так же, как и другие летальные случаи, результаты оценивают следующим образом; О - выживание, X - смерть.
7.3.1.2 Значение LD50 - менее 2000 мг/кг, если погибло трое животных или более:
О ХО XX
О ОХ XX
О XX ОХ
О XX X
Если умирает третье животное, проводят основное испытание.
7.3.1.3 Исследуют пять животных. Значение LD50 - более 2000 мг/кг при выживании трех животных или более:
О ОО ОО
О ОО ХО
О ОО ОХ
О ОО XX
О ХО ХО
О ХО ОО/Х
О ОХ ХО
О ОХ ОО/Х
О XX ОО
7.3.2 Испытание предельной дозы 5000 мг/кг
7.3.2.1 Испытание предельной дозы 5000 мг/кг проводят в исключительных случаях, когда это оправдано конкретными требованиями регулирующих органов (см. приложение В). По причине гуманного отношения к животным испытания в диапазонах категории 5 СГС (от 2000 до 5000 мг/кг) не одобряются и проводятся только в том случае, если высока вероятность прямой связи результатов таких испытаний с охраной здоровья человека, или животных, или окружающей среды.
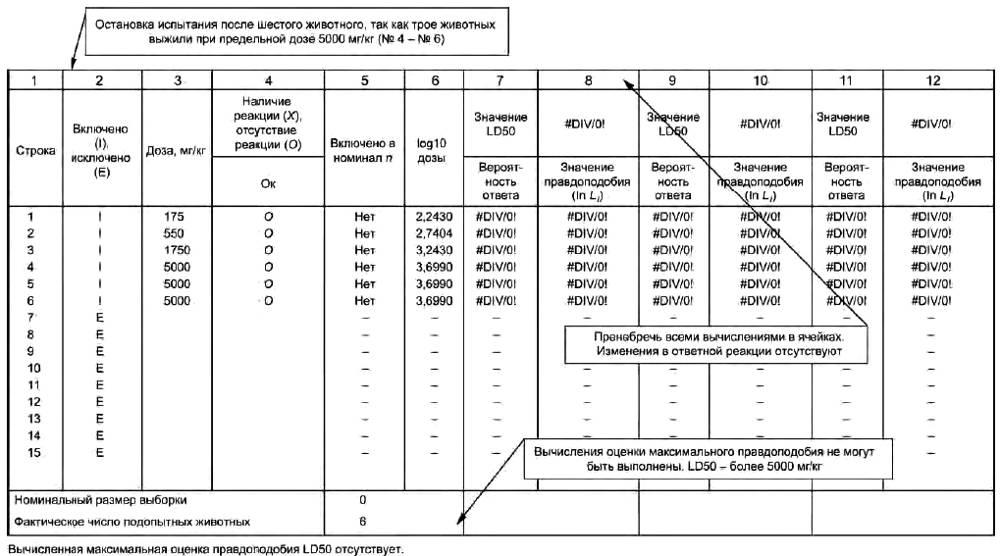
7.3.2.2 Исследуемую дозу вводят одному животному, при его гибели проводят основное испытание для определения значения LD50. Если животное выживает, дозу вводят другим двум животным. Если оба животных выживают, то значение LD50 принимают более 5000 мг/кг и прекращают испытание (то есть до завершения 14-дневного наблюдения без введения дозы другим животным).
7.3.2.3 Если одно или два животных погибают, дозу вводят последовательно другим двум животным. Если в конце исследования погибает одно животное, а остальные выживают, прекращают введение вещества и наблюдают за всеми животными в течение аналогичного периода времени (см. 3.6 о периоде первоначального наблюдения). Случаи поздней смерти учитывают так же, как и другие случаи смерти.
Результаты оценивают следующим образом: O - выживание, X - смерть и U - не обязательно.
7.3.2.4 Значение LD50 - менее 5000 мг/кг в том случае, если умирают трое животных или более.
О ХО XX
О ОХ XX
О XX ОХ
О XX X
7.3.2.5 Значение LD50 более 5000 мг/кг при выживании трех животных или более:
О ОО
О ХО ХО
О ХО О
О ОХ ХО
О ОХ О
О XX ОО
7.4 Основное испытание
7.4.1 Животным последовательно по одному вводят дозу, как правило, с интервалом в 48 ч. Однако интервалы времени между введением доз зависят от начала, продолжительности и выраженности токсических признаков. Введение дозы следующему животному следует отложить до тех пор, пока выживание животного с ранее введенной дозой не будет вызывать сомнение. В случае неубедительного ответа временной интервал может быть отрегулирован соответствующим образом. Проведение эксперимента упрощается в том случае, если для принятия решения о последовательном введении доз используют один временной интервал. Тем не менее отсутствует необходимость пересчитывать дозы или использовать отношение правдоподобия, если временной интервал изменяется в середине испытания. При выборе начальной дозы следует использовать всю имеющуюся информацию, включая информацию о структурно родственных веществах и данные результатов других испытаний токсичности исследуемого химического вещества, а также наклон кривой "доза-ответ" для аппроксимации значения LD50.
7.4.2 Первому животному вводят дозу на ступень ниже наиболее надежного предварительного значения LD50. Если животное выживает, то второму животному вводят более высокую дозу. В случае гибели или агонии первого животного второму животному вводят более низкую дозу. Коэффициент прогрессии (регрессии) дозы выбирают как антилогарифм от 1/(расчетный наклон кривой зависимости "доза-ответ") и используют на протяжении всего испытания (прогрессия 3,2 соответствует наклону 2). При отсутствии информации о наклоне кривой используют коэффициент, равный 3,2. При применении стандартного коэффициента прогрессии выбирают дозы из последовательности 1,75; 5,5; 17,5; 55; 175; 550; 2000 (или 1,75; 5,5; 17,5; 55; 175; 550; 1750; 5000 в соответствии с конкретными требованиями регулирующих органов). При отсутствии данных о летальности вещества введение доз начинают с 175 мг/кг. В большинстве случаев эта доза является сублетальной и служит для снижения уровня боли и страданий. Если ожидается высокая переносимость химического вещества (то есть наклон кривой зависимости "доза-ответ" менее 2,0), перед началом испытания следует рассмотреть вопрос о повышении коэффициента прогрессии дозы выше стандартного, превышающего значение по умолчанию 0,5 по логарифмической шкале дозы (то есть коэффициента прогрессии 3,2). Аналогично для исследуемых веществ, которые имеют очень крутой наклон кривой, следует выбирать коэффициенты прогрессии дозы менее, чем значение по умолчанию. (В приложении A приведена таблица прогрессии дозы для наклонов кривой в диапазоне от 1 до 8 с дозой 175 мг/кг.)
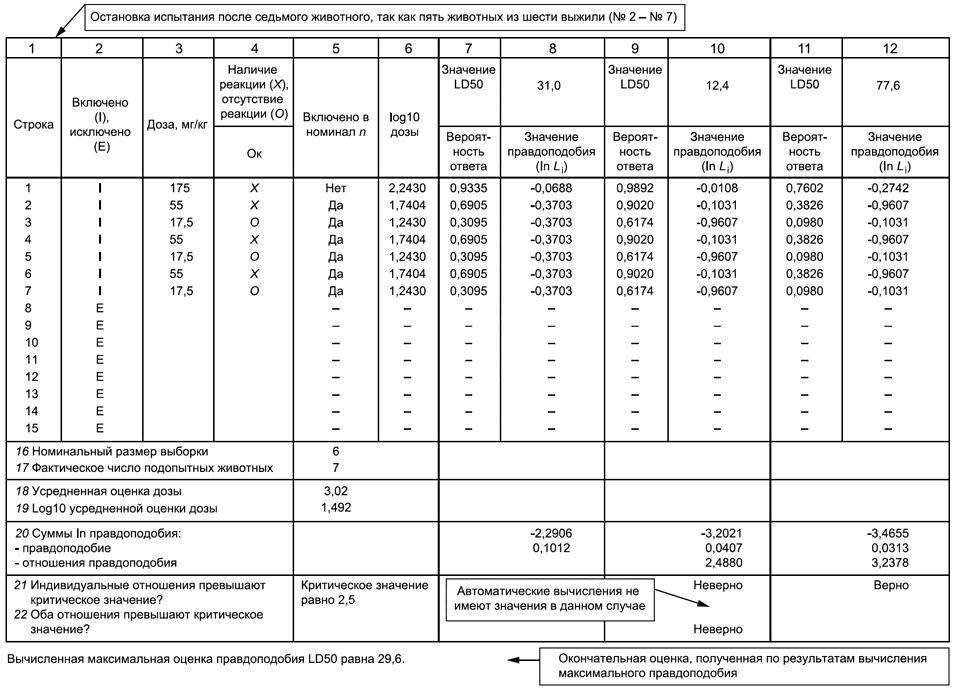
7.4.3 Введение доз продолжают в соответствии с ответами, полученными после испытания всех животных, через фиксированные интервалы времени (например, 48-часовые). Испытание останавливают при обнаружении соответствия как минимум одному из следующих критериев остановки:
a) более трех животных, последовательно введенных в эксперимент, выживают при введении максимальной дозы;
b) происходит пять реверсирований у шести последовательно испытуемых животных;
c) не менее четырех животных проявляют реверсирование после наблюдавшегося первого, и соответствующие отношения правдоподобия превышают критическое значение (см. 9.2.4 и приложение C. Вычисления выполняют при введении каждой дозы, следующей за введением дозы четвертому животному после первого реверсирования).
При большом разнообразии оценочных значений LD50 и наклонов кривой условие "правила остановки" согласно перечислению с) 7.4.3 будет выполняться для четырех-шести животных после реверсирования. В некоторых случаях для веществ с пологими кривыми зависимости "доза-ответ" может понадобиться дополнительное количество животных (не более 15).
7.4.4 Если соблюдены критерии остановки, значение LD50 следует вычислять на основании результатов, полученных на животных при остановке испытаний, используя метод, приведенный в 9.1 и 9.2.1.
7.4.5 Количество агонизирующих и умерщвленных по причинам гуманности животных учитывают так же, как и количество погибших в ходе испытания. В случае гибели животного в конце исследования и выживания остальных с этой или более высокой дозой прекращают введение вещества и наблюдают за выжившими животными для того, чтобы зафиксировать гибель или выживание других животных в течение аналогичного периода наблюдения. В случае летальных исходов среди животных, получивших дозу, превышающую значение LD50, но выживших в начале эксперимента, испытание повторяют, начиная с дозы на две ступени ниже самой низкой из ранее введенных доз, вызвавших летальный эффект (и увеличивают период наблюдения), так как метод является наиболее точным при начальной дозе ниже значения LD50. При введении следующему животному дозы, вызвавшей гибель предыдущего или превышающей ее, прогрессию дозы не изменяют; информацию о погибшем животном включают в расчеты и учитывают как гибель при более низкой дозе, чем у выживших животных, что в результате приведет к снижению вычисленного значения LD50.
8 Наблюдения
8.1 За каждым животным наблюдают индивидуально, не реже одного раза в течение 30 мин после введения дозы, затем периодически в течение первых 24 ч (особое внимание уделяют в течение первых 4 ч) и впоследствии ежедневно, на протяжении 14 дней, за исключением тех случаев, когда животных удаляют из эксперимента и умерщвляют по соображениям гуманного обращения или их обнаруживают мертвыми. В то же время продолжительность наблюдения не должна быть жестко фиксированной. Длительность наблюдения зависит от токсических реакций, времени их появления и продолжительности периода восстановления и, следовательно, при необходимости может быть увеличена. Те периоды времени, в которые признаки токсичности появляются и проходят, являются важными, особенно если наблюдается тенденция к задержке токсических признаков [17]. Все наблюдения систематически регистрируют, при этом по каждому животному ведут отдельные записи.
8.2 Дополнительные наблюдения понадобятся в том случае, если у животных продолжают проявляться симптомы интоксикации. Наблюдения должны включать фиксирование изменений состояния кожи и шерсти, глаз и слизистых оболочек, а также со стороны респираторной, кровеносной, вегетативной и центральной нервных систем, отображая соматомоторную активность и характер поведения. Следует обратить особое внимание на появление тремора, конвульсий, слюноотделения, диареи, вялости, сонливости и впадение в кому, а также учитывать принципы и критерии, обобщенные в [13]. Животных, находящихся в предсмертном состоянии и испытывающих сильную боль или стойкие признаки тяжелого недомогания, следует гуманно умертвить. Если животное умерщвляют по причинам гуманности или оно найдено мертвым, следует по возможности зарегистрировать точное время смерти.
8.3 Масса тела
Животных взвешивают перед введением исследуемого вещества, после введения контролируют массу тела не реже одного раза в неделю, фиксируя все изменения. Вычисляют и регистрируют изменение массы тела. В конце испытания выживших животных взвешивают и затем гуманно умерщвляют.
8.4 Патология
Патологоанатомическим исследованиям (общей аутопсии) подвергают всех подопытных животных (включая погибших во время испытаний и умерщвленных при исследовании по причинам гуманности). Все выраженные (макроскопические) патологические изменения должны быть зарегистрированы относительно каждого животного. Следует проводить микроскопическое исследование органов у животных, имеющих признаки макропатологии, выживших в течение 24 ч или более после введения дозы, так как данная информация может быть полезной.
9 Данные и отчетность
9.1 Данные
Данные по каждому животному представляют отдельно. Кроме того, все данные следует обобщить в табличной форме, указывая: число использованных животных для каждой исследуемой дозы; число животных с признаками токсичности [17]; число животных, обнаруженных мертвыми во время исследования или умерщвленных по причинам гуманности; время смерти каждого животного; описание и временную динамику токсического воздействия и реверсирования, а также результаты аутопсии. Следует предоставить обоснование начальной дозы и прогрессии дозы и любые данные, использованные для подтверждения этого выбора.
9.2 Вычисление значения LD50 для основного испытания
9.2.1 Значение LD50 вычисляют с использованием метода максимального правдоподобия [14], [15], за исключением случаев, приведенных в 9.2.2. При выполнении предлагаемых вычислений максимального правдоподобия (с принятым значением ) можно использовать следующие статистические данные: все смертельные случаи, такие как быстрая или замедленная смерть либо умерщвление по причинам гуманности, объединяют для анализа методом максимального правдоподобия. В соответствии с критерием У.Дж.Диксона [4] функцию правдоподобия результатов эксперимента L с учетом
,
и n вычисляют по формулам:
![]() , (1)
, (1)
где 1, 2….. - порядковый номер i-го животного;
n - общее число подопытных животных;
![]() , если i-е животное выжило,
, если i-е животное выжило,
где F - кумулятивное стандартное нормальное распределение;
![]() ,
,
где ![]() - доза, введенная i-му животному;
- доза, введенная i-му животному;
- значение, в соответствии с которым задается оценка истинного значения LD50 и обеспечивается максимальное правдоподобие L (см. 9.2.3);
- стандартное квадратическое отклонение дозы в логарифмических единицах (которое не является логарифмическим среднеквадратическим отклонением),
![]() , если i-е животное погибло.
, если i-е животное погибло.
Используют оценочное значение , равное 0,5, если отсутствует более качественное общее значение или конкретное значение.
9.2.2 При определенных условиях статистическое вычисление невозможно или, вероятнее всего, приведет к ошибочным результатам. Для подобного рода условий используют следующие специальные методы для определения/установления расчетного значения LD50:
a) если испытание остановлено на основании критерия, приведенного в перечислении а) 7.4.3, то есть максимальная доза испытана неоднократно, или если испытание заканчивалось максимальной дозой, то сообщают, что значение LD50 превышает максимальную дозу. На основании этого классификацию завершают;
b) если все погибшие животные получали более высокие дозы, чем выжившие (или в исключительных случаях все выжившие животные получили более высокие дозы, чем погибшие, несмотря на то, что это маловероятно), то значение LD50 находится между дозами, которые были введены выжившим и погибшим животным. Такие наблюдения не дают дополнительной информации о точном значении LD50, но позволяют оценить максимальное правдоподобие при условии, что имеется значение для . Критерий остановки в перечислении b) 7.4.3 описывает одно из таких условий;
c) если выжившие и погибшие животные получили одну общую дозу, а остальные погибшие животные получили более высокие дозы, а выжившие - более низкие дозы, или наоборот, то значение LD50 равно их обобщенной дозе. При последующих испытаниях родственных веществ исследования начинают с меньшей прогрессией дозы.
Если ни одна из вышеперечисленных ситуаций не наблюдалась, то значение LD50 вычисляют с использованием метода максимального правдоподобия.
9.2.3 Вычисление максимального правдоподобия можно выполнять с использованием пакетов компьютерных программ SAS [14] ("PROC NLIN") или BMDP [15] (программа AR), приложения 1D в [3], а также других компьютерных программ. Типовые инструкции к таким пакетам программ приведены в приложениях к [6]. (Значение , используемое в программе BASIC в [6], необходимо отредактировать для отражения параметров настоящего стандарта.) Результатом работы программы является оценка log (LD50) и ее средней квадратической ошибки.
9.2.4 Правило остановки по отношению правдоподобия, приведенное в перечислении с) 7.4.3, основано на трех измерениях в процессе испытания, которые имеют форму правдоподобия (см. 9.2.1), но с разными значениями для Сравнения проводят после выполнения испытаний на каждом животном, введенном в эксперимент после шестого животного, если результаты испытаний не удовлетворяют критериям, приведенным в перечислениях а) или b) 7.4.3. Формулы для критериев отношения правдоподобия приведены в приложении С. Данные вычисления лучше всего выполнять автоматически, их можно выполнять многократно, например в виде программы электронных таблиц, приведенных в приложении С. Испытание останавливают при соответствии критерию и вычисляют значение LD50 методом максимального правдоподобия.
9.3 Вычисление доверительного интервала
9.3.1 После проведения основного испытания и вычисления значения LD50 возможно вычисление доверительных интервалов значения LD50. Любой из доверительных интервалов предоставляет ценную информацию о надежности и полезности проведенного основного испытания. Широкий доверительный интервал указывает на существование значительной неопределенности, связанной с вычисленным значением LD50. В этом случае надежность вычисленного значения LD50 является низкой, и полезность оценки значения LD50 может быть ограниченной. Узкий интервал указывает на относительно небольшую неопределенность оценки значения LD50, высокую надежность и оправданную полезность оценки значения LD50. Это означает, что при повторении основного испытания новое вычисленное значение LD50 будет близким к первоначальному значению LD50 и обе оценки окажутся близкими к истинному значению LD50.
9.3.2 В зависимости от результатов основного испытания вычисляют один из двух видов доверительных интервалов истинного значения LD50.
После проведения испытаний не менее трех разных уровней доз, когда при испытании средней дозы как минимум одно животное выжило и одно животное погибло, используется процедура вычисления на основе профиля правдоподобия для получения доверительного интервала, который, предположительно, будет включать истинное значение LD50 с достоверностью 95%. Однако фактический уровень достоверности не является точным [18], так как число животных небольшое. Правило случайной остановки повышает возможность эксперимента реагировать на изменяющиеся основные условия, а также приводит к тому, что зарегистрированный уровень достоверности и фактический уровень достоверности незначительно отличаются [19].
Если выживают все животные при определенном уровне дозы или ниже его и погибают все животные при введении следующей дозы с более высоким уровнем, интервал вычисляют следующим образом: нижним пределом является самая высокая доза, при которой все животные выжили, а его верхним пределом - доза, вызвавшая гибель всех животных. Этот интервал обозначают как "приблизительный", так как точный доверительный интервал не может быть определен. В связи с тем, что такой тип ответной реакции наблюдается при крутой зависимости кривой "доза-ответ", в большинстве случаев предполагают, что истинное значение LD50 находится в пределах вычисленного интервала или очень близко к нему. Данный интервал является относительно узким и достаточно точным в большинстве случаев практического применения.
9.3.3 В некоторых случаях указывают, что доверительные интервалы являются бесконечными, когда в качестве нижнего предела они включают ноль, или в качестве верхнего предела бесконечность, или оба интервала. Такие интервалы могут наблюдаться, например, если все животные погибают или все животные выживают. Для обработки результатов таких экспериментов требуются вычисления с применением специализированных программ (например, [20]). Достигаемые охваты таких интервалов и свойства специальной программы приведены в отчете [21].
10 Отчет об испытаниях
10.1 Отчет об испытании должен содержать информацию, приведенную в 10.1.1-10.1.6.
10.1.1 Исследуемое вещество:
- физические свойства, чистота и, при необходимости, физико-химические свойства (включая изомеризацию);
- идентификационные данные, включая номер CAS.
10.1.2 Растворитель (при использовании):
- обоснование выбора растворителя, если он не является водой.
10.1.3 Подопытные животные:
- используемые виды/линии;
- микробиологический статус животных, если известен;
- число, возраст и пол животных (в том числе, при необходимости, обоснование использования самцов вместо самок);
- источник, условия содержания, кормления и т.д.
10.1.3 Условия испытаний:
- обоснование выбора начальной дозы, коэффициент прогрессии дозы и последующие уровни доз;
- сведения о составе исследуемого вещества, включая сведения о физической форме вводимого материала;
- подробности введения исследуемого вещества, в том числе объемы и время введения дозы;
- сведения о качестве корма и воды, включая тип/источник корма и воды.
10.1.4 Результаты:
- масса тела/изменения массы тела;
- сведенные в таблицу данные о реакции и уровне дозы для каждого животного (т.е. информация о животных, имеющих симптомы интоксикации, в том числе характер, тяжесть, длительность эффектов и смертность);
- индивидуальные показатели массы тела животных в день введения дозы, с последующими недельными интервалами и во время смерти или умерщвления;
- время проявления симптомов токсичности и их реверсирование для каждого животного;
- результаты аутопсии и любые гистопатологические результаты для каждого животного, при наличии;
- данные о значении LD50;
- статистическая обработка результатов (описание использованной компьютерной программы и представление данных с использованием электронных таблиц).
10.1.5 Обсуждение и интерпретация результатов.
10.1.6 Выводы.
Приложение А
(справочное)
Процедура дозирования
A.1 Последовательность доз для основного исследования
A.1.1 Методика дозирования "вверх и вниз"
В каждой серии экспериментов животным вводят дозу по очереди, как правило, с интервалами в 48 ч. Первое животное получает дозу на ступень ниже уровня наиболее точной оценки значения LD50. Такой подход отражает корректировку тенденции к смещению от значения LD50 в направлении начальной дозы к окончательной оценке (см. 3.3). Предполагается, что общая картина результатов стабилизируется, так как для каждого последующего животного в дальнейшем доза будет скорректирована. Дополнительные рекомендации по выбору коэффициента интервала доз приведены в А.1.3.
А.1.2 Прогрессия дозы по умолчанию
После определения начальной дозы и интервала доз следует перечислить все возможные дозы, включая верхнюю границу (как правило, 2000 или 5000 мг/кг). Дозы, близкие к верхней границе, должны быть удалены из прогрессии. Ступенчатый характер исследования предусматривает, что первые несколько доз выполняют функцию саморегулирующейся последовательности. Из-за тенденции к положительному смещению при отсутствии данных о веществе рекомендуемая начальная доза составляет 175 мг/кг. При использовании процедуры по умолчанию для основного исследования введение доз начинают с дозы 175 мг/кг, выбирая дозы с коэффициентом 0,5 по логарифмической шкале. Используют дозы, включающие следующую последовательность: 1,75; 5,5; 17,5; 55; 175; 550; 2000 мг/кг или по требованию регулирующих органов -1,75; 5,5; 17,5; 55; 175; 550; 1750; 5000 мг/кг. Для некоторых высокотоксичных веществ может потребоваться включение последовательности доз с более низкими значениями.
А.1.3 При необходимости использования коэффициента прогрессии дозы, отличного от значения по умолчанию, для выбора последовательности доз можно использовать прогрессии дозы, приведенные в таблице А.1, для значений наклона кривой "доза-ответ" - кратные целым числам от 1 до 8.
Таблица А.1 - Прогрессии доз в зависимости от наклона кривой "доза-ответ" (дозы указаны в миллиграммах на килограмм массы тела)
Наклон кривой зависимости "доза-ответ" | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
0,175* | 0,175* | 0,175* | 0,175* | 0,175* | 0,175* | 0,175* | 0,175* |
- | - | - | - | - | - | 0,24 | 0,23 |
- | - | - | - | 0,275 | 0,26 | - | - |
- | - | - | 0,31 | - | - | 0,34 | 0,31 |
- | - | 0,3-75 | - | - | 0,375 | - | - |
- | - | - | - | - | - | - | 0,41 |
- | - | - | - | 0,44 | - | 0,47 | |
- | 0,55 | - | 0,55 | 0,55 | - | 0,55 | |
- | - | - | - | 0,69 | - | 0,65 | |
- | - | - | - | - | - | - | 0,73 |
- | - | 0,81 | - | - | 0,82 | - | - |
- | - | - | 0,99 | - | - | 0,91 | 0,97 |
- | - | - | - | 1,09 | 1,2 | - | - |
- | - | - | - | - | - | 1,26 | 1,29 |
1,75 | 1,75 | 1,75 | 1,75 | 1,75 | 1,75 | 1,75 | 1,75 |
- | - | - | - | - | - | 2,4 | 2,3 |
- | - | - | - | 2,75 | 2,6 | - | - |
- | - | - | 3,1 | - | - | 3,4 | 3,1 |
- | - | 3,75 | - | - | 3,75 | - | - |
- | - | - | - | 4,4 | - | - | 4,1 |
- | - | - | - | - | - | 4,7 | - |
- | 5,5 | - | 5,5 | - | 5,5 | - | 5,5 |
- | - | - | - | 6,9 | - | 6,5 | - |
- | - | - | - | - | - | - | 7,3 |
- | - | 8,1 | - | - | 8,2 | - | - |
- | - | - | 9,9 | - | - | 9,1 | 9,7 |
- | - | - | - | 10,9 | 12 | - | - |
- | - | - | - | - | - | 12,6 | 12,9 |
17,5 | 17,5 | 17,5 | 17,5 | 17,5 | 17,5 | 17,5 | 17,5 |
- | - | - | - | - | - | 24 | 23 |
- | - | - | - | 27,5 | 26 | - | - |
- | - | - | 31 | - | - | 34 | 31 |
- | - | 37,5 | - | - | 37,5 | - | - |
- | - | - | - | 44 | - | - | 41 |
- | - | - | - | - | - | 47 | - |
- | 55 | - | 55 | - | 55 | - | 55 |
- | - | - | - | - | - | 65 | - |
- | - | - | - | 69 | - | - | 73 |
- | - | 81 | - | - | 82 | - | - |
- | - | - | - | - | - | 91 | 97 |
- | - | - | - | 109 | 120 | - | - |
- | - | - | - | - | - | 126 | 129 |
175 | 175 | 175 | 175 | 175 | 175 | 175 | 175 |
- | - | - | - | - | - | 240 | 230 |
- | - | - | - | - | - | - | - |
- | - | - | - | 275 | 260 | - | - |
- | - | - | - | - | - | 340 | 310 |
- | - | 375 | - | - | 375 | - | - |
- | - | - | - | 440 | - | - | 410 |
- | - | - | - | - | - | - | - |
- | - | - | - | - | - | - | 550 |
- | - | - | - | - | - | - | - |
- | - | - | - | 690 | - | - | 730 |
- | - | - | - | - | 820 | - | - |
- | - | - | 990 | - | - | 910 | 970 |
- | - | - | - | 1090 | 1200 | - | - |
- | - | - | - | - | - | 1260 | 1290 |
1750 | 1750 | 1750 | 1750 | 1750 | 1750 | 1750 | 1750 |
- | - | - | - | - | - | 2400 | 2300 |
- | - | - | - | - | 2750 | 2600 | - |
- | - | - | 3100 | - | - | - | 3100 |
- | - | - | - | - | 3750 | 3400 | - |
- | - | - | - | - | - | - | 4100 |
5000 | 5000 | 5000 | 5000 | 5000 | 5000 | 5000 | 5000 |
* Если требуются более низкие дозы, следует продолжить прогрессию к более низким значениям дозы. | |||||||
Приложение В
(справочное)
Критерии классификации исследуемых веществ с ожидаемыми значениями LD50, превышающими 2000 мг/кг, без проведения испытаний
В.1 Критерии для категории опасности 5 по СГС предназначены для идентификации исследуемых веществ, которые имеют относительно низкую острую токсичность, но при определенных обстоятельствах могут представлять угрозу для уязвимых групп населения. Предполагается, что эти вещества имеют значение LD50 при внутрижелудочном или накожном поступлении в диапазоне от 2000 до 5000 мг/кг или эквивалентные значения доз для других способов поступления. Исследуемое вещество может быть классифицировано по категории опасности, обозначаемой 2000 мг/кг<LD50<5000 мг/кг (категория 5 в СГС), в следующих случаях:
a) если уже имеются достоверные данные, подтверждающие нахождение значения LD50 в диапазоне значений категории 5, или другие исследования на животных, или исследования токсических эффектов, проведенные на людях и указывающие на возможность возникновения серьезных проблем для их здоровья;
b) путем экстраполяции, оценки или измерения данных, если отнесение к более опасной категории не оправданно:
- и имеется надежная информация о существенных токсических эффектах для людей, или
- наблюдались случаи смертности при внутрижелудочном поступлении при испытаниях доз до категории 4, или
- экспертное заключение подтверждает существенные клинические симптомы токсичности при испытаниях доз до категории 4, за исключением диареи, пилоэрекции или неухоженного вида, или
- экспертное заключение подтверждает надежную информацию о возможности существенного острого эффекта на основании других исследований на животных.
В.2 Исследования с дозами выше 2000 мг/кг
В.2.1 Признавая необходимость защиты животных, испытания на животных в диапазоне значений категории 5 не одобряют. Следует рассматривать их проведение только в том случае, если высока вероятность того, что результаты подобного испытания будут иметь прямое отношение к защите здоровья человека.
Приложение С
(справочное)
Вычисление правила остановки по отношению правдоподобия
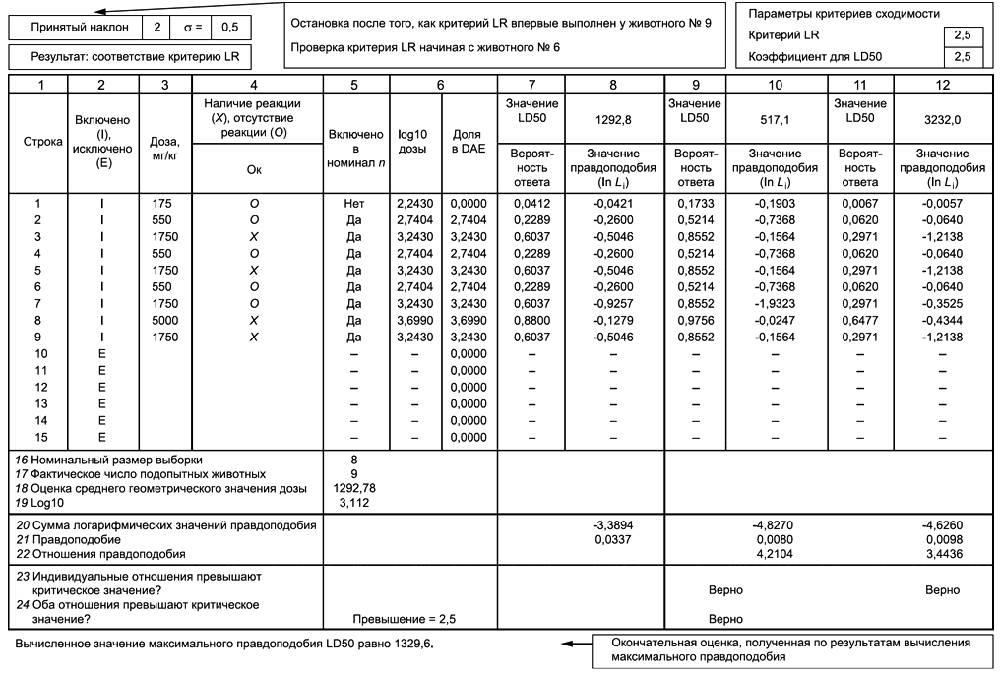
С.1 В соответствии с 7.4.3 основное испытание может быть завершено на основе одного из трех критериев остановки. Причем даже при отсутствии соответствия как минимум одному из критериев остановки введение доз прекращают при их введении 15 животным. В таблицах С.1-С.4 приведены примеры, когда исследование начиналось при отсутствии информации, поэтому использовались рекомендуемая стандартная начальная доза 175 мг/кг и рекомендуемый стандартный коэффициент прогрессии дозы, равный 3,2. Следует обратить внимание на то, что форматирование вышеуказанных таблиц носит исключительно иллюстративный характер.
С.2 В таблице С.1 показано, что основное исследование останавливают, если выжили трое животных, получивших предельную дозу 2000 мг/кг. В таблице С.2 приведена аналогичная ситуация при использовании предельной дозы 5000 мг/кг (в этих таблицах представлены ситуации, при которых результаты испытаний предельной дозы изначально считались неадекватными). В таблице С.3 отображена вероятная определенная последовательность пяти реверсирований у шести подопытных животных, позволяющая завершить испытание. В таблице С.4 представлен пример отсутствия соответствия критериям остановки, приведенным в перечислениях а) и b) 7.4.3, реверсирование отклика происходит после исследования четырех животных, и, следовательно, также должен быть оценен критерий, приведенный в перечислении с) 7.4.3.
С.3 Критерий, приведенный в перечислении с) 7.4.3, требует оценки правила остановки по отношению правдоподобия после исследования каждого животного, начиная с четвертого, испытанного после реверсирования. Вычисляют три критерия процесса испытания. Технически эти измерения динамики являются правдоподобиями, так как рекомендуются для оценки максимального правдоподобия LD50. Методика тесно связана с вычислением доверительного интервала с помощью процедуры, основанной на правдоподобии.
Таблица С.1 - Пример остановки по критерию перечисления а) 7.4.3 при введении дозы 2000 мг/кг
|
Таблица С.2 - Пример остановки по критерию перечисления а) 7.4.3 при введении дозы 5000 мг/кг
|
Таблица С.3 - Пример остановки по критерию перечисления b) 7.4.3
|
Таблица С.4 - Пример остановки по критерию перечисления c) 7.4.3
|
С.4 Методика основана на том, что при наличии достаточного количества данных точечная оценка значения LD50 должна быть более обоснованной, чем значения выше и ниже точечной оценки, при которой статистическая поддержка определена количественно с использованием правдоподобия. В связи с этим вычисляют три значения правдоподобия: вычисленное значение LD50 (называемое приблизительной оценкой или усредненной оценкой дозы) и значения ниже и выше среднего значения. За нижнюю границу принимают среднее значение LD50, деленное на 2,5, а в качестве верхней границы - умноженное на 2,5.
С.5 Значения правдоподобия сравнивают путем вычисления коэффициентов правдоподобия, затем определяют, превышают ли эти коэффициенты (LR) критическое значение. Испытание останавливают, если отношение правдоподобия для расчетной величины превышает каждое из других правдоподобий на коэффициент 2,5, который указывает на относительно строгое статистическое обоснование вычисленной величины. С этой целью вычисляют два коэффициента правдоподобия (LRs): коэффициент правдоподобия для точечной оценки и точечной оценки, деленной на 2,5, и коэффициент для точечной оценки и времени оценки 2,5.
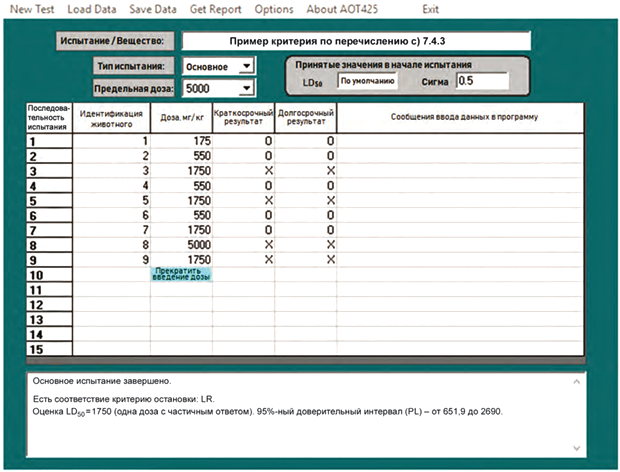
С.6 Вычисления значения LD50 выполняют с использованием соответствующей электронной таблицы со стандартными функциями вероятности. Пример вычислений представлен в таблице С.4, структура которой имитирует применение электронных таблиц. Этапы вычислений показаны на примере верхней предельной дозы - 5000 мг/кг, но этапы вычислений выполнены аналогичным образом, когда верхняя предельная доза составляет 2000 мг/кг. В качестве альтернативы имеется отдельное программное обеспечение, которое позволяет вводить данные о животных и включает в себя необходимые формулы для оценки значения LD50 и вычисления доверительного интервала. Это программное обеспечение представлено на веб-сайтах ОECD и Агентства по охране окружающей среды США, и в таблице С.5 показано изображение экрана данного программного обеспечения.
Таблица С.5 - Пример остановки по критерию перечисления c) 7.4.3
|
Гипотетический пример с использованием верхней предельной дозы 5000 мг/кг представлен в таблице С.4.
С.7 В гипотетическом примере с использованием верхней предельной дозы 5000 мг/кг соответствие критерию остановки LR наблюдается после испытания девяти животных. Первое реверсирование происходит при испытании третьего животного. Критерий остановки LR проверяют, когда после реверсирования проведены испытания на еще четырех животных. В этом примере четвертое животное, испытанное после реверсирования, фактически является седьмым. Поэтому для этого примера вычисления с использованием электронных таблиц необходимы только после исследования седьмого животного, и данные могут быть введены в этот промежуток времени. Впоследствии критерий остановки LR может быть проверен после испытания седьмого, восьмого и девятого животных. В этом примере соответствие критерию остановки выполнено после испытания девятого животного.
Этап А Ввод информации о зависимости "доза-ответ" для каждого животного
Графа 1. Нумеруют строки 1-15. Испытанию можно подвергнуть не более 15 животных.
Графа 2. В этой графе помещают букву "I" для каждого подопытного животного.
Графа 3. Вводят дозу, полученную каждым i-м животным.
Графа 4. Указывают наличие реакции животного (X) или отсутствие реакции (О).
Этап В Номинальный и фактический размер выборки
С.8 Номинальная выборка включает двух животных, которые показывают первое реверсирование (второе и третье животные в таблице С.4), затем учитывают всех животных, исследованных впоследствии. В графе 5 указано, внесено ли данное животное в номинальную выборку.
Номинальный размер выборки (номинал n) представлен в строке 16 таблицы С.4. Это - число животных в номинальной выборке. В приведенном примере номинал n равен 8.
Фактическое число подопытных животных приведено в строке 17.
Этап C Оценка приблизительного значения LD50
С.9 В качестве приблизительной оценки значения LD50, по которой можно оценить результат, использовано среднее геометрическое значение дозы для животных в текущей номинальной выборке (в таблице С.4 - "оценка среднего геометрического значения дозы"). Данная оценка обновляется после каждого исследованного животного. Среднее геометрическое значение ограничено номинальной выборкой, обеспечивающей небольшой набор значений начальной дозы, которая может генерировать начальную последовательность ответов или начальную последовательность отсутствия ответов. (При этом результаты для всех животных используют при вычислении правдоподобия для окончательного вычисления значения LD50.)
Примечание - Средним геометрическим значением n чисел является произведение n чисел в степени 1/n.
Среднее геометрическое значение дозы приведено в строке 18 (то есть 175·550·...·1750)![]() =1292,78.
=1292,78.
В строке 19 приведен десятичный логарифм значения по строке 18 (например, log![]() 1292,8=3,122).
1292,8=3,122).
Этап D Оценка правдоподобия приблизительного значения LD50
С.10 Правдоподобие является статистической мерой того, насколько полученные данные соответствуют вычисленному значению LD50 или другого параметра. Значения отношения правдоподобия могут использоваться для сравнения того, насколько подтверждающие данные соответствуют разным вычисленным значениям LD50.
С.11 Графа 8. Вычислено правдоподобие для приблизительного значения LD50 по этапу C. Правдоподобие (строка 21) является произведением значений правдоподобия для отдельных животных (см. 9.2.1). Значение правдоподобия для i-го животного обозначают ![]() .
.
С.12 Графа 7. Вводят оценку вероятности ответа на дозу ![]() , обозначаемую как
, обозначаемую как ![]() . Значение
. Значение ![]() вычисляют по кривой зависимости "доза-ответ". Параметрами кривой зависимости "доза-ответ" с использованием пробит-метода являются наклон и значение LD50, поэтому требуются значения для каждого из этих параметров. Для LD50 используют среднее геометрическое значение доз из строки 18. Для наклона в данном примере используют значение по умолчанию 2. Для вычисления вероятности ответа
вычисляют по кривой зависимости "доза-ответ". Параметрами кривой зависимости "доза-ответ" с использованием пробит-метода являются наклон и значение LD50, поэтому требуются значения для каждого из этих параметров. Для LD50 используют среднее геометрическое значение доз из строки 18. Для наклона в данном примере используют значение по умолчанию 2. Для вычисления вероятности ответа ![]() можно использовать следующие процедуры:
можно использовать следующие процедуры:
- вычисляют десятичный логарифм дозы ![]() (графа 6);
(графа 6);
- для каждого животного вычисляют z-показатель, обозначаемый как ![]() (не показан в таблице С.4) по следующим формулам:
(не показан в таблице С.4) по следующим формулам:
=1/наклон;
![]() .
.
Например, для первого животного (строка 1)
=1/2
![]() =(2,243-3,112)/0,500=-1,738;
=(2,243-3,112)/0,500=-1,738;
- для i-й дозы оценка вероятности ответа составляет:
![]() ,
,
где F - кумулятивная функция распределения для стандартного нормального распределения (то есть нормальное распределение со средним значением 0 и дисперсией 1).
Например, для первого животного (строка 1)
![]() =F(-1,738)=0,0412.
=F(-1,738)=0,0412.
Функцию F (или наиболее близкую), как правило, используют для нормального распределения в статистических таблицах, но функция широко доступна в виде специальных электронных таблиц. Она известна под разными наименованиями, например функция @NORMAL в Lotus 1-2-3 [22] и функция @NORMDIST в Excel [23]. Для того чтобы убедиться в том, что функция, имеющаяся в программном обеспечении, использована правильно, можно проверить известные значения, такие как F (1,96)0,975 или F (1,64)
0,95.
С.13 Графа 8. Вычисляют натуральный логарифм влияния правдоподобия [ln(Li)], где Li - вероятность ответа, которая фактически наблюдалась для i-го животного:
- отвечающие (реагирующие) животные: ![]() ;
;
- не отвечающие (нереагирующие) животные: ![]() .
.
Следует обратить внимание на то, что в данном случае используют натуральный логарифм (In), тогда как ранее - логарифм с основанием 10 (десятичный логарифм).
Приведенные выше этапы выполнены для каждого животного.
Строка 20. Сумма логарифмических значений правдоподобия в графе 8.
Строка 21. Вычисляют правдоподобие, используя экспоненциальную функцию применительно к логарифмическому значению правдоподобия в строке 20 [например, ехр(-3,389)=е![]() =0,0337].
=0,0337].
Этап Е Вычисление правдоподобия для двух значений доз выше и ниже приблизительного значения LD50
C.14 Если данные позволяют выполнить точное вычисление, то предполагается, что правдоподобие должно быть высоким, если вычисление является обоснованной оценкой значения LD50 относительно правдоподобия для значений, удаленных от возможного значения. Сравнивают правдоподобие среднего геометрического значения доз (1292,8, строка 18) со значениями, отличающимися на коэффициент 2,5 от указанного значения (то есть 1292,8·2,5 и 1292,8/2,5). Вычисления (результаты приведены в графах 9-12) выполняют аналогично описанным выше, за исключением того, что для значения LD50 вместо значения 1292,8 используют значения 517,1 (равное 1292,8/2,5) и 3232,0 (равное 1292,8·2,5). Правдоподобия и логарифмы правдоподобия отображены в строках 20-21.
Этап F Вычисление отношения правдоподобия
С.15 Для вычисления двух отношений правдоподобия (строка 22) используют три значения правдоподобия (строка 21). Отношение правдоподобия используют для сравнения статистического обоснования оценки 1292,8 с обоснованием каждого другого значения - 517,1 и 3232,0. Получают два отношения правдоподобия (LR):
LR1=[правдоподобие 1292,8]/[правдоподобие 517,1]=0,0337/0,0880=4,21
и
LR2=[правдоподобие 1292,8]/[правдоподобие 3232,0]=0,0337/0,0098=3,44.
Этап G Определение отношения правдоподобия и критического значения
С.16 Высокие значения отношения правдоподобия показывают высокую обоснованность вычисленного значения LD50. Оба отношения правдоподобия, вычисленные на этапе F (4,21 и 3,44), превышают критическое значение отношения правдоподобия, которое составляет 2,5. Поэтому значение отношения правдоподобия удовлетворяет критерию остановки (LR), и испытание останавливают. Соответствие критерию LR подтверждает запись "TRUE" (верно) в строке 24 и над электронной таблицей.
Приложение ДА
(справочное)
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа OECD Test N 425:2008 |
Введение (1-3) | Введение |
1 Область применения | - |
2 Термины и определения | 4 |
3 Основные положения (5-11) | Основные положения |
4 Правила исследования предельной дозы (12) | Правила исследования предельной дозы |
5 Правила основного исследования (13, 14) | Правила основного исследования |
6 Сущность метода (15-19) | Сущность метода |
6.2 Условия содержания и кормления | Условия содержания и кормления |
6.3 Подготовка животных | Подготовка животных |
6.4 Подготовка доз | Подготовка доз |
7 Проведение испытаний (20-35) | Проведение испытаний |
7.2 Испытание предельной дозы и основной дозы | Испытание предельной дозы и основной дозы |
7.3 Испытание предельной дозы | Испытание предельной дозы |
7.3.2 Испытание предельной дозы 5000 мг/кг | Испытание предельной дозы 5000 мг/кг |
7.4 Основное испытание | Основное испытание |
8 Наблюдения (36-39) | Наблюдения |
8.3 Масса тела | Масса тела |
8.4 Патология | Патология |
9 Данные и отчетность (40-47) | Данные и отчетность |
9.2 Вычисление значения LD50 для основного испытания | Вычисление значения LD50 для основного испытания |
9.3 Вычисление доверительного интервала | Вычисление доверительного интервала |
10 Отчет об испытаниях (48) | Отчет об испытаниях |
* | Библиография |
** | Приложение 1 Термины и определения |
Приложение A Процедура дозирования (приложение 2) | Приложение 2 Процедура дозирования |
Приложение B Критерии классификации исследуемых веществ с ожидаемыми значениями LD50, превышающими 2000 мг/кг, без проведения испытаний (приложение 4) | Приложение 3 Вычисление правила остановки по отношению правдоподобия |
Приложение C Вычисление правила остановки по отношению правдоподобия (приложение 3) | Приложение 4 Критерии классификации исследуемых веществ с ожидаемыми значениями LD50, превышающими 2000 мг/кг, без проведения испытаний |
Приложение ДА Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа | - |
Библиография | - |
* Данный раздел размещен в конце настоящего стандарта для приведения в соответствие с требованиями ГОСТ 1.5. ** Термины и определения перечислены в разделе 2 для приведения в соответствие с требованиями ГОСТ 1.5. Примечание - После заголовков разделов (подразделов) настоящего стандарта приведены в скобках номера аналогичных параграфов международного документа. | |
Библиография
[1] | Dixon W.J. and A.M.Mood. (1948). A Method for Obtaining and Analyzing Sensitivity Data. J.Amer. Statist. Assoc., 43, 109-126 |
[2] | Dixon W.J. The Up-and-Down Method for Small Samples (1965). J.Amer. Statist. Assoc. 60, 967-978 |
[3] | Dixon W.J. (1991). Staircase Bioassay: The Up-and-Down Method. Neurosci. Biobehav. Rev., 15, 47-50 |
[4] | Dixon W.J. (1991) Design and Analysis of Quantal Dose-Response Experiments (with Emphasis on Staircase Designs). Dixon Statistical Associates, Los Angeles CA, USA |
[5] | Bruce R.D. (1985). An Up-and-Down Procedure for Acute Toxicity Testing. Fundam. Appl. Tox., 5, 151-157 |
[6] | ASTM (1987). E 1163-87, Standard Test Method for Estimating Acute Oral Toxicity in Rats. American Society for Testing and Materials, Philadelphia Pa, USA |
[7] | Lipnick R.L., Cotruvo J.A., Hill R.N., Bruce R.D., Stitzel K.A., Walker A.P, Chu I., Goddard M., Segal L., Springer J.A., and Myers R.C. (1995). Comparison of the Up-and-Down, Conventional LD50 and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol., 33, 223-231 |
[8] | Choi S.C. (1990). Interval estimation of the LD50 based on an up-and-down experiment. Biometrics 46, 485-492 |
[9] |
|
[10] | Hsi B.P (1969). The multiple sample up-and-down method in bioassay. J.Amer. Statist. Assoc. 64, 147-162 |
[11] | Noordwijk van A.J. and van Noordwijk J. (1988). An accurate method for estimating an approximate lethal dose with few animals, tested with a Monte Carlo procedure. Arch. Toxicol. 61, 333-343 |
[12] | OECD (2000). Guidance Document on Acute Oral Toxicity. Environmental Health and Safety Monograph Series on Testing and Assessment No 24 |
[13] | OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19 |
[14] | OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmentla Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and Working Party on Chemicals in November 1998, Part 2, pg 11. [//webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN- |
[15] | SAS Institute Inc. (1990). SAS/STAT® User's Guide. Version 6, Fourth |
[16] | BMDP Statistics Software, Inc. (1990). BMDP Statistical Software Manual. W.J.Dixon, Chief Ed. 1990 rev. or later. University of California Press, Berkeley, CA, USA |
[17] | Chan PK. and Hayes A.W. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W.Hayes, Editor. Raven Press, Ltd., New York, USA |
[18] | Rosenberger W.F., Flournoy N. and Durham S.D. (1997). Asymptotic normality of maximum likelihood estimators from multiparameter response-driven designs. Journal of Statistical Planning and Inference 60, 69-76 |
[19] | Jennison C. and Turnbull B.W. 2000. Group Sequential Methods with Application to Clinical Trials. Chapman&Hall/CRC: Boca Raton, FL. USA |
[20] | (20) Acute Oral Toxicity (OECD Test Guideline 425) Statistical Programme (AOT 425 StatPgm). Version: 1.0, 2001 [//www.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-document-524-nodirectorate-no-24-6775-8,FF.html] |
[21] | Westat. 2001. Simulation Results from the AOT425StatPgm Program. Report prepared for U.S. E.PA. under Contract 68-W7-0025, Task Order 5-03 |
[22] | Lotus Development Corporation. (1999). Lotus® 1-2-3. Version 9.5, Millenium Edition. Cambridge, MA, USA |
[23] | Microsoft Corporation. (1985-1997). Microsoft® Excel Version 5.0 or later. Seattle, WA, USA |
УДК 615.038/615.012/615.014/615.2:006.354 | МКС | 75.080 | MOD |
11.020 | |||
11.120.01 | |||
Ключевые слова: методы испытания по воздействию химической продукции на организм человека, испытания по оценке острой токсичности при пероральном поступлении, метод "вверх и вниз" | |||
Электронный текст документа
и сверен по:
, 2019