ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТР
ИСО 14851— 2022
ПЛАСТМАССЫ
Определение способности к полному аэробному биологическому разложению в водной среде. Метод измерения потребления кислорода в закрытом респирометре
(ISO 14851:2019, Determination of the ultimate aerobic biodegradability of plastic materials in an aqueous medium — Method by measuring the oxygen demand in a closed respirometer, IDT)
Издание официальное
Москва Российский институт стандартизации 2022
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением «Российский институт стандартизации» (ФГБУ «РСТ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 230 «Пластмассы, полимерные материалы, методы их испытаний»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 23 сентября 2022 г. № 989-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 14851:2019 «Определение способности пластмасс к полному аэробному биологическому разложению в водной среде. Метод измерения потребления кислорода в закрытом респирометре» (ISO 14851:2019 «Determination of the ultimate aerobic biodegradability of plastic materials in an aqueous medium — Method by measuring the oxygen demand in a closed respirometer», IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5—2012 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
6 Некоторые элементы настоящего стандарта могут являться объектами патентных прав
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. №162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2019
© Оформление. ФГБУ «РСТ», 2022
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные положения
5 Испытательная среда
6 Реактивы
7 Аппаратура
8 Проведение испытаний
9 Вычисления и интерпретация результатов
10 Достоверность результатов испытаний
11 Протокол испытаний
Приложение А (справочное) Теоретическое потребление кислорода (ThOD)
Приложение В (справочное) Корректировка значений BOD на влияние нитрификации
Приложение С (справочное) Принцип работы закрытого манометрического респирометра
Приложение D (справочное) Вариант двухфазного респирометрического испытания в закрытом сосуде
Приложение Е (справочное) Пример определения углеродного баланса
Приложение F (справочное) Пример определения количества и молекулярной массы нерастворимого в воде полимера, оставшегося в конце испытания на биологическое разложение ... 19
Приложение G (справочное) Пример определения СО2, поглощенного абсорбентом
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Библиография
Введение
С ростом использования пластмасс их вторичное использование и утилизация стали серьезной проблемой. В первую очередь следует способствовать вторичному использованию. Однако повторное использование отходов пластмасс труднодоступно. Например, пластмассовый мусор, который поступает в основном от потребителей, сложно повторно использовать полностью. Дополнительными примерами пластмасс, которые сложно повторно использовать, являются рыболовные снасти, микрошарики из пластмасс в продуктах личной гигиены и водорастворимые полимеры. Эти пластмассы имеют тенденцию просачиваться из замкнутых циклов утилизации отходов в окружающую среду. В настоящее время появляются биоразлагаемые пластмассы как один из возможных вариантов решения таких экологических проблем. Предполагается, что изделия из пластмасс, которые отправляются на предприятия по компостированию, являются потенциально биоразлагаемыми. Следовательно, очень важно определить потенциальную способность таких материалов к биологическому разложению и получить данные об их способности к биологическому разложению в естественной среде.
ГОСТ Р ИСО 14851—2022
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПЛАСТМАССЫ
Определение способности к полному аэробному биологическому разложению в водной среде.
Метод измерения потребления кислорода в закрытом респирометре
Plastics. Determination of the ultimate aerobic biodegradability in an aqueous medium. Method by measuring the oxygen demand in a closed respirometer
Дата введения — 2023—03—01
ПРЕДУПРЕЖДЕНИЕ — Сточные воды, активный ил, почва и компост могут содержать потенциально патогенные организмы. Поэтому при обращении с ними следует соблюдать соответствующие меры предосторожности. С токсичными испытуемыми соединениями и соединениями, свойства которых неизвестны, следует обращаться с осторожностью.
1 Область применения
Настоящий стандарт устанавливает метод измерения потребления кислорода в закрытом респирометре для определения степени аэробной биоразлагаемости пластмасс, включая содержащиеся в них добавки. В лабораторных условиях испытуемый материал подвергают воздействию инокулята из активного ила в водной среде.
При использовании в качестве инокулята неадаптированного активного ила испытание моделирует процессы биоразложения, происходящие в обычной водной среде; метод с использованием смешанного или предварительно экспонированного инокулята используют для исследования потенциальной биоразлагаемости испытуемого материала.
Условия испытаний, используемые в настоящем стандарте, могут не соответствовать оптимальным условиям, обеспечивающим максимальное биоразложение, но целью разработки настоящего стандарта является определение потенциальной способности пластмасс к биоразложению или определение их способности к биоразложению в естественной среде.
Метод позволяет улучшить оценку способности к биологическому разложению путем вычисления углеродного баланса (при необходимости, см. приложение Е).
Метод применим к следующим материалам:
- природным и/или синтетическим полимерам, сополимерам или их смесям;
- пластмассам, содержащим такие добавки, как пластификаторы, красители или другие соединения;
- водорастворимым полимерам;
- материалам, которые в условиях испытания не подавляют микроорганизмы, присутствующие в инокуляте. Ингибирующее действие можно определить с помощью контроля (проверки) ингибирования или другим подходящим методом (см., например, [2]). Если испытуемый материал ингибирует инокулят, то при проведении испытаний допускается использовать более низкую концентрацию материала, другой инокулят или предварительно экспонированный инокулят.
Издание официальное
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт [для датированной ссылки применяют только указанное издание ссылочного стандарта, для недатированной — последнее издание (включая все изменения)]:
ISO 8245, Water quality — Guidelines for the determination of total organic carbon (TOC) and dissolved organic carbon (DOC) [Качество воды. Рекомендации по определению общего органического углерода (ТОС) и растворенного органического углерода (DOC)]
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
ИСО и МЭК поддерживают терминологические базы данных, используемые в стандартизации по следующим адресам:
- платформа онлайн-просмотра ИСО: доступна по адресу https://www.iso.org/obp
- Электропедия МЭК: доступна по адресу http:/www.electropedia.org/
3.1 полное аэробное биологическое разложение (ultimate aerobic biodegradation): Разложение органического соединения микроорганизмами в присутствии кислорода на углекислый газ, воду и минеральные соли других присутствующих элементов (минерализация) плюс новая биомасса.
3.2 активный ил (activated sludge): Смесь органических материалов и биомассы, полученная при аэробной очистке сточных вод в результате роста бактерий и других микроорганизмов в присутствии растворенного кислорода.
3.3 содержание взвешенных твердых частиц в активном иле (concentration of suspended solids in an activated sludge): Масса твердых частиц, полученных путем фильтрации или центрифугирования известного объема активного ила (3.2) и высушивания при температуре приблизительно 105 °C до постоянной массы.
3.4 биохимическое потребление кислорода; BOD (biochemical oxygen demand, BOD): Массовая концентрация растворенного кислорода, потребляемого в определенных условиях при аэробном биологическом окислении химического соединения или органического вещества в воде.
Примечание 1 — Выражают в миллиграммах поглощенного кислорода на миллиграмм или грамм испытуемого соединения.
3.5 теоретическое потребление кислорода; ThOD (theoretical oxygen demand, ThOD): Теоретическое максимальное количество кислорода, необходимое для полного окисления химического соединения, вычисленное по молекулярной формуле.
Примечание 1 — Выражают в миллиграммах поглощенного кислорода на миллиграмм или грамм испытуемого соединения.
3.6 общий органический углерод; TOC (total organic carbon, ТОС): Количество углерода, содержащегося в органическом соединении.
3.7 растворенный органический углерод; DOC (dissolved organic carbon, DOC): Часть органического углерода в воде, которая не может быть удалена с помощью установленного разделения фаз, например центрифугированием при 40000 м ■ с-2 в течение 15 мин или фильтрацией с использованием мембранного фильтра с пористой мембраной с диаметром пор от 0,2 до 0,45 мкм.
3.8 индукционный период (фаза отставания) (lag phase): Время от начала испытания до достижения адаптации и/или отбора разлагающих микроорганизмов и повышения степени биологического разложения химического соединения или органического вещества приблизительно до 10 % от максимального уровня биологического разложения (3.9), измеряемое в днях.
3.9 максимальный уровень биологического разложения (maximum level of biodegradation): Степень биологического разложения химического соединения или органического вещества в ходе испытания, выше которой не происходит дальнейшего биологического разложения во время испытания, измеряемая в процентах.
3.10 фаза биологического разложения (biodegradation phase): Время от окончания индукционного периода (3.8) испытания до достижения приблизительно 90 % максимального уровня биологического разложения (3.9), измеряемое в днях.
3.11 фаза плато (plateau phase): Время от окончания фазы биологического разложения (3.10) до конца испытания, измеряемое в днях.
3.12 предварительное экспонирование (pre-exposure): Предварительная инкубация инокулята в присутствии испытуемого химического соединения или органического вещества с целью повышения способности инокулята к биологическому разложению исследуемого материала путем адаптации и/или подбора микроорганизмов.
3.13 предварительное кондиционирование (pre-conditioning): Предварительная инкубация инокулята в условиях последующего испытания при отсутствии испытуемого химического соединения или органического вещества с целью оптимизации испытания путем акклиматизации микроорганизмов к условиям испытания.
4 Основные положения
Биоразлагаемость пластмасс определяют с использованием аэробных микроорганизмов в водной системе. Испытательная смесь содержит неорганическую среду, органический испытуемый материал (единственный источник углерода и энергии) с концентрацией органического углерода от 100 до 2000 мг/дм3 и активный ил в качестве инокулята. Смесь перемешивают в закрытых колбах на респирометре не более 2 мес. Выделившийся диоксид углерода абсорбируется подходящим поглотителем в свободном пространстве колбы. Потребление кислорода (BOD) определяют, например, путем измерения количества кислорода, необходимого для поддержания постоянного объема газа в колбе респирометра, или путем измерения изменения объема или давления (или их комбинации) автоматически или вручную. Пример респирометра приведен в приложении С. В качестве альтернативы допускается использовать двухфазную версию с закрытым сосудом, приведенную в [3] (см. приложение D).
Уровень биоразложения определяют путем сравнения BOD с теоретическим количеством (ThOD) и выражают в процентах. Необходимо учитывать влияние возможных процессов нитрификации на BOD. Результатом испытания является максимальный уровень биоразложения, определяемый по фазе плато кривой биоразложения. При необходимости, для получения дополнительной информации о биоразложении (см. приложение Е) может быть вычислен углеродный баланс. При этом в конце испытания также может быть определен поглощенный в адсорбере диоксид углерода для получения дополнительной информации о биоразложении (см. приложение G).
В отличие от метода [6], используемого для разных органических соединений, настоящий стандарт специально предназначен для определения способности пластмасс к биологическому разложению. Необходимые специальные требования влияют на выбор инокулята и испытательной среды, и существует возможность улучшить оценку биоразлагаемости путем вычисления углеродного баланса.
5 Испытательная среда
Инкубацию следует проводить в темноте или при рассеянном свете в помещении, не содержащем паров веществ, ингибирующих микроорганизмов, в котором поддерживается постоянная температура, предпочтительно от 20 °C до 25 °C с точностью до ± 1 °C или при другой подходящей температуре в зависимости от используемого инокулята и оцениваемой окружающей среды.
6 Реактивы
Используют реактивы квалификации ч. д. а.
6.1 Дистиллированная или деионизированная вода
Используют дистиллированную или деионизированную воду, не содержащую токсичных веществ (особенно меди) с содержанием DOC менее 2 мг/дм3.
6.2 Испытательная среда
В зависимости от цели испытания допускается использовать разные испытательные среды. Например, при моделировании природных условий используют стандартную испытательную среду (6.2.1). При использовании испытуемого материала в более высоких концентрациях используют оптимизированную испытательную среду (6.2.2) с более высокой буферной емкостью и концентрацией питательных веществ.
6.2.1 Стандартная испытательная среда
6.2.1.1 Раствор А
Растворяют следующие компоненты в воде (6.1) и доводят объем раствора до 1000 см3:
безводный дигидрофосфат калия (КН2РО4) — 8,5 г;
безводный гидрофосфат калия (К2НРО4) — 21,75 г;
дигидрат гидрофосфата натрия (Na2HPO4 • 2Н2О) — 33,4 г;
хлорид аммония (NH4CI) — 0,5 г.
Правильность состава раствора можно проверить измерением значения pH, которое должно быть 7,4.
6.2.1.2 Раствор В
Растворяют 22,5 г гептагидрата сульфата магния (MgSO4 • 7Н2О) в воде (6.1) и доводят объем раствора до 1000 см3.
6.2.1.3 Раствор С
Растворяют 36,4 г дигидрата хлорида кальция (СаС12 • 2Н2О) в воде (6.1) и доводят объем раствора до 1000 см3.
6.2.1.4 Раствор D
Растворяют 0,25 г гексагидрата хлорида железа (III) (FeCI3-6H2O) в воде (6.1) и доводят объем до 1000 см3.
Этот раствор готовят перед использованием, чтобы избежать образования осадка, или добавляют одну каплю концентрированной соляной кислоты (HCI) или одну каплю 0,4 г/дм3 водного раствора эти-лендиаминтетрауксусной кислоты (EDTA).
6.2.1.5 Приготовление испытательной среды
Для приготовления 1 дм3 испытательной среды, добавляют приблизительно в 500 см3 воды (6.1) следующие растворы:
-10 см3 раствора А;
- по 1 см3 каждого растворов от В до D.
Доводят объем раствора водой (6.1) до 1000 см3. Перед каждым использованием готовят свежую испытательную среду. Растворы от А до С могут храниться не более 6 мес в темноте при температуре окружающей среды.
6.2.2 Оптимизированная испытательная среда
Данная оптимизированная среда обладает высокой буферизацией и содержит больше неорганических биогенных веществ. Это необходимо для поддержания постоянного значения pH в системе во время испытания даже при высоких концентрациях испытуемого материала. Среда содержит приблизительно 2400 мг/дм3 фосфора и 50 мг/дм3 азота и поэтому подходит для концентраций органического углерода в исследуемом материале до 2000 мг/дм3. При использовании более высоких концентраций испытуемого материала увеличивают содержание азота, для обеспечения соотношения C:N примерно 40:1.
6.2.2.1 Раствор А
Растворяют следующие компоненты в воде (6.1) и доводят объем раствора до 1000 см3:
безводный дигидрофосфат калия (КН2РО4) — 37,5 г;
дигидрат гидрофосфата натрия (Na2HPO4 • 2Н2О) — 87,3 г;
хлорид аммония (NH4CI) — 2,0 г.
6.2.2.2 Раствор В
Растворяют 22,5 г гептагидрата сульфата магния (MgSO4 • 7Н2О) в воде (6.1) и доводят объем раствора до 1000 см3.
6.2.2.3 Раствор С
Растворяют 36,4 г дигидрата хлорида кальция (СаС12 • 2Н2О) в воде (6.1) и доводят объем раствора до 1000 см3.
6.2.2.4 Раствор D
Растворяют 0,25 г гексагидрата хлорида железа (III) (FeCI3 • 6Н2О) в воде (6.1) и доводят объем раствора до 1000 см3 (см. второй абзац 6.2.1.4).
6.2.2.5 Раствор Е (раствор микроэлементов, необязательно)
Растворяют в 10 см3 водного раствора HCI (25%, 7,7 моль/дм3) в следующей последовательности: 70 MrZnCI2,100 мгМпС12 • 4Н20,6 мгН3ВО3,190 мгСоС12 ■ 6Н2О, 3 мгСиС12 • 2Н20,240 мг NiCI2 • 6Н2О, 36 мг Na2MoO4 ■ 2Н2О, 33 мг Na2WO4 • 2Н2О и 26 мг Na2SeO3 • 5Н2О. Доводят объем раствора до 1000 см3 водой (6.1).
6.2.2.6 Раствор F (витаминный раствор, необязательно)
Растворяют в 100 см3 воды (6.1) 0,6 мг биотина, 2,0 мг ниацинамида, 2,0 мг п-аминобензоата, 1,0 мг пантотеновой кислоты, 10,0 мг гидрохлорида пиридоксаля, 5,0 мг цианокобаламина, 2,0 мг фолиевой кислоты, 5,0 мг рибофлавина, 5,0 мг DL-тиоктовой кислоты и 1,0 мг дихлорида тиамина или используют раствор 15 мг дрожжевого экстракта в 100 см3 воды (6.1). Для стерилизации раствор фильтруют через мембранный фильтр (см. 7.4).
Растворы Е и F необязательны и не требуются при использовании достаточной концентрации инокулята, например активного ила. Рекомендуется готовить порции по 1см3 и хранить в холодильнике до использования.
6.2.2.7 Подготовка
Для приготовления 1 дм3 испытательной среды к 800 см3 воды (6.1) добавляют приблизительно:
-100 см3 раствора А;
- по 1 см3 каждого раствора В, С, D и, необязательно, Е и F.
Доводят объем раствора водой (6.1) до 1000 см3 и измеряют значение pH.
Правильный состав испытательной среды можно проверить путем измерения значения pH, которое должно быть 7,0 ± 0,2.
6.3 Раствор пирофосфата натрия
Растворяют 2,66 г безводного пирофосфата натрия (Na4P2O7) в воде (6.1) и доводят объем раствора до 1000 см3.
6.4 Поглотитель углекислого газа
Предпочтительно используют гранулированную натронную известь или другой подходящий абсорбент.
7 Аппаратура
Следует убедиться, что стеклянная посуда тщательно очищена и не содержит органических или токсичных веществ.
Требуется лабораторное оборудование, а также следующее.
7.1 Закрытый респирометр
Закрытый респирометр, включающий испытательные сосуды (стеклянные колбы), оснащенные мешалками и другим необходимым оборудованием, размещаемый в комнате с постоянной температурой или в термостатируемом аппарате (например,водяной бане). См. пример в приложении С.
Примечание — Подходит респирометр любого типа, обеспечивающий достаточную точность определения биохимического потребления кислорода, предпочтительно использовать устройство, которое измеряет и автоматически непрерывно пополняет потребляемый кислород таким образом, чтобы в процессе разложения не возникало дефицита кислорода и подавления микробной активности. Вместо обычного респирометра допускается использовать двухфазную версию с закрытым сосудом (см. приложение D).
7.2 Аналитическое оборудование для измерения общего органического углерода (ТОС) и растворенного органического углерода (DOC) в соответствии с ИСО 8245.
7.3 Аналитическое оборудование для измерения содержания нитратов и нитритов.
Сначала рекомендуется провести качественный анализ для определения возможности нитрификации. При подтверждении наличия нитрата/нитрита в среде проводят количественное определение с использованием подходящего метода (например, ионной хроматографии).
7.4 Центрифуга или фильтрующее устройство с мембранными фильтрами (размером пор 0,45 мкм), которые не адсорбируют и не выделяют в значительной степени органический углерод.
7.5 Аналитические весы (обычное лабораторное оборудование).
7.6 pH-метр (обычное лабораторное оборудование).
8 Проведение испытаний
8.1 Испытуемый материал
Испытуемый материал должен быть взвешен и содержать достаточное количество углерода для получения BOD, который может быть адекватно измерен с помощью используемого респирометра. Вычисляют ThOD по химической формуле или определяют элементным анализом (см. приложение А) и ТОО (применяя, например, ИСО 8245). Следует использовать концентрацию испытуемого материала не менее 100 мг/дм3, соответствующую ThOD приблизительно 170 мг/дм3 или ТОС приблизительно 60 мг/дм3. Более низкие концентрации используют, если чувствительность респирометра достаточна. Максимальное количество испытуемого материала ограничено поступлением кислорода в респирометр и используемой испытательной средой. При использовании оптимизированной испытательной среды (6.2.2) концентрация испытуемого материала должна быть такой, чтобы ТОС не превышало приблизительно 2000 мг/дм3, то есть отношение C:N должно быть примерно 40:1. При необходимости проверки более высоких концентраций, увеличивают количество азота в испытательной среде.
При необходимости моделирования процесса биоразложения в природных условиях рекомендуется использовать стандартную испытательную среду и концентрацию испытуемого материала 100 мг/дм3.
Испытуемый материал предпочтительно использовать в порошкообразном виде, но его также можно вводить в виде пленок, кусочков, фрагментов или профильных изделий. Форма и конфигурация испытуемого материала могут влиять на его биоразлагаемость. Если необходимо сравнить разные виды пластмасс, предпочтительно использовать аналогичные формы. Если испытуемый материал используют в виде порошка, следует использовать частицы известного узкого диапазона размеров. Рекомендуется использовать гранулометрический состав с диаметром не более 250 мкм. Кроме того, от формы испытуемого материала может зависеть размер используемого испытательного оборудования. Следует убедиться, что из-за условий испытаний, например типа используемого механизма перемешивания, не происходит существенных механических аберраций. Обработка испытуемого материала (например, использование порошка в случае композитов) не должна существенно влиять на поведение материала при разложении. При необходимости регистрируют содержание водорода, кислорода, азота, фосфора и серы и молекулярную массу испытуемого полимера, используя, например, жидкостную эксклюзионную хроматографию (например, по [1] или любой другой применимый стандартный метод). Рекомендуется проводить испытания, используя пластмассы, не содержащие добавок, таких как пластификаторы. Если материал содержит такие добавки, то для оценки биоразлагаемости самого полимера будет необходима информация о биоразлагаемости добавок.
Подробная информация об обращении с плохо растворимыми в воде веществами приведена в [7].
8.2 Эталонный материал
В качестве эталонного материала используют анилин и/или четко охарактеризованный биоразлагаемый полимер (например, порошок микрокристаллической целлюлозы, беззольные целлюлозные фильтры или поли-р-гидроксибутират). При возможности, ТОС, форма и размер должны быть сопоставимы с испытуемым материалом.
В качестве отрицательного контроля допускается использовать биологически неразлагаемый полимер (например, полиэтилен) в таком же виде, что и испытуемый материал.
8.3 Подготовка инокулята
Подходящим источником инокулята является активный ил с очистных сооружений, предназначенных для очистки преимущественно бытовых сточных вод. Его получают в активной аэробной среде, и он доступен набольших географических площадях, где необходимо проводить испытания широкого спектра пластмасс. При необходимости определения биоразложения в конкретной системе обработки отходов следует отбирать инокулят из этой окружающей среды.
Отбирают пробу активного ила на хорошо работающей установке по очистке сточных вод или на лабораторной установке предприятия, обрабатывающего преимущественно бытовые сточные воды. Образец тщательно перемешивают и хранят в аэробных условиях. Рекомендуется использовать его в день сбора (но не позднее 72 ч).
Перед использованием определяют содержание взвешенных веществ (например, по [4]). При необходимости концентрируют ил путем осаждения таким образом, чтобы объем ила, добавляемого в испытуемую пробу, был минимальным. Добавляют соответствующий объем для получения взвешенных твердых веществ в диапазоне от 30 мг/дм3 до 1000 мг/дм3 в конечной смеси.
Если эндогенная респирация инокулята слишком высока (избыточна), следует перед использованием стабилизировать инокулят путем аэрации. Приводят температуру испытания в соответствие с используемым инокулятом.
Также полезно определение колониеобразующих единиц (cfu) используемого инокулята. Испытуемая смесь предпочтительно должна содержать от 103 до 106 cfu/см3.
При моделировании процессов биоразложения в природных условиях или при определении баланса углерода (см. приложение Е) рекомендуемая концентрация инокулята — 30 мг/дм3 взвешенных веществ. Поскольку твердые вещества могут мешать определению углеродного баланса, рекомендуется использовать следующую процедуру приготовления инокулята. Гомогенизируют 500 см3 активного ила 2 мин в блендере на средней скорости или в подходящем высокоскоростном смесителе. Оставляют отстояться для того, чтобы надосадочная жидкость не содержала значительных количеств взвешенных веществ, но в любом случае не менее 30 мин. Декантируют достаточный объем надосадочной жидкости и добавляют его в испытательные колбы так, чтобы получить концентрацию от 1 % до 5 % объемной доли в испытательной среде. Следует избегать переноса частиц осадка.
Инокулят может быть предварительно кондиционирован, но в обычных условиях не следует использовать для этого предварительно экспонированный инокулят, особенно в случае стандартных испытаний, имитирующих биоразложение в природных условиях. В зависимости от цели испытания допускается также использовать предварительно экспонированный инокулят при условии, что это должно быть четко указано в протоколе испытаний (например, процент биоразложения = х %, с использованием предварительно экспонированного инокулята) и должен быть подробно описан метод предварительного воздействия. Предварительно экспонированный инокулят может быть получен с помощью подходящих лабораторных исследований биоразложения (см. [8]), проводимых в разных условиях, или из образцов, полученных в соответствующих условиях окружающей среды (например, на загрязненных территориях или на промышленных очистных сооружениях).
8.4 Проведение испытаний
Предусматривают несколько сосудов, чтобы испытания включали, как минимум, следующее:
а) три сосуда для испытуемого материала (обозначение FT);
b) три сосуда для контрольной пробы (обозначение FB);
с) два сосуда для проверки активности инокулята с использованием эталонного материала (обозначение Fc).
И при необходимости:
d) один сосуд для проверки возможного абиотического разложения или небиологических изменений в испытуемом материале, например в результате гидролиза (обозначается как Fs). Испытательный раствор в Fs должен быть стерилизован, например, автоклавированием или добавлением подходящего токсичного неорганического соединения для предотвращения микробной активности. Используют, например, 5 см3/дм3 раствора, содержащего 10 г/дм3 хлорида ртути (II) (HgCI2). При необходимости добавляют такое же количество токсичного вещества во время испытания;
е) один сосуд в качестве отрицательного контроля (обозначается как FN) с использованием небиоразлагаемого полимера (например, полиэтилена) такой же формы, что и испытуемый материал;
f) один сосуд для проверки возможного ингибирующего действия испытуемого материала на микробную активность (обозначается как F|). Следует обратить внимание, чтобы соотношение углерода в испытуемом и эталонном материалах и азота в среде было примерно C:N = 40:1. При необходимости добавляют азот.
Добавляют соответствующие количества испытательной среды (6.2) и инокулята (см. 8.3) в испытательные сосуды, как приведено в таблице 1.
Измеряют значение pH в сосудах и при необходимости доводят до 7. Помещают поглотитель диоксида углерода (6.4) в емкость для поглотителя респирометра (см. приложение С). Вносят испытуемый материал (см. 8.1), эталонный материал и материал отрицательного контроля (см. 8.2) в соответствующие сосуды, как указано в таблице 1. При необходимости проведения анализа баланса углерода (см. приложение Е) отбирают известный достаточный объем инокулированной испытательной среды из каждого сосуда или из дополнительных отдельных сосудов для определения DOC и биомассы в начале и в конце периода инкубации. Учитывают удаленный объем при вычислении окончательного объема или результатов испытания.
Помещают сосуды в среду с постоянной температурой (см. раздел 5) и обеспечивают возможность всем сосудам достичь требуемой температуры. Выполняют все необходимые соединения, закрывают сосуды, помещают их в респирометр и включают мешалку.
Снимают необходимые показания манометров (для неавтоматических манометров) и убеждаются, что регистратор потребления кислорода работает нормально (автоматический респирометр). В качестве альтернативы допускается использовать двухфазную версию с закрытым сосудом, приведенную в приложении D.
Таблица 1 — Окончательное распределение испытуемых и эталонных материалов
Сосуд | Испытуемый материал | Эталонный материал | Инокулят |
FT (испытуемый материал) | + | — | + |
FT (испытуемый материал) | + | — | + |
FT (испытуемый материал) | + | — | + |
FB (контрольный опыт) | — | — | + |
FB (контрольный опыт) | — | — | + |
FB (контрольный опыт) | — | — | + |
Fc (контроль инокулята) | — | + | + |
Fc (контроль инокулята) | — | + | + |
Fs (проверка абиотического разложения, при необходимости) | + | — | — |
F| (контроль ингибирования, при необходимости) | + | + | + |
Fn (отрицательный контроль, при необходимости) | — | + | + |
При достижении постоянного уровня BOD (достижение фазы плато) и если дальнейшего биоразложения не ожидается, испытание считают завершенным. Как правило период испытания не должен превышать 2 мес. Однако, если по-прежнему наблюдают значительное биоразложение и фаза плато не достигнута по прошествии этого периода времени, то испытание может быть продлено, но не более чем на 6 мес. В случае проведения длительных испытаний особое внимание следует уделять технической системе (например, герметичности испытательных сосудов и соединений).
В конце испытания измеряют значение pH и сразу определяют концентрации нитратов и нитритов в колбах FT (см. ниже) или отбирают пробы соответствующих сохраненных образцов. Полученные значения используют для корректировки вычисляемой степени биоразложения при нитрификации (см. приложение В).
Аллилтиомочевина может ингибировать нитрификацию только в течение коротких периодов инкубации, поскольку она биоразлагаема. Поэтому для предотвращения нитрификации не рекомендуется добавлять аллилтиомочевину. Однако практика показывает, что при низких концентрациях инокулята (приблизительно 1 % по объему) нитрификация не происходит даже в течение длительных периодов инкубации, когда ингибитор не используется.
При необходимости дополнительно определяют абсорбированный диоксид углерода в адсорбере в конце испытания (см. приложение G).
9 Вычисления и интерпретация результатов
9.1 Вычисления
Считывают значения потребления кислорода для каждой колбы, используя метод, указанный изготовителем для соответствующего типа респирометра. Вычисляют удельное биохимическое потребление кислорода (BODS) испытуемым материалом как разность между потреблением кислорода в испытательных колбах FT и контрольных пробах FB, деленную на концентрацию испытуемого материала по формуле
_ BOD# — BODr#
(1)
BODS =---------—
Рте
где BODS — определенное значение BOD испытуемого материала, мг/г;
BODf — BOD сосудов FT, содержащих испытуемый материал, в момент времени t, мг/дм3;
BODBf — BOD контрольного опыта FB в момент времени t, мг/дм3;
ртс — концентрация испытуемого материала в реакционной смеси колбы FT, г/дм3.
Вычисляют процент биоразложения Dt как отношение определенного биохимического потребления кислорода к теоретическому потреблению кислорода (ThOD, в миллиграммах на грамм испытуемого материала)по формуле
•100.
(2)
Таким же образом вычисляют BOD и процент биоразложения эталонного материала Fc и, при использовании, проверяют абиотическое разложение Fs, контроль ингибирования F( и отрицательный контроль Fn.
Вычисление ThOD приведено в приложении А. При определении значительных концентраций нитритов и нитратов рассматривают потребление кислорода с учетом нитрификации (см. приложение В). При необходимости вычисления углеродного баланса следует использовать информацию, приведенную в приложении Е.
9.2 Выражение и интерпретация результатов
Составляют таблицу измеренных значений BOD и процентов биоразложения для каждого интервала измерений и каждого испытательного сосуда. Для каждого сосуда строят кривую зависимости BOD и кривую биоразложения, в процентах от времени. Если для трех параллельных сосудов получены сопоставимые результаты, можно построить кривую для среднего значения.
Максимальный уровень биоразложения, определяемый как среднее значение фазы плато кривой биоразложения или максимальное значение, например когда кривая снижается или, в дальнейшем, медленно повышается в фазе плато, характеризует степень биоразложения испытуемого материала. Если был определен углеродный баланс, его результат характеризует общую степень биоразложения.
На результаты испытаний могут влиять смачиваемость и форма испытуемого материала, и, следовательно, процедура испытаний может быть ограничена сравнением пластмасс с аналогичной химической структурой.
Информация о токсичности испытуемого материала может быть полезна при интерпретации результатов испытаний, показывающих низкую биоразлагаемость.
10 Достоверность результатов испытаний
Испытание считают достоверным, если:
а) степень биоразложения эталонного материала (Fc контроль инокулята) в конце испытания составляет более 60%;
b) BOD контрольного опыта FB в конце испытания не превышает верхнего предельного значения, полученного опытным путем (это значение зависит от количества инокулята и, как показали результаты межлабораторных испытаний, составляет, например, в случае 30 мг/дм3 сухого вещества, приблизительно 60 мг/дм3);
с) значения BOD для трех контрольных опытов FB и трех сосудов с испытуемым материалом FT находятся в пределах 20 % от среднего значения фазы плато или в конце испытания.
Если в сосуде Ft (контроль ингибирования, при включении) процент биоразложения менее 25 % и не наблюдается значительного разложения испытуемого материала, можно предположить, что испытуемый материал является ингибирующим.
Если в сосуде Fs (контроль абиотического разложения, при включении) наблюдают значительное BOD (более 10 %), возможно, имели место процессы абиотического разложения.
Если был включен сосуд FN (отрицательный контроль) и значительного BOD не наблюдалось.
Если вышеприведенные критерии не выполняются, испытания повторяют, используя другой предварительно кондиционированный или предварительно экспонированный инокулят.
11 Протокол испытаний
Протокол испытаний должен содержать, как минимум, следующую информацию:
а) ссылку на настоящий стандарт;
Ь) всю информацию, необходимую для идентификации испытуемых и эталонных материалов, включая ТОС, ThOD, химический состав и формулу (если известны), форму, внешний вид и количество/ концентрацию в испытуемых образцах;
с) основные параметры испытания, включая испытательный объем, используемую испытательную среду, температуру инкубации и конечное значение pH;
d) источник и количество использованного инокулята, включая подробную информацию о любом предварительном воздействии;
е) используемые аналитические методы, включая принцип работы респирометра, определение ТОС и нитратов/нитритов;
f) все результаты испытаний, полученные для испытуемых и эталонных материалов (в табличной и графической форме), включая измеренные значения BOD, процентные значения биоразложения, соответствующие графики этих параметров в зависимости от времени и концентрации нитратов/ нитритов;
д) продолжительность индукционного периода, фазы биоразложения и максимальный уровень разложения, а также общую продолжительность испытания;
и, необязательно, если выполнено или определено:
h) результаты проверки абиотического разложения Fs, контроля ингибирования F( и отрицательного контроля Fn;
i) результаты определения углеродного баланса, включая, например:
1) количество углерода в испытуемом материале, окисленного до диоксида углерода, вычисленное по степени биоразложения на основе BOD,
2) увеличение DOC в испытательной среде в течение периода инкубации за счет водорастворимых веществ,
3) увеличение содержания органического углерода в биомассе во время испытания,
4) содержание углерода в остаточных полимерах в конце испытания,
5) сумму всего измеренного углерода, выраженную в процентах от углерода, введенного в качестве испытуемого материала;
j) колониеобразующие единицы (cfu/см3) в инокулированных испытуемых смесях;
к) любые другие соответствующие данные (например, начальная молекулярная масса образца, молекулярная масса остаточного полимера).
Приложение А (справочное)
Теоретическое потребление кислорода (ThOD)
А.1 Вычисление ThOD
Теоретическое потребление кислорода (ThOD) веществом СсНЛС1с/1\1п35Рр№паОо с относительной молекулярной массой Мг может быть вычислено, если элементный состав известен или может быть определен элементным анализом,по формуле
ThOD _ 1 +0,5(/1 - с/ - 3n)+3s + 2,5р+0,5па - о]
мг
Данное вычисление предполагает, что углерод превращается в СО2, водород в Н2О, фосфор в Р2О5, степень окисления серы + 6, а галогены удаляются в виде галогенидов водорода. Степень окисления N, Р и S должна быть проверена анализом. При проведении вычислений также предполагают, что азот выделяется в виде аммония. Влияние нитрификации приведено в приложении В.
ThOD выражают в миллиграммах на грамм или в миллиграммах на миллиграмм вещества.
А.2 Пример: поли (Р-гидроксимасляная кислота) (РНВ)
Химическая формула: С4Н6О2 (число атомов С = 4, атомов Н = 6 и атомов О = 2); относительная молекулярная масса Мт = 86. См. формулу (А.2):
16Г2.4 + 0,5-6-2]
ThOD=—1---—-----< (А.2)
ThOD = 1,6744 мг/мг РНВ = 1674,4 мг/г РНВ.
Примечание — РНВ — полимер, состоящий из мономера p-гидроксибутирата. При полимеризации (образование сложного эфира) удаляется вода и таким образом суммарная формула РНВ эквивалентна формуле мономера за вычетом Н2О, которая удаляется при химической реакции.
А.З Пример: смесь полиэтилена/крахмала/глицерина
Компонент | Формула | ThOD, мг/г | Содержание компонентов | ThOD, мг/сосуд | |
% | мг/сосуд | ||||
Полиэтилен | (С2Н4)п | 3400 | 50 | 500 | 1700 |
Крахмал | (С6Н10О5)п | 1190 | 40 | 400 | 476 |
Глицерин | СзН8О3 | 1200 | 10 | 100 | 120 |
Общее содержание | 100 | 1000 | 2296 | ||
Приложение В (справочное)
Корректировка значений BOD на влияние нитрификации
В.1 Влияние нитрификации
На значения BOD может влиять нитрификация. Необходима корректировка BOD для предотвращения серьезных ошибок при вычислении степени биоразложения, основанной на окислении углерода в азотсодержащем испытуемом материале.
Ошибки в случае веществ, не содержащих азота, как правило, незначительны, поскольку окисление аммониевых соединений в среде учитывается путем вычитания контрольного опыта.
Соли аммония и азотсодержащие испытуемые соединения могут быть окислены до нитрита или нитрата во время инкубационного периода испытания биоразложения. Поскольку реакции являются последовательными (осуществляются разными видами бактерий), концентрация нитрита может увеличиваться или уменьшаться. В последнем случае образуется эквивалентная концентрация нитрата. Химические реакции протекают в соответствии с формулами (В.1)—(В.З):
2NH4CI + ЗО2 = 2HCI + 2Н2О,
(В.1)
(В.2)
(В.З)
2HNO2 + О2 = 2HNO3.
Суммарное уравнение
2NH4CI + 4О2 =2HNO3 + 2HCI + 2Н2О.
Из этих формул можно сделать вывод, что:
- для окисления 2 моль (28 г) аммиачного азота (добавленного в виде NH4CI с неорганической средой) до нитрита необходимо 3 моля (96 г) кислорода (BODMri ), что дает коэффициент потребления кислорода 3,43 (96/28) мг/мг азота; 2
- для окисления 2 моль (28 г) аммиачного азота до нитрата необходимо 4 моля (128 г) кислорода (BODno ), что дает коэффициент потребления кислорода 4,57 (128/28) мг/мг азота. 3
Степень нитрификации можно определить путем измерения концентраций нитратов и нитритов в конце испытания в среде в колбах FT. Прежде всего рекомендуется провести качественный анализ для определения, произошла ли нитрификация. Если есть признаки присутствия нитрата или нитрита, требуется количественное определение.
Часть BOD, полученную в результате окисления азота в конце испытания, BODN, мг/дм3, вычисляют по формуле
BODn = (pN03 • 4,57) + (pNq2 • 3,43), (В.4)
где pNQ3 — измеренная концентрация нитратного азота в колбах FT в конце испытания, мг/дм3;
pNo2 — измеренная концентрация нитритного азота в колбах FT в конце испытания, мг/дм3;
4,57 — коэффициент потребления кислорода для образования нитрата;
3,43 — коэффициент потребления кислорода для образования нитрита.
Часть BOD, полученную в результате окисления углерода в конце испытания, BODC, мг/дм3, вычисляют по формуле
BODC = BODg - BODn - BODB/, (В.5)
где BODg — измеренное BOD сосудов FT в конце испытания, мг/дм3;
BODB( — BOD контрольного опыта FB в конце испытания, мг/дм3.
BODC соответствует BOD( и используется для вычисления BODS и Dt [см. формулы (1) и (2) в 9.1].
В.2 Пример
Испытуемое вещество 2-этилгексиловый эфир п-аминобензойной кислоты в FT концентрацией 100 мг/дм3:
ThOD....................................................................................................... 239 мг/дм3;
BODf, измеренное в конце испытания................................................. 199 мг/дм3;
BODBf, измеренное для контрольного опыта...................................... 8 мг/дм3;
Dt без корректировки на нитрификацию.............................................. 80 %;
нитрат в конце испытания 15 мг/дм3..................................................... pNo3 = 3,5 мг/дм3;
нитрит в конце испытания 1 мг/дм3...................................................... pNo2 = 0,3 мг/дм3;
BODn в конце испытания...................................................................... 17 мг/дм3;
BODC....................................................................................................... 174 мг/дм3;
Dt, скорректированная на нитрификацию............................................ 73 %.
Приложение С (справочное)
Принцип работы закрытого манометрического респирометра
Респирометр, содержащий испытательные сосуды (колбы), оснащенные магнитной мешалкой и контейнером для абсорбера СО2 в свободном пространстве, устанавливают в среде с контролируемой температурой (например, в водяной бане), каждый сосуд содержит кулонометрическую установку для производства кислорода, манометр, внешнее устройство мониторинга и регистрации (принтер, плоттер или компьютер). Сосуды для испытаний заполняют испытуемой смесью примерно на треть их вместимости. См. рисунок С.1.
Непрерывное перемешивание гарантирует равновесие кислорода между водной и газовой фазами. Если происходит биоразложение, микроорганизмы потребляют кислород и производят углекислый газ, который полностью поглощается. Общее давление в сосудах снижается. Падение давления регистрируется манометром и используется для инициирования электролитического образования кислорода. При восстановлении исходного давления электролиз останавливается, и количество потребляемой электроэнергии, пропорциональное непрерывно измеряемому потреблению кислорода, используется для индикации потребления кислорода в мг/дм3 BOD на самописце.
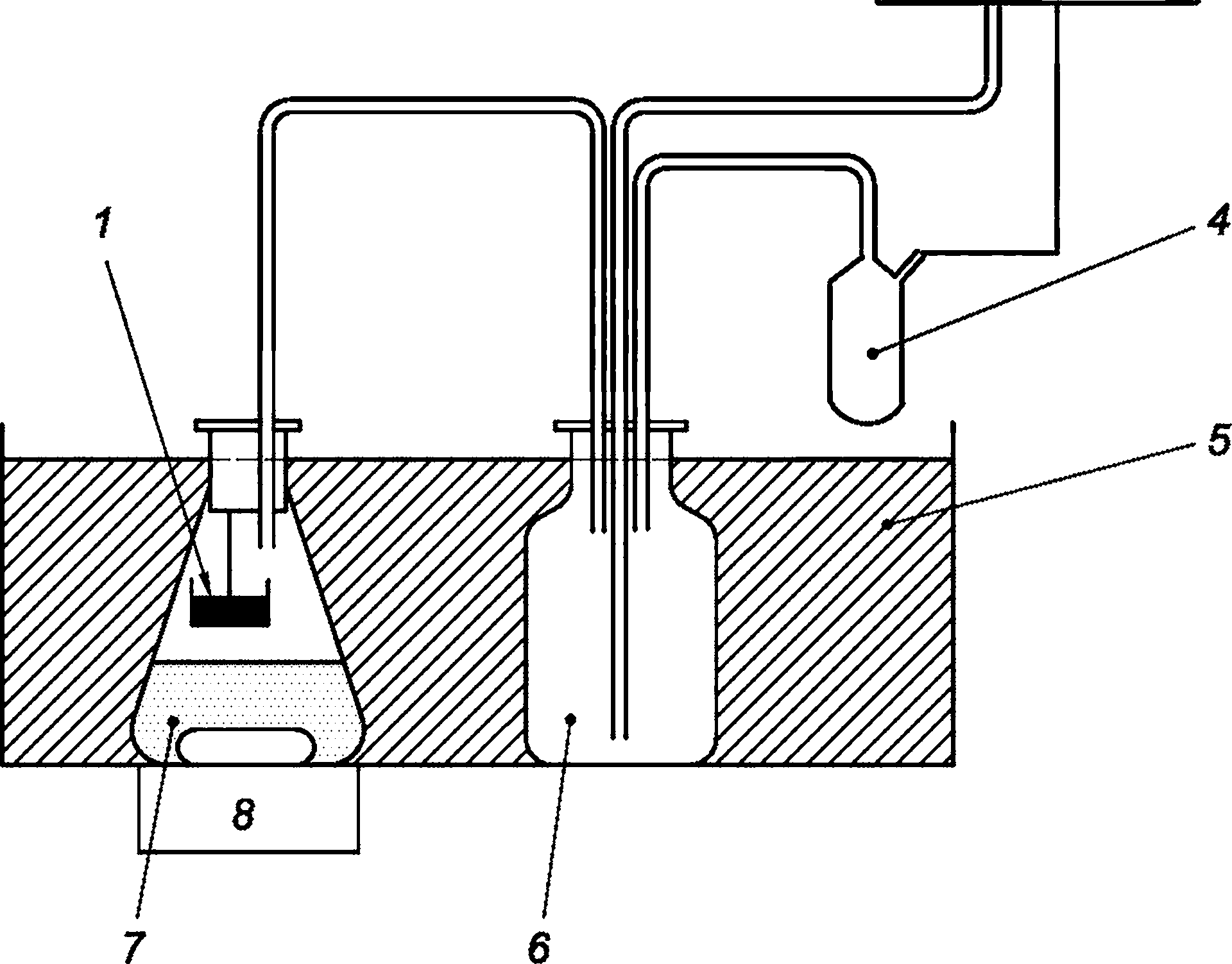
1 — абсорбер СО2; 2 — регистратор; 3 — принтер, плоттер или компьютер; 4 — манометр; 5 — водяная баня; б — блок производства кислорода; 7 — испытательная колба; 8 — магнитная мешалка
Рисунок С.1 — Схематическое изображение манометрического респирометра
Приложение D (справочное)
Вариант двухфазного респирометрического испытания в закрытом сосуде
D.1 Принцип
Эту версию допускается использовать как альтернативную, например, при отсутствии респирометра. Инокулированную среду, а также испытуемые и эталонные материалы встряхивают или перемешивают при температуре от 20 °C до 25 °C в закрытых сосудах, содержащих известные объемы водной среды и воздуха, для обеспечения устойчивого распределения кислорода между водной и газовой фазами. Во время биоразложения регулярно измеряют концентрацию растворенного кислорода в водной фазе. Общее поглощение кислорода в испытательных сосудах вычисляют делением разности измеренных концентраций растворенного кислорода в контрольных пробах и испытательных сосудах на значение насыщения кислородом при нормальных условиях, умноженное на общее содержание кислорода, первоначально присутствующее в водной и газовой фазах. Биоразлагаемость вычисляют как отношение общего потребления кислорода к теоретическому потреблению кислорода (ThOD) и выражают в процентах.
D.2 Специальная аппаратура
D.2.1 Инкубационные сосуды: газонепроницаемые сосуды, например узкогорлые колбы вместимостью от 200 до 300 см3 с соответствующими пробками (например, притертыми пробками, пробками из бутилкаучука или завинчивающимися крышками), обеспечивающие защиту от света (например, из коричневого стекла). Рекомендуется использовать фиксирующие зажимы. Помечают каждую колбу водостойкой маркировкой. Если не используют кислородные электроды с установленными мешалками, снабжают колбы стержнем для магнитной мешалки с покрытием из PTFE. Подходят колбы стандартной вместимости, чтобы стандартное отклонение среднего значения вместимости для партии колб было не более 1 см3; или измеряют и записывают вместимость каждой пронумерованной колбы с точностью до 1 см3. Тщательно смазывают пробки бутылок инертной силиконовой смазкой для обеспечения надежного закрытия и легкого удаления.
D.2.2 Кислородный электрод, предпочтительно с установленной мешалкой, обеспечивающий проведение измерений в диапазоне от 0 до 10 мг/дм3 с точностью до 1 %. Устойчивый режим работы должен достигаться примерно в течение 1,5 мин. Устанавливают электрод, например, в пробку из инертного материала, обеспечивающего герметичную посадку в горловине стеклянного шлифа инкубационной колбы, или используют метод измерения концентрации кислорода в круговом байпасе.
D.2.3 Магнитная мешалка или встряхивающее устройство.
D.3 Проведение испытаний
Устанавливают инкубационные сосуды FT, FB и Fc как приведено в 8.4. Помещают в каждый сосуд стержень для мешалки, если их необходимо перемешивать, а не встряхивать. Готовят достаточное количество испытательной среды, предпочтительно стандартной (6.2.1), для проведения полного испытания. Для обеспечения достаточного количества питательных веществ увеличивают количество хлорида аммония в растворе А (6.2.1.1) в три раза —до 1,5 г/дм3. Инокулируют среду в соответствии с 8.3, предпочтительно используя активный ил с концентрацией взвешенных веществ 30 мг/дм3, тщательно перемешивают и добавляют смесь в сосуды. Добавляют объем, равный двум третям вместимости сосуда (например, 200 см3 жидкости в сосуды вместимостью 300 см3). Помещают сосуды на устройство для встряхивания или перемешивают и инкубируют при температуре от 20 °C до 25 °C в течение одной недели. В это время бактерии используют свой материальный резерв, и инокулят стабилизируется. Затем аэрируют сосуды с помощью насыщенного водой сжатого воздуха и воздушного диффузора в течение примерно 15 мин. Измеряют исходную концентрацию кислорода. Добавляют в соответствующие сосуды испытуемый или эталонный материал, как приведено в 8.1 и 8.2. Максимальная концентрация испытуемого материала в этом испытании должна соответствовать 150 мг/дм3 ThOD, что соответствует приблизительно 90 мг/дм3 ТОС. Тщательно закрывают пробками все сосуды и продолжают инкубацию.
После инкубации в течение одной недели или чаще определяют концентрацию растворенного кислорода в каждом сосуде. При проведении измерений в сосудах поддерживают постоянную температуру инкубации с точностью ± 0,5 °C. Калибруют кислородный электрод в соответствии с инструкциями изготовителя. Для измерения содержания кислорода энергично встряхивают вручную каждый сосуд по очереди в течение примерно 30 с. Помещают сосуд на мешалку (без перемешивания). Удаляют пробку и сразу помещают кислородный электрод в сосуд таким образом, чтобы пробка электрода плотно закрывала сосуд, а кончик электрода находился значительно ниже поверхности жидкости. Включают мешалку со скоростью, чтобы было возможно измерение кислорода, но не образовывалось завихрений. Используют одну и ту же скорость мешалки для всех измерений и калибровок электродов. Записывают значение кислорода, когда оно стабилизируется, что должно быть достигнуто примерно через 2 мин. Для вычисления результатов испытаний используют только те сосуды, в которых концентрация кислорода была не менее 1,5 мг/дм3. В качестве альтернативы допускается использовать другие подходящие методы измерения концентрации растворенного кислорода в водной фазе, такие как кислородный электрод, расположенный в замкнутом круговом байпасе.
Затем измеряют и записывают значение pH в каждом сосуде. Если значение pH ниже 6,0, доводят его до приблизительно 7,5 раствором гидроксида натрия от 0,1 до 0,5 моль/дм3. Если значение pH выше 8,0, доводят его до приблизительно 7,5 раствором соляной кислоты от 0,1 до 0,5 моль/дм3. Затем аэрируют среду в каждом сосуде с помощью воздушного диффузора в течение 15 мин и снова измеряют концентрацию кислорода, как описано выше. Закрывают сосуды крышками, помещают в шейкер и продолжают инкубацию. В конце испытания корректируют измеренные значения BOD на нитрификацию (см. 8.4 и приложение В).
D.4 Вычисление результатов
Определяют относительное поглощение кислорода UT, измеренное в водной фазе в каждой бутылке, по формуле
(D.1)
где Св? — среднее значение концентрации растворенного кислорода в контрольных опытах после инкубации в момент времени t, мг/дм3;
Ct — концентрация растворенного кислорода в каждом испытательном сосуде после инкубации в момент времени t, мг/дм3;
Cs — значение насыщения растворенного кислорода, мг/дм3.
В качестве значения насыщения Cs используют среднее значение, измеренное после каждой аэрации или повторной аэрации контрольного опыта и испытуемых сосудов. Теоретическое значение при стандартном атмосферном давлении (1013 гПа) и 20 °C составляет 9,08 мг/дм3.
Определяют общую производительность кислорода сосудом Ос (мг/сосуд), исходя из максимального содержания кислорода в газовой фазе и содержания кислорода в водной фазе при стандартном давлении и 20 °C по формуле
Ос = (0,28- Vg) + (0,009 • X/,), (D.2)
где 0,28 — содержание кислорода в стандартной атмосфере, мг/см3;
Vg — объем газа в инкубационном сосуде, см3;
0,009 — концентрация насыщения воды кислородом, мг/см3;
\/| — объем жидкости в инкубационном сосуде, см3.
Обычно \7( будет постоянным в серии испытаний, за исключением случаев, когда отбирают образцы для анализа, но Vg может отличаться в зависимости от используемых испытательных сосудов. Если различия между отдельными сосудами незначительные, можно использовать постоянное значение Ос. Если различия значительны (например, более 2 см3 для сосудов вместимостью 200 см3), Ос следует вычислять для каждого сосуда. Если Ц уменьшается в зависимости от объема взятой пробы, то 1/д пропорционально увеличивается.
Затем вычисляют потребление кислорода BOD, мг/сосуд, по формуле
BOD = Ur • Ос. (D.3)
Для получения BOD в конце испытания суммируют потребление кислорода ZBOD, мг/сосуд, для всех (л) периодов инкубации по формуле
EBOD = BOD1 + BOD2 + ... BODn.
(D.4)
Наконец вычисляют процент биологического разложения как приведено в 9.1.
Используют соответствующие формулы для определения абиотического разложения, а также биологического разложения эталонного материала и контроля ингибирования.
Приложение Е (справочное)
Пример определения углеродного баланса
Е.1 Основные положения
Пластмассы, как правило, имеют более сложный состав, чем вещества с низкой молекулярной массой. Для характеристики и количественной оценки их способности к биологическому разложению часто недостаточно только определения выделения СО2 или BOD. Во время биологического разложения микроорганизмами накапливается новая биомасса, и часть углерода в испытуемом материале превращается в биомассу, но не окисляется биохимически. В связи с этим аналитические параметры, такие как выделение СО2 и BOD, часто не достигают 100 % от соответствующих теоретических значений даже в случае полного биологического разложения испытуемого материала, и на основании результатов испытаний может быть ошибочно сделан вывод о неполном разложении. В таких случаях для подтверждения полной биоразлагаемости может быть полезным определение общего углеродного баланса, как приведено в данном приложении. Такой баланс основан на суммировании количеств углерода, полученных в результате следующих измерений: углерода, выделившегося в виде диоксида углерода, углерода, образовавшегося в виде новой биомассы, углерода, преобразованного в водорастворимые органические метаболиты, углерода, определенного как DOC и углерода, оставшегося в неразложившемся полимерном материале. Суммарное количество углерода сравнивают с количеством органического углерода в испытуемом материале, введенном в испытательную систему.
Е.2 Проведение испытаний
Определяютизменение BOD, как описано в 8.4.
Отбирают образцы инокулированной среды в начале испытания перед добавлением испытуемого материала и в конце периода инкубации. Для получения представительных образцов необходимо тщательно отбирать образцы. Образцы пропускают через мембранный фильтр или центрифугируют со скоростью приблизительно 40 000 м • с-2.
Для каждого образца определяют количество биомассы в фильтрате или центрифугате, используя подходящие методы, например путем измерения белка. Определяют или принимают количество углерода в биомассе и вычисляют по разнице увеличение содержания органического углерода в биомассе.
В соответствии с ИСО 8245 определяют DOC в фильтрате каждой пробы и вычисляют увеличение содержания органического углерода. При возможности определяют вещества, формирующие DOC, для подтверждения продуцирования водорастворимых метаболитов.
В конце испытания определяют количество углерода в остаточных полимерах, используя весь оставшийся образец. Обычно это сложная процедура и ее можно выполнить напрямую, если доступен полимер-специфический анализ (см. приложение F), или косвенно. В первом случае извлекают и взвешивают остаточные полимеры и вычисляютколичество углерода по их известному составу. Одним из возможных методов непрямого (косвенного) определения является промывка, сушка, взвешивание остатка и определение общего органического углерода (ТОО).
Затем вычитают углерод биомассы (см. выше) из ТОО для получения количества углерода в остаточных полимерах. Другая возможность — точно взвесить остаток, а затем обработать его подходящим методом для разрушения биомассы, но не полимеров (это необходимо проверить заранее). Используя, например, гипохлорит натрия, удаляют растворимую часть и снова взвешивают образец. Предполагают, что вся биомасса удалена, и по полученной массе вычисляют содержание полимера в остатке.
Е.З Вычисление углеродного баланса
Вычисляют количество биохимически окисленного углерода CB0D (мг/дм3) в испытуемом материале, введенном в испытательную систему(содержание углерода СМАТ), исходя из процента биоразложения Dt, полученного в респирометрическом испытании (см. 9.1) по формуле
С _ СМАТ ' Cbod—ioo~
(Е.1)
Вычисляют увеличение количества углерода в биомассе испытательных сосудов, содержащих испытуемый материал Свю (мг/дм3), сопоставлением измеренного или вычисленного количества углерода в биомассе в начале CB(start) и K0HUe инкубационного периода испытаний Сщепф по формуле
(Е.2)
СВЮ “ CB(end) “ CB(start)-
Определяют увеличение DOC в течение инкубационного периода CD0C (мг/дм3), сопоставлением концентрации DOC в начале DOC^start) и конце DOC(end) по формуле
(Е.З)
CDOC - D0C(end) ” D0C(start)-
В конце испытания определяют количество органического углерода в остаточных полимерах CPOL.
Вычисляют количества разногопреобразованного углерода в процентах от введенногов испытательную систему углерода СМАТ и суммируют, чтобы получить вычисленное значение углерода Ccalc, %, по формуле
(Е.4)
CCALC “ CBOD + CBIO + CDOC + CPOL‘
Е.4 Пример: углеродный баланс поли(Р-гидроксимасляной кислоты [5])
Исходный испытуемый материал: СМАТ = 600 (мг/дм3) = 334,8 (мг/дм3) углерода.
Степень биоразложения: Dt = 78 %.
Параметр | ^B(start) | ^B(end) | Свю | Doc(start) | DOCfend) | DOC | ^bod |
мг/дм3 | 3,2 | 61,0 | 57,8 | 2,0 | 22,0 | 20,0 | 261 |
% от СМАТ | 17,2 | 6,0 | 78 |
Приложение F (справочное)
Пример определения количества и молекулярной массы нерастворимого в воде полимера, оставшегося в конце испытания на биологическое разложение
Может быть полезным использование процедуры измерения количества и молекулярной массы полимеров, оставшихся в конце исследования биологического разложения. Данный метод или другой подходящий метод могут быть использованы для анализа нерастворимых в воде полимеров, растворяющихся в органических растворителях, не смешивающихся с водой.
а) Переносят испытуемую смесь в делительную воронку, добавляют подходящий органический растворитель и встряхивают от 10 до 20 мин для экстракции оставшихся полимеров. Отделяют слой органического растворителя от водного слоя. Добавляют свежий растворитель и повторяют процедуру.
Ь) Объединяют органические экстракты и выпаривают растворитель досуха. Растворяют твердый образец в соответствующем объеме подходящего элюата.
с) Вводят с помощью микрошприца подходящее количество испытуемого материала в высокоэффективный жидкостной хроматограф (ВЭЖХ), оснащенный колонкой, заполненной гелем для эксклюзионной хроматографии. Запускают анализ и записывают хроматограмму.
d) Определяют количество присутствующего полимера по калибровочной кривой.
е) Определяют молекулярную массу полимера, вводя в хроматограф подобный полимер или полимеры, структура которых аналогична исследуемым полимерам и молекулярные массы известны. Получают хроматограмму зависимости времени удерживания от молекулярной массы полимера. Определяют молекулярную массу, используя эту зависимость.
Абсолютную молекулярную массу исследуемого полимера также можно определить с помощью ВЭЖХ с комбинацией малоуглового лазерного светорассеяния(1_А1_1_В) и дифференциального рефрактометрического детектора (RI).
Приложение G (справочное)
Пример определения СО2, поглощенного абсорбентом
G.1 Основные положения
Если во время испытания происходит нитрификация, значения биологического разложения, основанные на потреблении кислорода, должны быть скорректированы (приложение В). Поскольку небольшие различия в содержании нитратов и нитритов приводят к значительным поправкам в полученные проценты биологического разложения, полезно определить, при необходимости, процент биоразложения на основе произведенного диоксида углерода. Процент биологического разложения на основе продуцированного диоксида углерода допускается использовать для проверки значений, полученных на основе потребления кислорода после поправки на нитрификацию.
G.2 Процедура испытаний
Определяют содержание углекислого газа в адсорбере каждый раз при замене адсорбера и в конце испытания. Для разложения карбонатов и бикарбонатов подкисляют содержимое всех сосудов в конце испытания добавлением от 1 до 10 см3 концентрированной соляной кислоты (HCI). Продолжают аэрацию еще 24 ч, затем определяют содержание углекислого газа.
Пример подходящего аналитического метода: добавляют 1 см3 раствора КОН (3 н.) вячейку адсорбера СО2. Адсорбированный СО2 определяют титрованием. Полученный раствор КОН разбавляют дистиллированной или деионизированной водой (6.1) до 60 см3 и титруют 0,05 н. раствором HCI.
G.3 Вычисления
Вычисляют теоретическое количество выделяемого диоксида углерода (ThCO2), мг, по формуле
ThCO2 = проба, мг •(G. 1)
2 100 12 k ’
где ТОС (%) — ТОС в пластмассе (или эталонном материале), деленное на 100;
44 — молекулярная масса СО2;
12 — молекулярная масса С.
Вычисляют процент биоразложения для испытательных сосудов FT по формуле
% биоразложения =
(мгСО2 продуцированного)т-(мгСО2 продуцированного)в
ThCO2
•100,
(G.2)
где (мг СО2 продуцированного)т — количество диоксида углерода, выделившегося в сосуде FT от начала и до конца испытания, мг;
(мг СО2 продуцированного)в — количество диоксида углерода, выделившегося в сосуде FB от начала и до конца испытания, мг;
ThCO2 — теоретическое количество диоксида углерода выделяемого испытуемым материалом, мг.
Аналогичным образом вычисляют процент биологического разложения эталонного материала в контрольном сосуде с инокулятом Fc.
Приложение ДА (справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА. 1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 8245 | NEQ | ГОСТ 31958—2012 «Вода. Методы определения содержания общего и растворенного органического углерода» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - NEQ — неэквивалентный стандарт. | ||
Библиография
[1]
ASTM D 3536—911) Molecular Weight Averages and Molecular Weight Distributionby Liquid Exclusion
[2]
ISO 8192
[3]
ISO 10708
[4]
ISO 11923
Chromatography (GEL Permeation Chromatography — GPC)] [Средние значения молекулярной массы и распределение молекулярной массы с помощью жидкостной эксклюзионной хроматографии (гель-проникающая хроматография — GPC)]
Water quality — Test for inhibition of oxygen consumption by activated sludge for carbonaceous and ammonium oxidation (Качество воды. Испытание на ингибирование поглощения кислорода активным илом при окислении углеродсодержащих и амони-евых соединений)
Water quality— Evaluation in an aqueous medium of the ultimate aerobic biodegradability of organic compounds — Determination of biochemical oxygen demand in a twophase closed bottle test (Качество воды. Оценка способности органических соединений к полному биологическому разложению в водной среде. Определение биохимической потребности в кислороде при двухфазном испытании в закрытой склянке)
Water quality — Determination of suspended solids by filtration through glass-fibre filters (Качество воды. Определение содержания взвешенных твердых частиц путем фильтрации через стекловолоконные фильтры)
[5]
PLICHNER. P. (1994), Screening-Testmethoden zur Abbaubarkeit von Kunststoffen unter aerobe und anaeroben Bedingungen, Dissertation, Stuttgart University Fakultat fur Bauingenieurwesen, Stuttgarter Berichte zur Abfallwirtschaft, 59, Erich Schmidt Verlag, Berlin
[6]
ISO 9408:19992)
[7]
ISO 106343)
[8]
ISO/TR 154624)
Water quality — Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium by determination of oxygen demand in a closed respirometer (Качество воды. Оценка способности органических соединений к полному аэробному биологическому разложению в водной среде методом определения потребности в кислороде в закрытом респирометре)
Water quality— Preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium (Подготовка и обработка плохо растворимых в воде органических соединений для последующей оценки их биоразлагаемости в водной среде)
Water quality — Selection of tests for biodegradability (Качество воды. Выбор методов оценки биоразлагаемости)
[9]
[Ю]
[11]
[12]
JIS К 6950:1994 Plastics Testing Method for Aerobic Biodegradability by Activated Sludge
KITANO. M., and YAKABE, Y., Strategy for Biodegradability Testing in OECD. Edited by Y. Doi and K. Fukuda, Biodegradable Plastics and Polymers, Elsevier, Amsterdam, pp. 217—227
SAWADA. H. (1994), Field Testing of Biodegradable Plastics, Edited by Y. Doi and K. Fukuda, Biodegradable Plastics and Polymers, Elsevier, Amsterdam, pp. 298—312
SPERANDIO, A., and PUCHNER, P. Bestimmung der Gesamtproteine als Biomasse-Parameter in waBrigen Kulturen und auf Tragermaterialien aus Bio-Reaktoren, gwf Wasser. Abwasser. 1993,134 pp. 482—485
Отменен. Действует ASTM D 5296—19 «Стандартный метод определения средней молекулярной массы и молекулярно-массового распределения полистирола методом высокоэффективной эксклюзионной хроматографии».
2> Действует ГОСТ Р ИСО 9408—2016 «Качество воды. Оценка биоразлагаемости органических соединений в водной среде. Метод оценки полной аэробной биоразлагаемости путем определения кислородной потребности в закрытом респирометре».
3> Действует ГОСТ Р ИСО 10634—2016 «Качество воды. Оценка биоразлагаемости органических соединений в водной среде. Подготовка и обработка малорастворимых в воде органических соединений для последующей оценки».
4) Действует ГОСТ Р 56989—2016 «Качество воды. Оценка биоразлагаемости органических соединений в водной среде. Выбор метода оценки».
УДК 678:691.175:006.354
ОКС 83.080.01
Ключевые слова: пластмассы, определение способности к полному анаэробному биологическому разложению в водной среде, измерение потребления кислорода в закрытом респирометре
Редактор Н.В. Таланова
Технический редактор В.Н. Прусакова
Корректор Е.Ю. Митрофанова
Компьютерная верстка И.Ю. Литовкиной
Сдано в набор 26.09.2022. Подписано в печать 06.10.2022. Формат 60*8478. Гарнитура Ариал.
Усл. печ. л. 3,26. Уч-изд. л. 2,24.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «РСТ» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.

