ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТР
ИСО 14852—
2022
ПЛАСТМАССЫ
Определение способности к полному аэробному биологическому разложению в водной среде. Метод с применением анализа выделяемого диоксида углерода
(ISO 14852:2021, Determination of the ultimate aerobic biodegradability of plastic materials in an aqueous medium — Method by analysis of evolved carbon dioxide, IDT)
Издание официальное
Москва Российский институт стандартизации 2022
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением «Российский институт стандартизации» (ФГБУ «РСТ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 230 «Пластмассы, полимерные материалы, методы их испытаний»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 23 сентября 2022 г. № 990-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 14852:2021 «Определение способности пластмасс к полному аэробному биологическому разложению в водной среде. Метод с применением анализа выделяемого диоксида углерода» (ISO 14852:2021 «Determination of the ultimate aerobic biodegradability of plastic materials in an aqueous medium — Method by analysis of evolved carbon dioxide», IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5—2012 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
6 Некоторые элементы настоящего стандарта могут являться объектами патентных прав
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2021
© Оформление. ФГБУ «РСТ», 2022
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные положения
5 Условия проведения испытаний
6 Реактивы
7 Аппаратура
8 Проведение испытаний
9 Вычисления и выражение результатов
10 Достоверность результатов
11 Протокол испытаний
Приложение А (справочное) Принцип устройства системы для измерения выделившегося диоксида углерода (пример)
Приложение В (справочное) Примеры методов определения выделившегося диоксида углерода
Приложение С (справочное) Пример определения углеродного баланса
Приложение D (справочное) Пример определения количества нерастворимого в воде полимера, остающегося в конце испытания на биоразложение, и молекулярной массы полимера...............................................................16
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам................................17
Библиография........................................................................18
Введение
С ростом использования пластмасс их вторичное использование и утилизация стали серьезной проблемой. В первую очередь следует способствовать вторичному использованию. Как один из возможных вариантов решения таких экологических проблем появляются биологически разлагаемые пластмассы. Изделия из пластмасс или упаковочные материалы, отправляемые на предприятия по компостированию, должны быть потенциально биологически разлагаемыми. Следовательно, очень важно определить потенциальную биоразлагаемость таких материалов и получить общее представление об их потенциальной биоразлагаемости.
ГОСТ Р ИСО 14852—2022
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПЛАСТМАССЫ
Определение способности к полному аэробному биологическому разложению в водной среде. Метод с применением анализа выделяемого диоксида углерода
Plastics. Determination of the ultimate aerobic biodegradability in an aqueous medium. Method by analysis of evolved carbon dioxide
Дата введения — 2023—03—01
ПРЕДУПРЕЖДЕНИЕ — Сточные воды и активный ил могут содержать потенциально патогенные организмы. Поэтому при обращении с ними следует соблюдать соответствующие меры предосторожности. С токсичными испытуемыми соединениями и соединениями, свойства которых неизвестны, следует обращаться с осторожностью.
1 Область применения
Настоящий стандарт устанавливает метод измерения количества выделяемого диоксида углерода для определения степени аэробного биологического разложения пластмасс, в том числе содержащих добавки. Испытуемый материал подвергается воздействию инокулята из активного ила в аэробных условиях искусственной среды, созданной в стандартных лабораторных условиях.
Условия испытаний, используемые в настоящем стандарте, не всегда соответствуют оптимальным условиям, обеспечивающим возможность максимального биоразложения, тем не менее данный метод разработан для измерения биологического разложения пластмасс и дает представление об их потенциальной способности к биоразложению.
Метод позволяет улучшить оценку биоразложения путем вычисления углеродного баланса (при необходимости см. приложение С).
Метод распространяется на следующие материалы:
- природные и/или синтетические полимеры, сополимеры или их смеси;
- пластмассы, содержащие такие добавки как пластификаторы, красители или другие соединения;
- водорастворимые полимеры;
- материалы, которые в условиях испытаний не ингибируют микроорганизмы, присутствующие в инокуляте. Влияние ингибирования можно определить с помощью проверки ингибирования или другим подходящим методом (см., например, [1]). Если испытуемый материал ингибирует инокулят, допускается использовать более низкую концентрацию испытуемого материала, другой инокулят или предварительно экспонированный инокулят.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт [для датированной ссылки применяют только указанное издание ссылочного стандарта, для недатированной — последнее издание (включая все изменения)]:
ISO 8245, Water quality — Guidelines for the determination of total organic carbon (TOC) and dissolved organic carbon (DOC) [Качество воды. Рекомендации по определению общего органического углерода (ТОС) и растворенного органического углерода (DOC)]
Издание официальное
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
ИСО и МЭК поддерживают терминологические базы данных, используемые в стандартизации по следующим адресам:
- платформа онлайн-просмотра ИСО: доступна по адресу https://www.iso.org/obp
- Электропедия МЭК: доступна по адресу //www.electropedia.org/
3.1 полное аэробное биологическое разложение (ultimate aerobic biodegradability): Коэффициент разложения, выраженный в процентах, органического соединения микроорганизмами в присутствии кислорода на углекислый газ, воду и минеральные соли других присутствующих элементов (минерализация) плюс новая биомасса.
3.2 активный ил (activated sludge): Смесь органических материалов и биомассы, полученная при аэробной очистке сточных вод в результате роста бактерий и других микроорганизмов в присутствии растворенного кислорода.
3.3 содержание взвешенных веществ (concentration of suspended solids): Количество сухого вещества, полученного путем фильтрации или центрифугирования известного объема активного ила (3.2) и высушивания при температуре приблизительно 105 °C до постоянной массы.
3.4 растворенный неорганический углерод; DIC (dissolved inorganic carbon, DIC): Часть неорганического углерода в воде, которая не может быть удалена посредством установленного разделения фаз.
Примечание 1 — Разделение фаз может быть достигнуто, например, центрифугированием при 40 000 мс-2 в течение 15 мин или фильтрацией с использованием мембранного фильтра с диаметром пор от 0,2 до 0,45 мкм.
3.5 теоретическое количество образующегося диоксида углерода; ThCO2 (theoretical amount of evolved carbon dioxide, ThCO2): Максимальное теоретическое количество диоксида углерода, выделяющееся в результате полного окисления химического соединения, вычисленное по молекулярной формуле.
Примечание 1 — Считается по молекулярной формуле.
Примечание 2 — Выражается в миллиграммах диоксида углерода, выделяемого на миллиграмм или грамм испытуемого соединения.
3.6 общий органический углерод; TOC (total organic carbon, TOC): Количество углерода, содержащегося в органическом соединении.
Примечание 1 — Выражается в миллиграммах углерода на 100 мг соединения (по [6], статья 3.14).
3.7 растворенный органический углерод; DOC (dissolved organic carbon, DOC): Часть органического углерода в воде, которая не может быть удалена с помощью установленного разделения фаз.
Примечание 1 — Разделение фаз может быть достигнуто, например, центрифугированием при 40 000 м с-2 в течение 15 мин или фильтрацией с использованием мембранного фильтра с диаметром пор от 0,2 до 0,45 мкм.
3.8 индукционный период (lag phase): Время от начала испытания до достижения адаптации и/или выделения разлагающих микроорганизмов и повышения степени биологического разложения химического соединения или органического вещества приблизительно до 10 % от максимального уровня биологического разложения (3.9).
Примечание 1 — Измеряется в днях.
3.9 максимальный уровень биологического разложения (maximum level of biodegradation): Степень биологического разложения химического соединения или органического вещества в ходе испытания, выше которой не происходит дальнейшего биологического разложения во время испытания.
Примечание 1 — Измеряется в процентах.
3.10 фаза биологического разложения (biodegradation phase): Время от окончания индукционного периода (3.8) испытания до достижения фазы плато (3.11).
Примечание 1 — Измеряется в днях.
3.11 фаза плато (plateau phase): Время от окончания фазы биологического разложения (3.10) до конца испытания.
Примечание 1 — Измеряется в днях.
3.12 предварительное экспонирование (pre-exposure): Предварительная инкубация инокулята (3.14) в присутствии испытуемого химического соединения или органического вещества с целью повышения способности инокулята к биологическому разложению исследуемого материала путем адаптации и/или подбора микроорганизмов.
3.13 предварительное кондиционирование (pre-conditioned): Предварительно инкубированный инокулят в условиях последующего испытания при отсутствии испытуемого химического или органического вещества с целью оптимизации испытания путем акклиматизации микроорганизмов к условиям испытания.
3.14 инокулят (inoculum): Микроорганизмы или другой материал, используемые для посева (инокуляции).
Примечание 1 — Также называют инокулянтом.
3.15 инокуляция (посев) (inoculation): Введение микроорганизмов в питательную среду для запуска биологического процесса.
4 Основные положения
Биоразлагаемость пластмассы определяют с использованием аэробных мезофильных микроорганизмов в водной системе. Испытательная смесь содержит неорганическую среду, органический испытуемый материал (единственный источник углерода и энергии) с концентрацией органического углерода от 100 до 2000 мг/дм3, а также активный ил в качестве инокулята (посевного материала). При использовании более высоких концентраций испытуемого вещества следует применять оптимизированную испытательную среду.
Примечание — Были проведены испытания более низких концентраций органического углерода — от 20 до 40 мг/дм3 и признаны подходящими.
Смесь перемешивают в испытательных сосудах и аэрируют воздухом, не содержащим диоксида углерода, в течение определенного периода времени, зависящего от кинетики биоразложения, но не более 2 мес. Диоксид углерода, выделяющийся при микробиологическом разложении, определяют соответствующим аналитическим методом, примеры которого приведены в приложениях А и В.
Уровень биоразложения определяют путем сравнения количества выделившегося диоксида углерода с теоретическим количеством (ThCO2) и выражают в процентах. Результатом испытания является максимальный уровень биоразложения, определяемый по фазе плато кривой биоразложения. При необходимости для получения дополнительной информации о биоразложении может быть вычислен углеродный баланс (см. приложение С).
В отличие от метода [2], который используется для разных органических соединений, настоящий стандарт специально разработан для определения биологического разложения пластмасс. Необходимые особые требования влияют на выбор инокулята и испытательной среды, и есть возможность улучшения оценки биоразлагаемости путем вычисления углеродного баланса.
5 Условия проведения испытаний
Инкубацию следует проводить в темноте или при рассеянном свете в помещении, в котором отсутствуют испарения, ингибирующие микроорганизмы и поддерживается постоянная температура, предпочтительно от 20 °C до 25 °C, с точностью до ±1 °C.
6 Реактивы
Используют реактивы только квалификации ч. д. а.
6.1 Дистиллированная или деионизированная вода
Дистиллированная или деионизированная вода, не содержащая токсичных веществ (особенно меди) и содержащая менее 2 мг/дм3 DOC.
6.2 Испытательная среда
В зависимости от цели испытания допускается использовать разные испытательные среды. Например, при использовании испытуемого материала в более высоких концентрациях следует использовать оптимизированную испытательную среду (6.2.2) с более высокой буферной емкостью и концентрацией питательных веществ.
6.2.1 Стандартная испытательная среда
6.2.1.1 Раствор А
Растворяют в воде (6.1) следующие компоненты и доводят объем раствора до 1000 см3:
безводный дигидрофосфат калия (КН2РО4).....................8,5 г;
безводный гидрофосфат калия (К2НРО4)........................21,75 г;
дигидрат гидрофосфата натрия (Na2HPO4 • 2Н2О)............33,4 г;
хлорид аммония (NH4CI)..............................................0,5 г.
Правильность состава раствора можно проверить, измерив значение pH, которое должно быть равно 7,4.
6.2.1.2 Раствор В
Растворяют 22,5 г гептагидрата сульфата магния (MgSO4-7H2O) в воде (6.1) и доводят объем раствора до 1000 см3.
6.2.1.3 Раствор С
Растворяют 36,4 г дигидрата хлорида кальция (СаС12-2Н2О) в воде (6.1) и доводят объем раствора до 1000 см3.
6.2.1.4 Раствор D
Растворяют 0,25 г гексагидрата хлорида железа (III) (FeCI3-6H2O) в воде (6.1) и доводят объем раствора до 1000 см3.
Используют свежеприготовленный раствор, чтобы избежать осаждения, или добавляют каплю концентрированной соляной кислоты (HCI) или каплю 0,4 г/см3 водного раствора этилендиаминтетра-уксусной кислоты (EDTA).
6.2.1.5 Подготовка
Чтобы приготовить 1 дм3 испытательной среды, добавляют приблизительно к 500 см3 воды (6.1):
-10 см3 раствора А (6.2.1.1);
- по 1 см3 каждого из растворов В (6.2.1.2), С (6.2.1.3), D (6.2.1.4).
Доводят объем раствора до 1000 см3 водой (6.1).
Используют свежеприготовленную испытательную среду. Растворы от А до С можно хранить до 6 мес в темноте при комнатной температуре. То же самое относится к раствору D при добавлении HCI или EDTA.
6.2.2 Оптимизированная испытательная среда
Оптимизированная среда обладает высокой буферизацией и содержит большее количество неорганических питательных веществ. Это необходимо для поддержания постоянного значения pH в системе во время испытания даже при высоких концентрациях испытуемого материала. Среда содержит приблизительно 2400 мг/дм3 фосфора и 50 мг/дм3 азота и поэтому подходит для концентраций органического углерода в испытуемом материале до 2000 мг/дм3. При использовании более высоких или более низких концентраций испытуемого материала увеличивают или уменьшают соответственно содержание азота для поддержания соотношения C:N примерно 40:1.
6.2.2.1 Раствор Е
Растворяют в воде (6.1) следующие компоненты и доводят объем раствора до 1000 см3:
безводный дигидрофосфат калия (КН2РО4).......................37,5 г;
дигидрат гидрофосфата натрия (Na2HPO4 • 2Н2О)...............87,3 г;
хлорид аммония (NH4CI)..................................................2,0 г.
6.2.2.2 Раствор F (раствор микроэлементов, при необходимости):
Растворяют в 10 см3 водного раствора HCI (25 %, 7,7 моль/дм3) в следующей последовательности: а) 70 мг ZnCI2;
b) 100 мг MnCI2-4H2O;
с) 6 мг Н3ВО3;
d) 190 мг СоС12 • 6Н2О;
е) 3 мг CuCI2-2H2O;
f) 240 мг NiCI2-6H2O;
д) 36 мг Na2MoO4-2H2O;
h) 33 мг Na2WO4-2H2O;
i) 26 мг Na2SeO3-5H2O.
Доводят объем раствора до 1000 водой (6.1).
6.2.2.3 Раствор G (витаминный раствор, при необходимости)
Растворяют в 100 см3 воды (6.1) 0,6 мг биотина, 2,0 мг ниацинамида, 2,0 мг п-аминобензоата, 1,0 мг пантотеновой кислоты, 10,0 мг гидрохлорида пиридоксаля, 5,0 мг цианокобаламина, 2,0 мг фолиевой кислоты, 5,0 мг рибофлавина, 5,0 мг DL-тиоктовой кислоты и 1,0 мг дихлорида тиамина или используют раствор 15 мг дрожжевого экстракта в 100 см3 воды (6.1). Для стерилизации фильтруют раствор с помощью мембранных фильтров (см. 7.6).
Растворы Е и F являются необязательными и их применение не требуется, если используется достаточная концентрация инокулята, например активного ила, почвы или компоста. Рекомендуется готовить растворы порциями по 1 см3 и хранить в холодильнике до использования.
6.2.2.4 Подготовка
Для приготовления 1 дм3 испытательной среды добавляют приблизительно к 800 см3 воды (6.1):
- 100 см3 раствора Е (6.2.2.1), и
- по 1 см3 каждого из растворов В (6.2.1.2), С (6.2.1.3), D (6.2.1.4) и, при необходимости, F (6.2.2.2) и G (6.2.2.3).
Доводят объем раствора до 1000 см3 водой (6.1) и измеряют значение pH.
Правильность состава испытательной среды можно проверить путем измерения значения pH, которое должно составлять 7,0 ± 0,2.
7 Аппаратура
7.1 Следует убедиться, что вся стеклянная посуда тщательно очищена и не содержит органических или токсичных веществ.
Требуется обычное лабораторное оборудование, а также следующее.
7.2 Сосуды для испытаний
Стеклянные сосуды (например, бутыли или конические колбы), приспособленные для продувки газом и встряхивания или перемешивания и оснащенные трубками, непроницаемыми для СО2. Сосуды должны находиться в помещении с постоянной температурой или в термостатируемом аппарате (например, водяной бане).
7.3 Система производства воздуха, не содержащего СО2
Система, обеспечивающая подачу воздуха, не содержащего СО2, со скоростью потока от 50 до 100 см3/мин с постоянной точностью ±10 %, в каждый испытательный сосуд (пример системы, включая испытательные сосуды, приведен в приложении А).
7.4 Аналитическое оборудование для определения диоксида углерода
Аналитический прибор, состоящий из любого подходящего устройства с достаточной точностью, например анализатор СО2 или DIC или прибор для титриметрического определения после полной абсорбции в щелочном растворе (см. примеры в приложении В). Следует обратить внимание, что при использовании анализатора с инфракрасным детектором нет необходимости в воздухе, не содержащем СО2.
7.5 Аналитическое оборудование для измерения общего органического углерода (ТОС) и растворенного органического углерода (DOC) приведено в ИСО 8245.
7.6 Аналитические весы.
7.7 Центрифуга или фильтрующее устройство с мембранными фильтрами (диаметр пор 0,45 мкм), которые не адсорбируют и не выделяют в значительной степени органический углерод.
7.8 рН-метр.
7.9 Магнитная мешалка или встряхивающее устройство.
8 Проведение испытаний
8.1 Испытуемый материал
Должна быть известна масса испытуемого материала, содержащего достаточное количество углерода, чтобы продуцируемый СО2 можно было адекватно измерить используемой аналитической системой. Вычисляют ТОС по химической формуле или определяют подходящим аналитическим методом (например, элементным анализом или измерением по ИСО 8245) и вычисляют ThCO2. Используют такую концентрацию испытуемого материала, чтобы содержание ТОС составляло не менее 30 мг/дм3, предпочтительно 100 мг/дм3. Максимальное количество испытуемого материала ограничено подачей кислорода в испытательную систему и используемой испытательной средой. При использовании большего количества испытуемого материала следует использовать оптимизированную испытательную среду (6.2.2), но в любом случае концентрация испытуемого материала должна быть такой, чтобы значение ТОС не превышало приблизительно 2000 мг/дм3, т. е. соотношение C:N было приблизительно 40:1. При необходимости проверки более высоких концентраций, увеличивают количество азота в испытательной среде.
Примечание — Были проведены испытания меньших количеств испытуемых материалов, соответствующих содержанию ТОС от 20 до 40 мг/дм3, и признаны подходящими.
Испытуемый материал предпочтительно использовать в виде порошка, но его также можно вводить в виде пленок, кусочков, фрагментов или фигурных изделий. Вид и форма испытуемого материала могут влиять на его биоразложение. Желательно использовать аналогичные формы, если необходимо сравнить разные виды пластмасс. Если испытуемый материал используют в виде порошка, следует использовать частицы известного узкого гранулометрического состава. Рекомендуется гранулометрический состав с диаметром не более 250 мкм. Кроме того, размер используемого испытательного оборудования может зависеть от формы испытуемого материала. Следует убедиться, что из-за условий испытаний, например типа используемого механизма для перемешивания, не происходит существенных механических отклонений. Обработка испытуемого материала (например, использование порошка в случае композитов) не должна существенно влиять на поведение материала при разложении. При необходимости регистрируют содержание водорода, кислорода, азота, фосфора и серы и молекулярную массу испытуемого полимерного материала, используя, например, жидкостную эксклюзионную хроматографию (см., например, [7] или другой соответствующий стандартный метод). Рекомендуется проводить испытания, используя пластмассы, не содержащие добавок, таких как пластификаторы. Если материал содержит такие добавки, то для оценки биоразлагаемости самого полимера будет необходима информация о биоразлагаемости добавок.
Подробная информация об обращении с плохо растворимыми в воде веществами приведена в [3].
8.2 Эталонный материал
В качестве эталонного материала используют хорошо охарактеризованный биоразлагаемый полимер (например, порошок микрокристаллической целлюлозы, беззольные целлюлозные фильтры или поли-0-гидроксибутират). Если возможно, ТОС, форма (внешний вид) и размер должны быть сопоставимы с испытуемым материалом.
В качестве отрицательного контроля допускается использовать биологически неразлагаемый полимер (например, полиэтилен) той же формы, что и испытуемый материал.
8.3 Приготовление инокулята
8.3.1 Основные положенияПодходящим источником инокулята является активный ил с очистных сооружений, предназначенных для очистки преимущественно бытовых сточных вод. Он может быть получен в активной аэробной среде и доступен в широком диапазоне географических зон. При необходимости определения биоразложения на конкретном предприятии по переработке отходов отбирают инокулят из этой среды.
Инокулят может быть приготовлен из источников, приведенных в 8.3.2, для получения разнообразной и концентрированной микробной флоры с достаточной активностью биоразложения. Если эндогенная респирация инокулята избыточна, перед использованием пассивируют инокулят путем аэрации. Температуру испытания согласовывают с используемым инокулятом (см. раздел 5).
8.3.2 Инокулят из очистных сооружений
Отбирают пробу активного ила на хорошо работающей установке по очистке сточных вод или в лаборатории, обрабатывающей преимущественно бытовые сточные воды. Затем тщательно перемешивают, хранят в аэробных условиях и предпочтительно используют его в день сбора (но не позднее 72 ч).
Перед использованием определяют концентрацию взвешенных веществ (например, по [4]). При необходимости концентрируют ил путем осаждения таким образом, чтобы объем ила, добавляемого в испытуемый образец, был минимальным. Добавляют соответствующий объем, для получения концентрации взвешенных веществ в конечной смеси от 30 до 1000 мг/дм3.
При определении углеродного баланса (см. приложение С) рекомендуется использовать концентрацию взвешенных веществ в инокуляте 30 мг/дм3. Поскольку твердые вещества могут мешать определению углеродного баланса, рекомендуется следующая процедура приготовления инокулята. Отбирают 500 см3 активного ила и гомогенизируют 2 мин на средней скорости в блендере или подходящем высокоскоростном миксере. Дают отстояться не менее 30 мин, чтобы надосадочная жидкость не содержала значительных количеств взвешенных веществ. Декантируют достаточный объем надосадочной жидкости и добавляют ее в испытательные колбы, для получения объемной концентрации от 1 % до 5 % в испытательной среде. Следует избегать переноса частиц осадка.
Инокулят может быть предварительно кондиционирован, но, как правило, не следует использовать предварительно экспонированный инокулят. В зависимости от цели испытания может быть использован предварительно экспонированный инокулят, при условии, что это четко указано в протоколе испытаний (например, процент биоразложения = х % при использовании предварительно экспонированного инокулята) и подробно описан метод предварительного воздействия. Предварительно экспонированный инокулят может быть получен в результате лабораторных испытаний на биоразложение (см. [5]), проводимых в разных условиях, или на образцах, отобранных в местах с соответствующими условиями окружающей среды (например, на загрязненных территориях или на промышленных очистных сооружениях).
8.4 Проведение испытаний
Обеспечивают достаточное количество сосудов, чтобы в испытания было включено как минимум следующее:
а) три сосуда для испытуемого материала FT;
b) три сосуда для контрольного опыта FB;
с) три сосуда для проверки активности инокулята с использованием эталонного материала Fc.
Для предварительной проверки вместо трех сосудов могут использоваться по два сосуда — для испытуемого и эталонного материала и контрольного опыта. И при необходимости:
d) один сосуд для проверки возможного абиотического разложения или небиологических изменений в исследуемом материале, например, в результате гидролиза Fs. Раствор для испытаний Fs стерилизуют, например, автоклавированием или добавлением подходящего неорганического токсичного соединения для предотвращения микробной активности. Используют, например, 5 см3/дм3 раствора, содержащего 10 г/дм3 хлорида ртути (II) (HgCI2). При необходимости добавляют такое же количество токсичного вещества во время испытания;
е) один сосуд в качестве отрицательного контроля FN с использованием биологически неразлага-емого полимера (например, полиэтилена) той же формы, что и испытуемый материал;
f) один сосуд для проверки возможного ингибирующего действия испытуемого материала на микробную активность Fr Следят за тем, чтобы отношение углерода к азоту C:N в среде испытуемого и эталонного материалов составляло не менее 40:1. При необходимости добавляют азот.
Добавляют соответствующие количества испытательной среды (6.2) и инокулята (см. 8.3) в испытательные колбы, как приведено в таблице 1.
Таблица 1 — Окончательное распределение испытуемых и эталонных материалов
Сосуд | Испытуемый материал | Эталонный материал | Инокулят |
FT— испытуемый материал | + | - | + |
FB— контрольный опыт | - | - | + |
Fc — проверка инокулята | - | + | + |
Fs—проверка абиотического разложения (при необходимости) | + | - | - |
F| — проверка ингибирующего действия (при необходимости) | + | + | + |
Fn — отрицательный контроль (при необходимости) | - | + | + |
Подключают сосуды к системе получения воздуха, не содержащего СО2 (см. приложение А). Инкубируют при заданной температуре испытания (см. раздел 5) и аэрируют сосуды в течение 24 ч для удаления двуокиси углерода из системы. При более высоких температурах для предотвращения попадания или утечки жидкости используют соответствующее оборудование. В течение всего испытания содержимое сосудов перемешивают с помощью магнитной мешалки или шейкера. Если наблюдается чрезмерное пенообразование, заменяют продувку воздухом аэрацией с перемешиванием. После предварительной аэрации подсоединяют выход воздуха из каждой колбы к системе улавливания или измерения диоксида углерода.
При необходимости определения баланса углерода (см. приложение С) отбирают фиксированный достаточный объем инокулированной испытательной среды из каждого сосуда или из дополнительных сосудов для определения DOC и биомассы в начале и в конце инкубации. Учитывают удаленный объем при корректировке окончательного объема или при вычислении результатов испытания.
Помещают испытуемый и эталонный материал (см. 8.1), эталонный материал и материал отрицательного контроля (см. 8.2) в соответствующие сосуды, как приведено в таблице 1, и начинают испытание, барботируя через сосуды воздух, не содержащий СО2, для обеспечения достаточного количества кислорода в течение всего испытания. Обычно подходит скорость от 50 до 100 см3/мин.
Регулярно, в зависимости от скорости выделения диоксида углерода, измеряют количество диоксида углерода, выделившегося из каждого сосуда, используя подходящий и достаточно точный метод (см. приложение В).
Испытание считают завершенным при достижении постоянного уровня выделения диоксида углерода (фазы плато), когда дальнейшее биоразложение не предполагается. Время проведения испытания, как правило, не должно превышать 2 мес. Однако если продолжается наблюдение значительного биоразложения и фаза плато не достигнута по истечении указанного промежутка времени, то время испытания может быть продлено, но не более чем на 6 мес. В случае длительных испытаний особое внимание следует уделять технической системе (например, герметичности испытательных сосудов и соединений, отсутствию проникновения диоксида углерода и утечек).
В последний день испытания измеряют значение pH, затем подкисляют содержимое всех сосудов 1 см3 концентрированной соляной кислоты для разложения карбонатов и бикарбонатов и аэрируют для удаления диоксида углерода. Продолжают аэрацию в течение 24 ч и измеряют количество диоксида углерода, выделившегося в каждой серии сосудов (FT, FB, Fc и т.д.).
9 Вычисления и выражение результатов
9.1 Вычисления
9.1.1 Теоретическое количество диоксида углерода, выделяемого испытуемым материаломВычисляют теоретическое количество выделяемого диоксида углерода ThCO2 в миллиграммах по формуле
44
ThCO2 = т-Хс—, (1)
где т — масса испытуемого материала, введенного в испытательную систему, мг;
Хс — содержание углерода в испытуемом материале, определенное по химической формуле или вычисленное на основе элементного анализа, массовая доля;
44 — молекулярная масса диоксида углерода;
12 — молекулярная масса углерода.
Аналогичным образом вычисляют теоретическое количество диоксида углерода, выделяемого эталонным материалом в сосуде Fc и смесью испытуемого и эталонного материалов в колбе Fr
9.1.2 Процент биоразложения по выделению СО2
Вычисляют процент биоразложения Dt для сосудов с испытуемым материалом FT по количеству выделенного диоксида углерода для каждого интервала измерения по формуле
У(СО2)Т-У (CO2)R
Dt = —--- 7т ■ 100,
f ThCO2
___ vvrn \ — количество диоксида углерода, выделившегося в сосуде с испытуемым материалом FT где д^ си2 т
z 1 между началом испытания и моментом времени t, мг;
У fCO 1 — количество диоксида углерода, выделившегося в сосуде с контрольной пробой FB меж-
2 в ду началом испытания и временем t, мг;
ThCO2 — теоретическое количество диоксида углерода, выделяемого исследуемым материалом, мг.
По возможности вычисляют среднее значение для трех параллельных сосудов. Таким же образом вычисляют процент биоразложения эталонного материала в сосуде для проверки инокулята Fc и, если предусмотрено, процент биоразложения смеси испытуемого и эталонного материала в сосуде для проверки ингибирующего действия F(, испытуемого материала в сосуде для контроля абиотического разложения Fs и в сосуде для отрицательного контроля FN.
При необходимости определения баланса углерода вычисляют степень биоразложения испытуемого материала по количеству выделившегося диоксида углерода и содержание углерода в биомассе, образовавшейся во время испытания (см. приложение С).
9.2 Выражение и интерпретация результатов
Составляют таблицу значений выделившегося диоксида углерода и процента биоразложения для каждого интервала измерений и каждого испытательного сосуда. Для каждого сосуда строят графики зависимости выделившегося диоксида углерода и процента биоразложения от времени. Если для трех параллельных сосудов получены сопоставимые результаты, можно построить график среднего значения.
Максимальный уровень биоразложения, определяемый как среднее значение фазы плато кривой биологического разложения или максимальное значение, например когда кривая понижается или в дальнейшем медленно повышается в фазе плато, характеризует степень биоразложения испытуемого материала. Если был определен углеродный баланс, результат этого определения характеризует общую степень биоразложения.
На полученный результат могут влиять смачиваемость и форма испытуемого материала, и, следовательно, процедура испытания может быть ограничена сравнением пластмасс с аналогичной химической структурой.
При интерпретации результатов испытаний, показывающих низкую биоразлагаемость, может быть полезна информация о токсичности испытуемого материала.
10 Достоверность результатов
Испытание признается достоверным, если:
а) степень биоразложения эталонного материала (Fc проверка инокулята) составляет более 60 % в конце испытания;
Ь) количество диоксида углерода, выделившегося в контрольном опыте FB в конце испытания, не превышает верхнего предельного значения, получаемого практическим путем (это значение зависит от количества инокулята и составляет, как показали межлабораторные испытания, например, в случае 30 мг/дм3 сухого вещества, приблизительно 90 мг/дм3);
с) количество диоксида углерода, выделившегося из трех контрольных опытов FB и трех сосудов для испытуемого материала FT, находится в пределах 20 % от среднего значения на фазе плато или в конце испытания.
Если в сосуде F( (проверка ингибирующего действия, при использовании) процент биоразложения менее 25 % и значительного разложения испытуемого материала не наблюдалось, можно предположить, что испытуемый материал является ингибирующим.
Если в сосуде Fs (проверка абиотического разложения, при использовании) наблюдается значительное количество (более 10 %) выделившегося диоксида углерода, возможно, имели место процессы абиотического разложения.
Если был включен сосуд FN (отрицательный контроль), не должно наблюдаться значительного количества выделяющегося диоксида углерода (более 10 %).
Если перечисленные критерии не выполняются, повторяют испытания, используя другой предварительно кондиционированный или предварительно экспонированный инокулят.
11 Протокол испытаний
Протокол испытаний должен содержать как минимум следующую информацию:
а) ссылку на настоящий стандарт;
Ь) всю информацию, необходимую для идентификации испытуемых и эталонных материалов, включая их ТОС, ThCO2, химический состав и формулу (если известны), вид, форму и количество/кон-центрацию в испытуемых образцах;
с) основные параметры испытания, включая испытательный объем, используемую испытательную среду, температуру инкубации и конечное значение pH;
d) источник и количество использованного инокулята, включая подробную информацию о предварительном воздействии;
е) используемые аналитические методы, включая методы обнаружения диоксида углерода и определения ТОС, DOC и биомассы;
f) все результаты испытаний, полученные для испытуемых и эталонных материалов (в табличной и графической форме), включая результаты измерений диоксида углерода, значения процента биоразложения и соответствующие графики зависимости этих параметров от времени;
д) продолжительность индукционного периода, фазы биоразложения и максимальный уровень разложения, а также общую продолжительность испытания;
h) любые отклонения в проведении испытаний;
i) любые наблюдаемые отклонения;
j) дату проведения испытаний;
и, при необходимости, если проводили или определяли:
к) результаты проверки абиотического разложения Fs, контроля ингибирования F\ и отрицательного контроля FN;
I) результаты определения углеродного баланса, включая, например:
1) количество углерода в испытуемом материале, окисленного до диоксида углерода,
2) увеличение DOC в испытательной среде во время инкубации за счет водорастворимых веществ,
3) увеличение содержания органического углерода в биомассе во время испытания,
4) содержание углерода в остаточных полимерах в конце испытания, и
5) сумма измеренного углерода, выраженная в процентах от углерода, введенного в качестве испытуемого материала;
гл) колониеобразующие единицы (cfu/см3) в инокулированных испытательных смесях;
п) любую полезную информацию (например, начальная молекулярная масса образца, молекулярная масса остаточного полимера).
Приложение А (справочное)
Принцип устройства системы для измерения выделившегося диоксида углерода (пример)
Сосуды устанавливают последовательно, как показано на рисунке А.1, и соединяют с помощью газонепроницаемых трубок. Через систему при постоянном низком давлении пропускают от 50 до 100 см3/мин воздуха не содержащего СО2. Подсчитывают пузырьки воздуха или используют подходящий регулятор для проверки скорости потока воздуха. Используют искусственный воздух, не содержащий СО2, или сжатый воздух. В последнем случае удаляют СО2 пропусканием воздуха через склянку, содержащую сухую натронную известь, или, по крайней мере, через две промывные склянки с водным раствором гидроксида калия, содержащие, например, 500 см3 10 моль/дм3 раствора КОН. Используют дополнительный индикаторный сосуд, содержащий 100 см3 раствора гидроксида бария [Ва(ОН)2] с концентрацией 0,0125 моль/дм3, для обнаружения присутствия СО2 в воздухе по помутнению раствора. Для предотвращения переброса жидкости допускается использовать пустой сосуд между индикатором и последующей испытательной колбой. Если имеет место биоразложение и в испытательном сосуде образуется СО2, он абсорбируется в последующих емкостях с абсорбером (промывных склянках) и определяется, как приведено в приложении В.
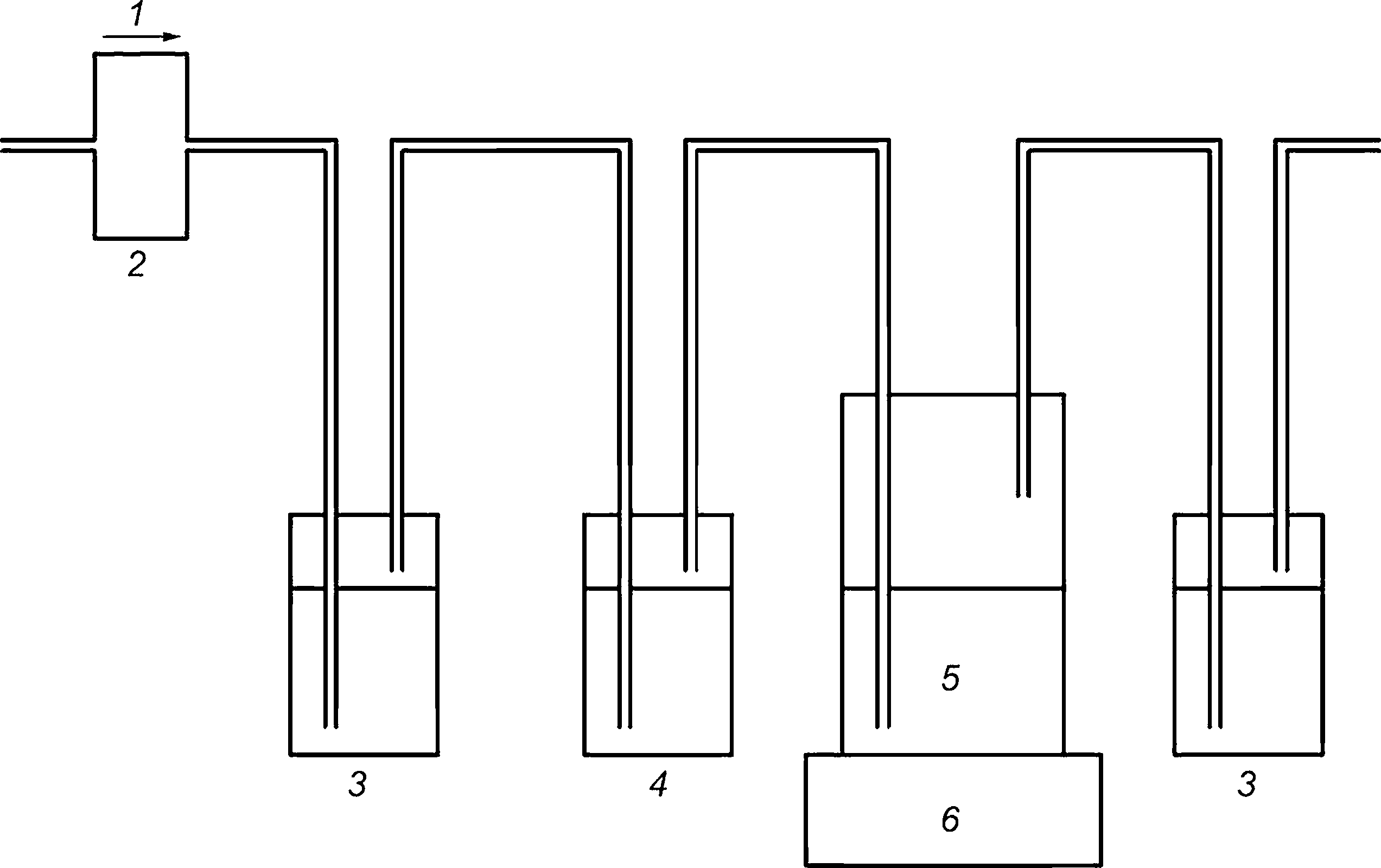
1 — сжатый воздух; 2 — регулятор скорости потока воздуха; 3 — ловушка для диоксида углерода (например, две промывные склянки, содержащие щелочь); 4 — индикатор диоксида углерода [Ва(ОН)2]; 5 — испытательная емкость; 6 — мешалка
Рисунок А.1 — Пример системы для измерения образовавшегося диоксида углерода
Приложение В (справочное)
Примеры методов определения выделившегося диоксида углерода
В.1 Определение СО2 измерением DIC
Выделившийся диоксид углерода абсорбируется раствором гидроксида натрия (NaOH) и определяется как растворенный неорганический углерод (DIC) с использованием, например, анализатора DOC без сжигания.
Готовят раствор 0,05 моль/дм3 NaOH в деионизированной воде. Измеряют DIC этого раствора и используют это значение контрольной пробы при вычислении продуцирования СО2. Соединяют последовательно с испытательным сосудом две промывные склянки, каждая из которых содержит 100 мл раствора NaOH. Закрывают выпускное отверстие последнего сосуда небольшим сифоном для предотвращения попадания СО2 из воздуха в раствор NaOH. Для определения содержания СО2, отсоединяют первую промывную склянку от испытательной колбы и отбирают пробу, достаточную для измерения DIC (например, 10 см3). Заменяют промывную склянку на новую со свежеприготовленным раствором NaOH. В последний день после подкисления испытуемого раствора измеряют DIC в обеих промывных склянках.
Вычисляют продуцированный СО2 по формуле
ч (DICT-DICB)• 3,67 m(C02)T ='---т 1OB) . (В.1)
где m(CO2)T — масса выделившегося СО2, мг;
DICT — измеренное значение DIC в сосуде с испытуемым материалом, мг;
DICB — измеренное значение DIC контрольной пробы для раствора NaOH, мг;
3,67 — отношение молекулярной массы СО2 (44) к атомной массе углерода (12);
10 — поправочный коэффициент, учитывающий тот факт, что использовалось 100 см3 раствора NaOH.
В.2 Титриметрический метод с использованием раствора гидроксида бария
Выделившийся СО2 вступает в реакцию с гидроксидом бария [Ва(ОН)2] и осаждается в виде карбоната бария (ВаСО3) [см. формулу (В.2)]. Количество выделившегося СО2 определяют титрованием оставшегося Ва(ОН)2 соляной кислотой (HCI) [см. формулу (В.З)].
СО2 + Ва(ОН)2 ВаСО3 + Н2О, (В.2)
Ва(ОН)2 + 2HCI —>ВаС12 + 2Н2О. (В.З)
Растворяют 4,0 г Ва(ОН)2-8Н2О в деионизированной или дистиллированной воде и доводят объем до 1000 см3 для получения раствора с концентрацией 0,0125 моль/дм3. Рекомендуется приготовить достаточное количество раствора, например 5 дм3, для проведения серии испытаний. Отфильтровывают осадок и определяют точную концентрацию титрованием стандартным раствором HCL Для определения конечной точки используют индикатор фенолфталеин при ручном титровании или применяют автоматический титратор. Хранят прозрачный раствор в герметично закрытом сосуде для предотвращения поглощения СО2 из воздуха.
Разбавляют 50 см3 раствора HCI концентрацией 1 моль/дм3 (36,5 г/дм3) до объема 1000 см3 деионизированной или дистиллированной водой для получения раствора с концентрацией 0,05 моль/дм3.
В начале испытания помещают по 100 см3 раствора Ва(ОН)2 в три промывных склянки. В зависимости от свойств и количества испытуемого материала изменяют объем поглощающего раствора. Периодически отсоединяют ближайшую к испытательной емкости склянку для титрования. Это выполняют по мере необходимости, например когда жидкость в первой склянке мутная и до того, как во второй склянке будет наблюдаться осаждение ВаСО3. В начале испытания может потребоваться титрование через день, а затем при достижении фазы плато — каждый пятый день. После отсоединения промывной склянки сразу закрывают ее пробкой для предотвращения попадания СО2 из воздуха. Перемещают оставшиеся две склянки ближе к испытательному сосуду и в конце присоединяют новую склянку, заполненную свежим раствором Ва(ОН)2. Определяют точную концентрацию раствора, особенно если используют длительные периоды испытаний. Точно также обращаются со всеми сосудами, содержащими испытуемый и эталонный материал, контрольный образец, контроль ингибирования и контроль инокулята.
Сразу после удаления склянки оттитровывают две или три аликвотные порции раствора Ва(ОН)2 раствором HCI. Фиксируют объем раствора HCI, необходимый для нейтрализации.
Вычисляют массу СО2, поглощенного в промывной склянке, по формуле
( 2cr ■ . Чз, ) _ _
™ = „ B0-Va тт2- Сд 22, (В.4)
V СА VBZ )
где т — масса СО2, поглощенного в промывной склянке, мг;
св — точная концентрация раствора Ва(ОН)2, моль/дм3;
Уво — объем раствора Ва(ОН)2 в начале испытания, см3;
сА — точная концентрация раствора НО, моль/дм3;
VA — объем раствора HCI, использованного для титрования, см3;
УВ( — объем раствора Ва(ОН)2 в момент времени t перед титрованием, см3;
\/BZ — объем аликвот раствора Ва(ОН)2, использованных для титрования, см3;
22 — половина молекулярной массы СО2.
В тех случаях, когда выполняются следующие условия:
- объем раствора Ва(ОН)2 до и после поглощения составляет 100 см3;
- для титрования используется полный объем раствора (VB0 = VB? = VBZ);
- концентрация св раствора Ва(ОН)2 составляет 0,0125 моль/дм3;
- концентрация сА раствора НО составляет 0,05 моль/дм3, используют формулу
т = 1,1 • (50- \/А). (В.5)
Приложение С (справочное)
Пример определения углеродного баланса
С.1 Основные положения
Пластмассы, как правило, имеют более сложный состав, чем вещества с низкой молекулярной массой. Одного определения выделения СО2 или биохимического потребления кислорода (BOD) часто недостаточно для характеристики и количественной оценки их биологического разложения. Во время биологического разложения микроорганизмами накапливается новая биомасса, и часть углерода в испытуемом материале превращается в биомассу, но не окисляется биохимически. Следовательно, аналитические параметры, такие как выделение СО2 и BOD, часто не достигают 100 % соответствующих теоретических значений даже в случае полного биоразложения испытуемого материала, а по результатам испытаний может быть ошибочно сделан вывод о недостаточном разложении. Определение общего углеродного баланса, приведенное в данном приложении, может быть полезно в таких случаях для подтверждения полной биоразлагаемости. Такой баланс основан на суммировании количеств углерода, полученных в результате следующих измерений: углерода, выделившегося в виде диоксида углерода, углерода, продуцированного в виде новой биомассы, углерода, преобразованного в водорастворимые органические метаболиты, углерода, определенного как DOC и углерода, оставшегося в неразрушенном полимере. Суммарное количество углерода сравнивается с количеством органического углерода в испытуемом материале, введенном в испытательную систему.
С.2 Процедура испытаний
Определяют количество выделившегося диоксида углерода, как приведено в 8.4.
Отбирают образцы инокулированной среды в начале испытания, перед добавлением испытуемого материала и в конце периода инкубации. Следует тщательно отбирать пробы для получения представительных образцов. Пропускают пробы через мембранный фильтр или центрифугируют со скоростью приблизительно 40 000 м с-2.
Для каждого образца определяют количество биомассы на фильтре или в осадке, используя соответствующие методы, например измерение протеина. Определяют или предполагают количество углерода в биомассе и по разности вычисляют увеличение органического углерода в биомассе.
В соответствии с ИСО 8245 определяют DOC в фильтрате каждой пробы и вычисляют увеличение содержания органического углерода. Если возможно, определяют вещества, образующие DOC для подтверждения продуцирования водорастворимых метаболитов.
В конце испытания определяют количество углерода в остаточных полимерах, используя весь оставшийся образец. Обычно это сложная процедура, и ее можно выполнить напрямую, если доступен анализ для конкретного полимера (см. приложение D), или косвенно. В первом случае извлекают и взвешивают остаточные полимеры и вычисляют количество углерода по их известному составу. Одним из возможных методов непрямого определения является промывка, сушка и взвешивание остатка и определение общего органического углерода (ТОС). Затем вычитают углерод биомассы (см. выше) из ТОС для получения количества углерода в остаточных полимерах. Другая возможность — точно взвесить остаток, а затем обработать его подходящим методом для разрушения биомассы, но не полимеров (это необходимо проверить заранее). Используя, например, гипохлорит натрия, удаляют растворимую часть и снова взвешивают образец. Предполагают, что вся биомасса удалена, и вычисляют по полученной массе содержание полимера в остатке.
С.З Вычисление углеродного баланса
Вычисляют количество биохимически окисленного углерода СС02, мг/дм3, в испытуемом материале, введенном в испытательную систему (содержание углерода СМАТ), исходя из процента биоразложения Dt, полученного в испытании на выделение СО2 (см. 9.1.2) по формуле
Вычисляют увеличение углерода биомассы в колбах, содержащих испытуемый материал Свю мг/дм3, сравнивая биомассу в начале и в конце инкубационного периода с учетом измеренного или вычисленного количества углерода в биомассе в начале Св и конце испытания Св по формуле
^вю = “ Св • (С.2)
Определяют увеличение DOC в течение инкубационного периода CD0C мг/дм3, сравнивая концентрации DOC в начале CDs и конце CDe по формуле
^DOC = ^De “ ^Ds • (С.З)
Определяют количество органического углерода CPOL в остаточных полимерах в конце испытания.
Вычисляют количества различного преобразования углерода в процентах от введенного углерода СМАТ и суммируют для получения количества вычисленного углерода Ccalc, %, по формуле
CCALC = ССО2 + CBIO + CDOC + CPOL • (С-4)
С.4 Пример: углеродный баланс поли(Р-гидроксибутирата)
Введено испытуемого материала: СМАТ = 600 мг/дм3 = 334,8 мг/дм3 углерода.
Степень биоразложения: Dt = 78 %.
Параметр | CBs | ^Ве | Свю | CDs | ^De | ^doc | Ссо2 |
мг/дм3 | 3,2 | 61,0 | 57,8 | 2,0 | 22,0 | 20,0 | 261 |
% от СМАТ | 17,2 | 6,0 | 78 |
Вычисленный углеродный баланс: Ccalc = 78 % + 17 % + 6 % = 101 % СМАТ. Этот пример приведен и адаптирован из [9].
Приложение D (справочное)
Пример определения количества нерастворимого в воде полимера, остающегося в конце испытания на биоразложение, и молекулярной массы полимера
Может быть полезным использование процедуры измерения количества и молекулярной массы полимеров, оставшихся в конце исследования биоразложения. Следующий метод или другой подходящий метод допускается использовать для анализа нерастворимых в воде полимеров, растворяющихся в органических растворителях, не смешивающихся с водой.
а) Переносят испытуемую смесь в делительную воронку, добавляют подходящий органический растворитель и встряхивают от 10 до 20 мин для экстрагирования оставшихся полимеров. Отделяют слой органического растворителя от водного слоя. Добавляют свежий растворитель и повторяют процедуру.
Ь) Объединяют органические экстракты и выпаривают растворитель досуха. Растворяют твердый образец (остаток) в соответствующем объеме подходящего элюата.
с) С помощью микрошприца вводят подходящее количество в аппарат для высокоэффективной жидкостной хроматографии (HPLC), оснащенный колонкой заполненной гелем для эксклюзионной хроматографии. Запускают анализ и записывают хроматограмму.
d) По калибровочной кривой определяют количество присутствующего полимера.
е) Определяют молекулярную массу полимера, вводя в хроматограф идентичный полимер или полимеры, структура которых аналогична структуре испытуемых полимеров и молекулярные массы которых известны. Соотношение между временем удерживания и молекулярной массой получают из результирующей хроматограммы. Вычисляют молекулярную массу, используя это соотношение.
Абсолютную молекулярную массу исследуемого полимера также можно определить с помощью ВЭЖХ с комбинацией малоуглового лазерного светорассеяния (LALLS) и дифференциального рефрактометрического детектора (RI).
Приложение ДА (справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА. 1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 8245 | NEQ | ГОСТ 31958—2012 «Вода. Методы определения содержания общего и растворенного органического углерода» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - NEQ — неэквивалентный стандарт. | ||
Библиография
[1] ISO 8192 | Water quality — Test for inhibition of oxygen consumption by activated sludge for carbonaceous and ammonium oxidation (Качество воды. Испытание на ингибирование поглощения кислорода активным илом при окислении углеродсодержащих и амониевых соединений) |
[2] ISO94391) | Water quality — Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium — Carbon dioxide evolution test (Качество воды. Оценка способности органических соединений к предельному аэробному биологическому расщеплению в водной среде. Метод измерения количества выделенного диоксида углерода) |
[3] ISO 106342) | Water quality—Preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium (Качество воды. Подготовка и обработка плохо растворимых в воде органических соединений для последующей оценки их биоразлагаемости в водной среде) |
[4] ISO 11923 | Water quality — Determination of suspended solids by filtration through glass-fibre filters (Качество воды. Определение содержания взвешенных твердых частиц путем фильтрации через стекловолоконные фильтры) |
[5] ISO/TR 154623 4) | Water quality — Selection of tests for biodegradability (Качество воды. Выбор методов оценки биоразлагаемости) |
[6] ISO 17556:2012 | Plastics — Determination of the ultimate aerobic biodegradability of plastic materials in soil by measuring the oxygen demand in a respirometer or the amount of carbon dioxide evolved (Пластмассы. Определение максимальной способности к аэробному микробиологическому разрушению в почве путем измерения респирометром потребности в кислороде или количества выделяемого диоксида углерода) |
[7] ASTM D 3536-914) Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (GEL Permeation Chromatography — GPC) [Средние значения молекулярной массы и распределение молекулярной массы с помощью жидкостной эксклюзионной хроматографии (гель-проникающая хроматография — GPC)]
[8] Muller R.-J., Augusta J., Pantke M. An Interlaboratory Investigation into Biodegradation of Plastics; Part 1: A Modified Sturm Test. Material and Organisms. 1992, 27 (3) pp. 179—189
[9] Puchner P, Mueller W.R., Bardtke D. Assessing the Biodegradation Potential of Polymers in Screening and Long-Term Test Systems. J. Environ. Polym. Degrad. 1995, 3 pp. 133—143
[10] PUCHNER. P. (1994) Screening-Testmethoden zur Abbaubarkeit von Kunststoffen unteraeroben und anaeroben Bedingungen, Dissertation, Stuttgart University Fakultat fur Bauingenieurwesen, Stuttgarter Berichte zur Abfallwirtschaft, 59, Erich Schmidt Verlag, Berlin
[11] Sperandio A., & Puchner P. Bestimmung der Gesamtproteine als Biomasse-Parameter in walkigen Kulturen und auf Tragermaterialien aus Bio-Reaktoren, gwf Wasser. Abwasser. 1993, 134 pp. 482—485
[12] UrstadtS., Augusta J., MiillerR.-J., DeckwerW.-D. Calculation of Carbon Balancesforthe Evaluation of Biodegradability of Polymers. J. Environ. Polym. Degrad. 1995, 3 (3) pp. 121—131
УДК 678:691.175:006.354
ОКС 83.080.01
Ключевые слова: пластмассы, определение способности к полному анаэробному биологическому разложению в водной среде, анализ выделяемого диоксида углерода
Редактор Н.В. Таланова Технический редактор В.Н. Прусакова Корректор М.В. Бучная Компьютерная верстка Е.О. Асташина
Сдано в набор 26.09.2022. Подписано в печать 27.09.2022. Формат 60х841/8. Гарнитура Ариал. Усл. печ. л. 2,79. Уч.-изд. л. 2,52.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «РСТ» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.
1
) Действует ГОСТ P ИСО 9439—2016 «Качество воды. Оценка биоразлагаемости органических соединений в водной среде. Метод оценки полной аэробной биоразлагаемости путем измерения количества выделенного диоксида углерода».
2
> Действует ГОСТ Р ИСО 10634—2016 «Качество воды. Оценка биоразлагаемости органических соединений в водной среде. Подготовка и обработка малорастворимых в воде органических соединений для последующей оценки»
3
) Действует ГОСТ Р 56989—2016 «Качество воды. Оценка биоразлагаемости органических соединений в водной среде. Выбор метода оценки».
4
) Отменен. Действует АСТМД 5296-19 «Стандартный метод определения средней молекулярной массы и молекулярно-массового распределения полистирола методом высокоэффективной эксклюзионной хроматографии». 18

