ГОСТ Р ИСО 13629-2-2017
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МАТЕРИАЛЫ ТЕКСТИЛЬНЫЕ
Определение противогрибковой активности текстильных изделий
Часть 2
Чашечный метод подсчета
Textiles. Determination of antifungal activity of textile products. Part 2. Plate count method
ОКС 59.080.01
Дата введения 2018-05-01
Предисловие
1 ПОДГОТОВЛЕН Акционерным обществом "Всероссийский научно-исследовательский институт сертификации" (ОАО "ВНИИС") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 412 "Продукция текстильной и легкой промышленности"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 8 августа 2017 г. N 814-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 13629-2:2014* "Материалы текстильные. Определение противогрибковой активности текстильных изделий. Часть 2. Чашечный метод подсчета" (ISO 13629-2:2014 "Textiles - Determination of antifungal activity of textile products - Part 2: Plate count method", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные и действующие в этом качестве межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1 Область применения
Настоящий стандарт устанавливает метод количественного определения противогрибковой активности посредством подсчета колоний на чашках.
Настоящий стандарт применим к различным видам текстильных изделий, например волокнам, пряже, тканям, одежде, постельному белью и другим.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты*. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания, включая любые изменения и поправки.
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 105-F02, Textiles - Tests for colour fastness - Part F02: Specification for cotton and viscose adjacent fabrics (Текстиль. Испытания на устойчивость окраски. Часть F02. Технические условия на хлопчатобумажные и вискозные смежные ткани)
ISO 7218:2007 Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 контрольная ткань (control fabric): Ткань, используемая для подтверждения роста испытуемых грибков.
Примечание 1 - Контрольные образцы отбирают от контрольной ткани.
Примечание 2 - Контрольная ткань может являться той же, что и испытуемая, но не прошедшей противогрибковой обработки. При отсутствии такой возможности для контрольного образца используют ткань из 100%-ного хлопка по ИСО 105-F02, без флуоресцентных осветлителей или другой отделки, после стирки при температуре 60°С без моющих средств или осветлителей, придающих блеск, и механического прокручивания и полоскания.
3.2 противогрибковое средство (antifungal agent): Средство для предотвращения или ослабления роста грибков или снижения их количества.
3.3 противогрибковая обработка (antifungal treatment): Обработка для предотвращения или ослабления роста грибков или снижения их количества.
3.4 суспензия (взвесь) спор (spore suspension): Жидкость с равномерно диспергированными в ней грибковыми спорами в стерилизованной воде, содержащей анионное поверхностно-активное вещество.
3.5 метод подсчета колоний на чашках (plate count method): Метод, с помощью которого подсчитывают количество грибков, присутствующих после инкубации, по числу колоний, подсчитанных методом десятикратных разведений
Примечание - Результаты выражают в колониеобразующих единицах (КОЕ).
3.6 нейтрализатор (neutralizer): Химическое вещество, использующееся для дезактивации, нейтрализации или подавления противогрибковых свойств противогрибковых средств.
4 Сущность метода
Испытуемый и контрольный образцы засевают суспензией спор референтных штаммов грибков и инкубируют при температуре 30°С в течение 48 ч.
В настоящем стандарте рост грибков или противогрибковую активность определяют количественно посредством визуального подсчета колоний на чашке с агаровой средой в единицах КОЕ, а грибковую активность вычисляют по КОЕ.
Если образец абсорбирует воду, то рекомендуется использовать метод поглощения. Если образец не поглощает воду, то рекомендуется метод переноса.
5 Меры предосторожности
Установленные в настоящем стандарте методы требуют применения грибков.
Согласно ИСО 7218 такое испытание должен выполнять персонал, обладающий соответствующей подготовкой и опытом в сфере микробиологических исследований.
Обязательным являются ознакомление и соблюдение требований всех регламентов, правил и рекомендаций, касающихся соответствующих мер безопасности, в стране, где проводят эти испытания.
6 Референтные штаммы грибков
Применяемые грибки выбирают по таблице А.1 приложения А.
Можно использовать равноценные типы грибков, полученные от других агентств Всемирной Федерации коллекций культур (WFCC) по согласованию между заинтересованными сторонами.
В протоколе испытания необходимо указать номер штамма в коллекции и источник поставки использованных грибков.
7 Аппаратура
Обычное лабораторное оборудование и, в частности, следующее (при необходимости все позиции перед применением рекомендуется стерилизовать).
7.1 Марля стерилизованная.
7.2 Чашки Петри из стекла или пластика диаметрами приблизительно 90 и от 55 до 60 мм.
7.3 Автоклав, обеспечивающий поддержание температуры на уровне (121±2)°С (эквивалентно 103 кПа).
7.4 Платиновая петля для работы с колониями диаметром от 2 до 4 мм (или пластиковый эквивалент).
7.5 L-образный платиновый крюк для работы с колониями (или пластиковый эквивалент).
7.6 Инкубатор (термостат), обеспечивающий поддержание температуры в целевом диапазоне от 20°С до 37°С с допуском ±2°С.
7.7 Стеклянный флакон объемом 30 см, с навинчивающейся полипропиленовой крышкой с прокладкой из политетрафторэтилена (ПТФЭ) или силикона. Необходимо тщательно промыть в щелочном или нейтральном моющем средстве, сполоснуть и высушить.
7.8 Стеклянная воронка.
7.9 Пипетки объемом 0,05, 1, 5 и 10 см с допуском 5,0%, или меньшего объема, с наконечником из стекла или пластика.
7.10 Пипетка Пастера для микробиологических исследований (или пластиковый эквивалент).
7.11 Коническая колба объемом от 100 до 500 см.
7.12 Пинцет, изготовленный из материала, который можно стерилизовать.
7.13 Центрифуга с ускорением приблизительно 2000g.
7.14 Пробирки для центрифуги.
7.15 Гемоцитометр, обеспечивающий измерение от 1·10/см
до 3·10
/см
.
7.16 Микроскоп с увеличением 200Х.
7.17 Компактный ультразвуковой очиститель для лабораторных инструментов, частотой приблизительно от 30 до 50 кГц.
7.18 рН-метр точностью со стеклянными электродами для биохимических исследований или равноценный.
7.19 Колба Эрленмейера объемом 100 см.
7.20 Шаблон для резки из нержавеющей стали диаметром (3,8±0,1) см.
7.21 Гиря из нержавеющей стали массой (200±10) г и диаметром (3,5±0,1) см.
7.22 Устройство для встряхивания, способное производить встряхивание на вортексе.
7.23 Лопастная мешалка [по типу гомогенизатора Stomacher], обеспечивающая скорость от 6 до 8 ударов/с с подходящими контейнерами однократного применения.
7.24 Камера влажности, камера искусственного тропического климата или другая емкость, обеспечивающая поддержание условий высокой влажности.
7.25 Холодильник, обеспечивающий поддержание температуры на уровне от 2°С до 8°С при допуске ±2°С.
7.26 Морозильные камеры, с настройкой на температуры ниже 70°С, и ниже 20°С при допуске ±2°С.
7.27 Весы, обеспечивающие удобство считывания показания до 0,01 г.
7.28 Пластиковые мешки однократного применения для пищевых продуктов, которые используют для выемки пробы.
7.29 Бокс для микробиологических тестов (MSC Тип II) или другая система с аналогичными характеристиками.
7.30 Водяные бани, одна - для поддержания постоянной температуры (46±2)°С, другая - для поддержания температуры от 70°С до 90°С.
8 Реактивы и питательные среды
Реактивы, используемые в испытаниях, должны быть аналитической чистоты и/или марки, соответствующей применению в микробиологических анализах.
Обезвоженные продукты, имеющиеся в продаже, рекомендуется использовать при приготовлении питательных сред строго в соответствии с инструкциями изготовителя.
8.1 Чистая вода
Вода аналитической чистоты для микробиологических сред и приготовления реактивов, которая получена непосредственно после дистилляции и/или ионообменника, или ультрафильтра и/или профильтрована с помощью обратного осмоса (ОО = RO). Она не должна содержать токсичных или подавляющих рост грибков веществ.
8.2 Анионное поверхностно-активное вещество
Диоктилсульфосукцинат натрия для приготовления суспензии спор. Концентрация анионного поверхностно-активного вещества в чистой воде (8.1) составляет 50 мг/дм. Стерилизуют этот раствор в автоклаве (7.3) при температуре 121°С в течение 20 мин.
8.3 Питательная среда
Используют питательную среду, приготовленную, как описано ниже. Можно использовать готовые имеющиеся в продаже среды после соответствующего подтверждения правильности выбора.
Для питательных сред, которые не будут использованы сразу же после приготовления, рекомендуется хранение при температуре от 5°С до 10°С сроком хранения не более 1 месяца.
8.3.1 Бульон Сабуро с декстрозой (SDB)
Пептон | 10 г. |
Декстроза | 20 г. |
Чистая вода | 1000 см |
Уровень рН после стерилизации | 5,6±0,2. |
8.3.2 Картофельный агар с декстрозой (PDA)
Вытяжка из картофеля | 200 г. |
Декстроза | 20 г. |
Агар | 15 г. |
Чистая вода | 1000 см |
Уровень рН после стерилизации. | 5,6±0,2. |
Эта среда способствует спорообразованию грибков. |
8.3.3 Агар Сабуро с декстрозой (SDA)
Пептон мясной пепсиновый | 10 г. |
Декстроза | 40 г. |
Агар | 15 г. |
Чистая вода | 1000 см |
Необходимо следовать инструкциям поставщика. | |
Уровень рН после стерилизации | 5,6±0,2. |
Примечание - Данная среда будет использована для метода переноса.
8.3.4 Культура на скошенном агаре
8.3.4.1 Наливают приблизительно 10 см предварительно нагретого и полностью растворенного агара PDA (см. 8.3.2) в стерилизованную пробирку.
8.3.4.2 Затыкают пробирку пробкой из хлопковой ваты и стерилизуют паром.
8.3.4.3 После стерилизации помещают пробирку под углом приблизительно 15° относительно горизонтального уровня на чистом лабораторном столе и оставляют до застывания содержимого.
8.3.4.4 Если на застывшем агаре не выступает вода, то для использования растворяют и отверждают среду заново.
8.3.5 Нейтрализующий раствор, среда SCDLP
Полисорбат 80 | 30 г. |
Лецитин яичного желтка | 3 г. |
Гистидина гидрохлорид | 1 г. |
Мясной или казеиновый пептон | 1 г. |
Хлорид натрия (NaCI) | 4,3 г. |
Дигидрофосфат калия | 3,6 г. |
Гидрофосфат натрия обезвоженный | 7,2 г. |
Вода | 1000 см |
Уровень рН после стерилизации | 7,2±0,2. |
Если невозможно достичь достаточной нейтрализующей силы, можно отрегулировать содержимое полисорбата 80 или лецитина, или добавить другое нейтрализующее вещество. Имеющиеся в продаже растворы нейтрализаторов можно использовать после тестирования их эффективности (см. приложение В). Применение неустановленного нейтрализатора необходимо указать в протоколе с наименованием и концентрацией.
9 Консервация и использование грибков
9.1 Контрольные грибки и споры пересевают и работают с ними в стерильном боксе (7.29) или равноценном помещении.
9.2 Стерилизуют ватные пробки, горловины пробирок в пламени или химическим способом до и после пересева.
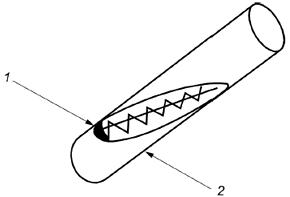
9.3 Соскребают небольшое количество грибков с первичных грибков, распределяют споры по выступившей воде в нижней части скошенного агара (8.3.4) и смазывают до верхнего конца скошенной поверхности прямым мазком или зигзагом (см. рисунок 1).
9.4 Каждый раз при пересеве грибков другого типа пользуются заново стерилизованными в пламени платиновой (бактериологической) петлей (7.4) и крюком (7.5).
9.5 Помещают засеянный скошенный агар в инкубатор (7.6) при температуре (25±2)°С как минимум на восемь дней и, прежде чем консервировать их при температуре от 5°С до 10°С, подтверждают, что образовалось достаточное количество спор.
9.6 В течение трех месяцев пересаживают пересеянные грибки на новый скошенный агар для последующей инкубации и консервации.
9.7 Повторяют пересев с интервалом до трех месяцев. Пересеваемую культуру, однако, не следует пересевать более пяти раз. Нельзя использовать грибки старше трех месяцев для дальнейшего субкультивирования.
Примечание - Длительная консервация возможна методом лиофилизации при температуре минус 80°С.
|
1 - выступившая вода; 2 - скошенный агар
Рисунок 1 - Пересев на скошенный агар
10 Суспензия спор
10.1 Общие положения
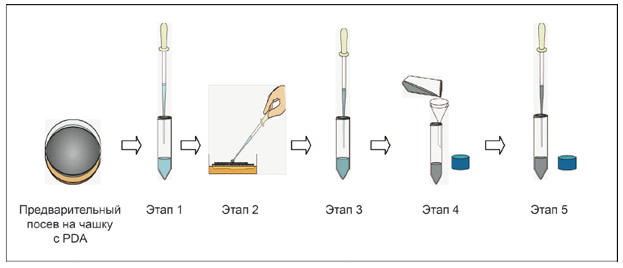
См. рисунок 2.
|
1 - предварительный посев на чашку с PDA; 2 - этап 1; 3 - этап 2; 4 - этап 3; 5 - этап 4; 6 - этап 5
Рисунок 2 - Этапы процедуры для приготовления суспензии спор
10.2 Суспендирование спор в питательной среде
10.2.1 Пользуются короткой пипеткой Пастера (см. 7.10) или аналогичным приспособлением для забора 0,5 см стерилизованной воды, содержащей анионное поверхностно-активное вещество (см. 8.2) (этап 1).
10.2.2 Медленно выпускают ее примерно в пять приемов на споры в центре чашки с агаром, чтобы осторожно смыть поверхность (этап 2).
Примечание - Допускаются небольшие изменения, например, увеличение количества воды для смыва. Все условия в таких случаях записывают.
10.3 Сбор и диспергирование суспензии спор из питательной среды
10.3.1 Суспензию спор (10.2) берут с помощью пипетки Пастера (7.10) или аналогичного приспособления.
10.3.2 Переносят ее приблизительно в 5 см стерилизованной воды, содержащей анионное поверхностно-активное вещество (8.2).
10.3.3 Пипеткой "забирают-выпускают" 100 раз или перемешивают суспензию на специальном устройстве для встряхивания (7.22) три раза в течение 20 с или применяют легкую ультразвуковую очистку в течение 5 мин для того, чтобы споры диспергировали в достаточной степени.
10.3.4 Визуально проверяют, чтобы суспензия выглядела слегка мутной (этап 3).
10.4 Фильтрование для удаления гиф и нитей
Для фильтрования пользуются воронкой (7.8) или другим приспособлением с марлей (7.1) или стекловатой (этап 4).
Примечание - Марля (7.1) или стекловата могут состоять из сложенных в стопку от 3 до 5 слоев в форме квадрата стороной 5x5 см.
10.5 Использование разделения на центрифуге и повторное суспендирование для удаления надосадочной жидкости
10.5.1 После фильтрования выполняют разделение на центрифуге приблизительно при ускорении 2000g в течение не менее 5 мин при температуре (25±2)°С или при комнатной температуре, если центрифуга (см. 7.13) не имеет устройства для контроля температуры.
10.5.2 Удаляют надосадочную жидкость.
10.5.3 Добавляют 5 см анионного поверхностно-активного вещества (8.2) в 10.5.2.
10.5.4 Осторожно перемешивают с помощью пипетки, чтобы диспергировать споры, или с помощью устройства для встряхивания (7.22), или, применяя легкую ультразвуковую очистку в течение примерно 5 мин, чтобы споры были диспергированы в достаточной степени (этап 5).
10.6 Подтверждение концентрации суспензии спор
Проверяют следующие позиции на гемоцитометре.
10.6.1 Подсчет спор и статус спор: подтверждают, что количество спор составляет от 1·10/см
до 3·10
/см
и что более 90% спор являются отдельными спорами без гиф.
10.6.2 В случае слишком большого количества спор разводят суспензию стерилизованной водой, содержащей анионное поверхностно-активное вещество (8.2), чтобы снизить число спор от 1·10/см
до 3·10
/см
, снова проверяют количество спор.
10.6.3 В случае недостаточного количества спор повторяют центрифугирование, чтобы удалить надосадочную жидкость, и используют стерилизованную воду, содержащую анионное поверхностно-активное вещество (8.2) для регулирования числа спор на уровне от 1·10/см
до 3·10
/см
, и снова подсчитывают споры.
10.7 Регулирование суспензии для анализа
10.7.1 Для метода поглощения используют 1/20 SDB в поверхностно-активном веществе (8.2) для регулирования суспензии спор на уровне от 1·10/см
до 3·10
/см
для анализа.
Примечание - Чтобы получить 1/20 SDB в анионном поверхностно-активном веществе добавляют 5 см SDB (8.3.1) в 95 см
анионного поверхностно-активного вещества (8.2).
10.7.2 Для метода переноса готовят посевной материал только в анионном поверхностно-активном веществе (8.2) (SDB 1/20 не требуется).
10.7.3 После разбавления хорошо перемешивают суспензию.
10.7.4 Охлаждают суспензию на льду и используют в течение 4 ч.
10.8 Подсчет культур
Разведение 10 до 10
анионным поверхностно-активным веществом рассчитывают по 11.2.4.
11 Проведение анализа
11.1 Подготовка образцов для анализа и посев
11.1.1 Общие положения
Для метода посева используют метод поглощения или метод переноса. Образцы для каждого метода готовят, как описано ниже. Метод переноса применяют к пробам текстильных изделий, не поглощающим воду.
11.1.2 Метод поглощения
11.1.2.1 Промывание пробы
При необходимости, например, чтобы оценить продолжительность обработки, образцы промывают по [1] или иным подходящим способом, и после окончательной промывки образцы споласкивают водой для того, чтобы смыть моющее средство. Применение неустановленного способа должно быть указано в протоколе испытания.
11.1.2.2 Масса и форма образцов
Получают образцы массой (0,40±0,05) г, вырезанные по размеру, удобному для испытания. Предпочтительная масса одного образца 0,4 г. Получают шесть контрольных образцов из контрольной ткани и шесть образцов для испытания из ткани для испытания, прошедшей противогрибковую обработку.
Примечание - Три контрольных и три испытуемых образца после противогрибковой обработки используют для нулевого момента времени (момента отсчета), сразу после посева. Остальные образцы используют для времени контактирования, после инкубации.
11.1.2.3 Установка образцов
11.1.2.3.1 Расположение образцов
Каждый из образцов помещают в отдельные флаконы (7.7), выбрав один из следующих способов в соответствии с характером образца:
- если образец представляет собой изделие из текстиля, который может легко скручиваться, или содержит ватин или пух, на образец во флаконе (7.7) помещают стеклянную палочку. В качестве альтернативы связывают оба конца образца ниткой;
- если образец представляет собой пряжу, ее завязывают узлом и на полученный таким образом испытуемый образец во флаконе (7.7) помещают стеклянную палочку;
- если образцы взяты от ковров или аналогичных изделий, отрезают пучок и на полученный таким образом испытуемый образец во флаконе (7.7) помещают стеклянную палочку.
11.1.2.3.2 Стерилизация
При необходимости, например, для загрязненных образцов, стерилизуют их в автоклаве (7.3) в соответствии со следующей процедурой.
Закрывают верхнюю часть флаконов (7.7) с образцами алюминиевой фольгой.
Помещают закрытые флаконы (7.7) в металлическую корзинку для автоклавирования.
Оборачивают крышки флаконов алюминиевой фольгой и помещают их в металлическую корзинку.
Стерилизуют крышки и флаконы (7.7) с образцами в автоклаве (7.3) при температуре 121°С (103 кПа) в течение 20 мин.
После стерилизации снимают алюминиевую фольгу и дают образцам в флаконах (7.7) просохнуть в течение не менее 60 мин, поместив их в стерильный бокс или любое другое место, где нет риска загрязнения из воздуха.
Примечание 1 - Если использовать автоклав невозможно, используют альтернативное средство стерилизации, например, газообразный этиленоксид или гамма-лучи, вносят их в протокол испытания.
Примечание 2 - Определенный способ стерилизации может дезактивировать или увеличить выделение определенных противомикробных веществ и, следовательно, привести к неправильным результатам.
Примечание 3 - Контрольную ткань можно стерилизовать способом, описанным выше.
11.1.2.3.3 Закрывают флакон пробкой
Плотно закупоривают флаконы после обработки для того, чтобы сохранить условия стерильности до посева.
11.1.2.4 Посев на испытуемые образцы
11.1.2.4.1 Открывают пробку флакона
11.1.2.4.2 Точно отбирают пипеткой 0,2 см посевного материала, приготовленного по 10.7 (от 1·10
/см
до 3·10
/см
), и наносят в нескольких точках на каждом испытуемом образце, подготовленном по 11.1.2.3.
Если посевной материал плохо поглощается образцом, можно прижать его, например, стеклянной палочкой.
11.1.2.4.3 Необходимо убедиться в том, что суспензия хорошо перемешана перед нанесением и хорошо впиталась в образец, после чего закрывают флакон, следя за тем, чтобы посевной материал не попал на пробку.
11.1.3 Метод переноса
11.1.3.1 Подготовка образцов
По шаблону (7.20) вырезают шесть образцов диаметром (3,8±0,1) см.
Образцы не должны включать швы, кромки, вышивки, застежки и т.д.
При необходимости образцы промывают по [1] или иным подходящим способом, и после окончательного промывания образцы споласкивают водой для того, чтобы смыть моющее средство. Если используют неустановленный способ, его указывают в протоколе испытания.
При необходимости образцы можно стерилизовать в автоклаве (7.3), газообразном этиленоксиде, гамма-лучах или любым другим подходящим способом. Если используют неустановленный способ, его указывают в протоколе испытания.
11.1.3.2 Посев на агаровые чашки
Готовят 12 чашек Петри (7.2) диаметром 60 мм или шесть чашек Петри диаметром 90 мм с агаром SDA (8.3.3) для переноса.
Засевают 1 см исходной суспензии спор из 10.7 в диапазоне концентраций от 1·10
/см
до 3·10
/см
на агар, наклоняя чашку в нескольких направлениях для того, чтобы полностью омыть поверхность агара. Дают избытку жидкости максимально впитаться. Оставляют на (300±30) с.
11.1.3.3 Перенос культуры на образцы
11.1.3.3.1 Готовят шесть образцов контрольной ткани и шесть испытуемых образцов, прошедших противогрибковую обработку.
11.1.3.3.2 Выбирают два контрольных образца: один для момента отсчета и другой - для времени 48 ч. Устанавливают каждый образец на агаровую поверхность (11.1.3.2) в чашку Петри диаметром 60 мм (7.2) или два образца в чашку Петри диаметром 90 мм (7.2) (таким образом, чтобы исключить наложение образцов друг на друга) и придавливают гирей массой 200 г из нержавеющей стали (7.21) в течение (60±5) с. Убирают гирю и каждый образец.
Помещают один образец в чашку Петри диаметром 60 мм (7.2), размещая поверхность, на которую перенесены грибки, вверх в инкубаторе.
Помещают другой образец в стерильный мешок или флакон для испытания по 11.2.
11.1.3.3.3 Повторяют 11.1.3.3.2 еще для четырех контрольных образцов. Затем готовят три контрольных образца для нулевого момента и три контрольных образца для времени инкубации 48 ч.
11.1.3.3.4 Повторяют 11.1.3.3.2 для шести испытуемых образцов для того, чтобы получить три образца для нулевого момента и три образца для времени инкубации 48 ч.
11.2 Процедура подсчета колоний
11.2.1 Встряхивание до момента начала посева
В случае метода поглощения сразу же после инкубирования образцов добавляют 20 см среды SCDLP (8.3.5) в каждый из шести флаконов (7.7), в которых расположены один контрольный и один испытуемый образец, закупоривают пробками и встряхивают, как описано в а) или b).
В случае метода переноса сразу же после переноса помещают каждый образец в стерильный мешок или флакон, содержащий 20 см среды SCDLP и встряхивают в соответствии с нижеследующими а), b) или с).
a) Встряхивание на вихревом смесителе
Перемешивание с помощью вихревого смесителя в течение 1 мин5 циклов.
b) Встряхивание вручную
Берут флакон в руки и встряхивают по дуге приблизительно 30 см в течение 1 мин5 циклов.
c) Встряхивание на лопастной мешалке (7.23).
Помещают помеченный мешок однократного применения (7.28) в лопастную мешалку типа гомогенизатора Stomacher (7.23) и включают на 1 мин с каждой стороны мешка.
11.2.2 Инкубирование 48 ч
В случае метода поглощения инкубируют флаконы (7.7) (три контрольных и три испытуемых образца) при температуре (30±2)°С в течение (48±2) ч.
В случае метода переноса инкубируют чашки Петри (7.2) с образцами в камере повышенной влажности (7.24) при температуре (30±2)°С и относительной влажности выше 95% в течение (48±2) ч.
11.2.3 Встряхивание после 48 ч инкубации
В случае метода поглощения после инкубации добавляют 20 см среды SCDLP в каждый из флаконов, плотно закрывают пробку и встряхивают в соответствии с 11.2.1.
В случае метода переноса после инкубации помещают каждый образец в стерильный мешок или флакон, содержащий 20 см среды SCDLP (8.3.5) и встряхивают по 11.2.1.
11.2.4 Подсчет колоний на чашках
11.2.4.1 Приготовление серии разведений
11.2.4.1.1 Готовят суспензию 11.2.1 или 11.2.3, которая будет нулевым разведением, 10.
11.2.4.1.2 Берут 1 см суспензии 11.2.1 или 11.2.3 пипеткой (7.9), добавляют в пробирку, содержащую (9,0±0,1) см
анионного поверхностно-активного вещества (8.2) и энергично встряхивают. Это будет разведение 10
.
11.2.4.1.3 Повторяют эту процедуру последовательно и готовят серию разведений 10 и 10
для нулевого момента инкубации и 10
до 10
для 48 ч инкубации.
11.2.4.2 Инкубирование серии разведений суспензии
Подсчет выполняют на поверхности среды SDA (8.3.3), разлитой по чашкам Петри (7.2) диаметром 90 мм.
11.2.4.2.1 Подсчет выполняют на поверхности среды SDA в чашке Петри. Распространяют 0,1 см суспензий и 0,1 см
их серий разведений на поверхности среды SDA (одна чашка на один подсчет), используя пластиковый или стерилизованный нагревом инструмент.
11.2.4.2.2 Подсчет выполняют в глубине среды SDA в чашке Петри. Переносят 1 см каждого разведения в чашки Петри (7.2). Подогревают приблизительно 15 см
среды SDA до температуры 45-46°С на водяной бане (7.30), добавляют в чашки и тщательно перемешивают. Держат при комнатной температуре и дают среде застыть.
11.2.4.2.3 Переворачивают чашки вверх дном и инкубируют при температуре (28±2)°С в течение от 24 до 48 ч, наблюдают за ростом колоний грибков.
11.2.4.3 Подсчет колоний
11.2.4.3.1 После инкубирования подсчитывают число колоний на чашках Петри (7.2) серии разведений, в которых выросло от 1 КОЕ до 300 КОЕ.
11.2.4.3.2 Получают концентрацию грибков в растворе согласно ИСО 7218:2007 по формуле
![]() , (1)
, (1)
где - концентрация грибков, КОЕ/см
;
- сумма КОЕ, посчитанных на двух чашках, оставшихся от двух последовательных разведений, как минимум одна из которых содержит менее 5 КОЕ;
- первое разведение после двух последовательных разведений;
1,1 - коэффициент для объединения двух последовательных разведений по ИСО 7218:2007;
- объем посевного материала, помещенного на каждой чашке, мм (0,1 см
).
В том случае, когда ни в одной из чашек Петри не содержится минимум 5 КОЕ, испытание считается неэффективным.
Пример - При разведении 10 - 168 КОЕ
При разведении 10 - 14 КОЕ
![]() КОЕ/см
КОЕ/см=1,65·10
КОЕ/см
12 Результаты испытания
12.1 Заключение об эффективности испытания
Если нижеприведенные в а), b) и с) условия удовлетворительны, испытание считается эффективным. Если испытание считается неэффективным, выполняют повторное испытание.
a) Испытуемый посевной материал должен быть от 1·10/см
до 3·10
/см
.
b) Разность между десятичными логарифмами максимального количества грибков на трех контрольных тканях сразу после посева должна быть менее единицы. Эта разность сразу после инкубации также должна быть менее единицы.
c) Показатель роста, полученный по формуле (2), должен быть более 1,0.
![]() , (2)
, (2)
где - показатель роста на контрольной ткани;
- среднеарифметическое количество грибков, полученное от трех образцов контрольной ткани после инкубации в течение (48±2) ч;
- среднеарифметическое количество грибков, полученное от трех образцов контрольной ткани сразу после посева.
12.2 Расчет значения противогрибковой активности
Если условие 12.1 удовлетворяется, испытание считается эффективным. Если испытание считается неэффективным, выполняют повторное испытание.
После подтверждения достоверности результатов испытания используют формулу (3) для получения значения противогрибковой активности.
![]() , (3)
, (3)
где - значение противогрибковой активности;
- показатель роста на контрольной ткани,
![]() ;
;
- показатель роста на обработанных противогрибковым средством образцах,
![]() ;
;
- среднеарифметическое количество грибков, полученное от трех образцов, обработанных противогрибковым средством, после инкубации в течение (48±2) ч;
- среднеарифметическое количество грибков, полученное от трех образцов, обработанных противогрибковым средством сразу после посева.
13 Протокол испытания
В протоколе испытания должна содержаться следующая информация:
a) ссылка на настоящий стандарт;
b) описание испытуемой пробы;
c) тип использованной контрольной ткани;
d) тип использованных референтных штаммов грибков;
e) концентрация спор;
f) метод посева;
g) показатель роста из формулы (2);
h) показатель противогрибковой активности каждого образца;
i) все отклонения от настоящего стандарта.
Приложение А
(справочное)
Грибки, используемые в испытаниях по настоящему стандарту
А.1 Общие положения
Используемые в испытаниях грибки должны быть идентичны указанным в таблице А.1, которые были законсервированы членами Всемирной Федерации коллекций культур [World Federation for Culture Collection (WFCC)].
A.2 Перечень грибков
Данные грибки законсервированы членами Всемирной Федерации коллекций культур.
Таблица А.1 - Грибки для испытаний
Тип грибка | Код WDCM (код во Всемирной Федерации коллекций культур) | Номер в хранении | Организация-хранитель |
Aspergillus niger | 00144 | АТСС 6275 | Американская коллекция клеточных культур (США) |
Коллекция института им.Пастера (Франция) | |||
UMIP 2475,98 | Германская коллекция микроорганизмов и клеточных культур (Германия) | ||
NBRC 105649 | Национальный институт технологии и развития, Центр биологических ресурсов (Япония) | ||
Aspergillus niger (A.brasiliensis) | 00053 | АТСС 16404 | |
UMIP 1431,8 | |||
DSM 1387 | |||
NBRC 9455 | |||
| |||
Примечание - После соответствующего подтверждения можно использовать другие культуры и другие коллекции.
Приложение В
(справочное)
Эффективность противогрибковых мер
Могут быть применены следующие критерии, чтобы показать действенность противогрибковых средств.
Примечание - Рекомендуемый критерий не гарантирует отсутствия роста грибков. Это означает, что грибки на обработанном изделии растут медленнее или не растут совсем по сравнению с контрольным текстильным изделием.
Таблица В.1 - Пример эффективности противогрибкового средства
Пункт | Значение | Пояснение |
Критерий противогрибковой активности по показателю |
| Неэффективно |
2 | Незначительный эффект остановки роста | |
3 | Средний эффект остановки роста | |
| Полный эффект остановки роста | |
| Противогрибковый эффект |
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным и действующим в этом качестве межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального, межгосударственного стандарта |
ISO 105-F02 | IDT | ГОСТ Р ИСО 105-F02-2014/ISO 105-F02:2009 "Материалы текстильные. Определение устойчивости окраски. Часть F02. Технические условия на хлопчатобумажные и вискозные смежные ткани" |
ISO 7218:2007 | IDT | ГОСТ ISO 7218-2015 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
[1] | ГОСТ Р ИСО 6330:2014/ИСО 6330:2012 Материалы текстильные. Процедуры домашней стирки и сушки, применяемые для испытаний |
УДК 677.017.86:006.354 | ОКС 59.080.01 |
Ключевые слова: материалы текстильные, противогрибковая активность, подсчет колоний, метод, обработка, суспензия, споры, образцы, испытание, анализ, расчет, протокол | |
Электронный текст документа
и сверен по:
, 2017