ГОСТ Р ИСО 11615-2014
Группа П85
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Информатизация здоровья
ИДЕНТИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах
Health informatics. Identification of medicinal products. Data elements and structures for the unique identification and exchange of regulated medicinal product information
ОКС 35.240.80
ОКСТУ 4002
Дата введения 2015-10-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Центральный научно-исследовательский институт организации и информатизации здравоохранения" Министерства здравоохранения Российской Федерации (ФБГУ "ЦНИИОИЗ" Минздрава) и обществом с ограниченной ответственностью "Корпоративные электронные системы" на основе собственного аутентичного перевода на русский язык международного документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 "Информатизация здоровья" при ЦНИИОИЗ Минздрава - постоянным представителем ИСО ТК 215
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2014 г. N 1621-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11615:2014* Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах (ISO 11615:2012 "Health informatics - Identification of medicinal products - Data elements and structures for unique identification and exchange of regulated medicinal product information").
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт . - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2004 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов и документов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в справочном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Введение
Настоящий стандарт разработан в связи с широкой мировой потребностью в международной гармонизации описаний лекарственных средств. Он является одним из пяти стандартов, образующих базис уникальной идентификации лекарственных средств. В эту группу стандартов входят*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах);
ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
Эти стандарты идентификации лекарственных средств (IDMP - Identification of Medicinal Products) предназначены для поддержки деятельности органов контроля обращения лекарственных средств во всем мире, включая контроль за исследованием лекарственных средств, регистрацией лекарственных средств, управление их жизненным циклом, а также контроль рисков и фармаконадзор.
Для достижения основных целей контроля обращения лекарственных средств и фармаконадзора необходимо обеспечивать надежный, качественный и согласованный обмен информацией о лекарственных средствах. Поэтому стандарты IDMP регламентируют как минимум следующий обмен данными:
- между органами контроля;
- от фармацевтической фирмы органу контроля;
- от спонсора клинического исследования органу контроля;
- от органа контроля другим участникам обращения лекарственных средств;
- от органа контроля международным источникам данных.
Соответствующие спецификации сообщений, обеспечивающих указанный выше обмен данными, являются составной частью стандартов IDMP/
Уникальные идентификаторы, присвоенные в соответствии со стандартами IDMP, предназначены для использования в тех приложениях, которым необходима надежная идентификация и отслеживание применения лекарственных средств.
Для различных целей и разных условий в стандартах информатизации здоровья, фармации и контроля лекарственных средств используется большое число разных понятий. В настоящем стандарте приведены те термины и определения понятий, которые предназначены для уникальной идентификации регистрируемых лекарственных средств, описания их свойств и передачи соответствующей информации.
Термины и определения, принятые в настоящем стандарте, предназначены для облегчения интерпретации и применения юридических и нормативных требований, но они не должны превалировать над юридически обязывающими документами. В случае сомнения или потенциального конфликта должны применяться термины и определения, принятые в юридически обязывающих документах.
Настоящий стандарт разработан совместно с Общей моделью продукции (Common Product Model) организации HL7. Предполагается, что для специфицированного в нем обмена информацией между участниками обращения лекарственных средств будут использоваться сообщения стандарта HL7 V3.
В контексте обмена регистрационными данными настоящий стандарт имеет двоякое назначение:
- определить элементы и структуры данных, а также отношения между элементами данных, необходимых для уникальной и уверенной идентификации лекарственных средств, предназначенных для лечения человека;
- задать определения терминов, используемых для описания всех элементов данных, необходимых для уникальной и уверенной идентификации лекарственных средств для применения человеком.
Кроме того, для обеспечения успешного обмена сопутствующей информацией в настоящий стандарт включены ссылки, необходимые для использования других стандартов группы IDMP и стандартов обмена данными.
1 Область применения
В настоящем стандарте описаны определения и понятия, а также элементы данных и их структурные отношения, необходимые для уникальной идентификации и детального описания лекарственных средств.
Стандарты, перечисленные во введении, в своей совокупности представляют собой информационную модель, предназначенную для описания характеристик и уникальной идентификации регистрируемых лекарственных средств для применения человеком в течение всего их жизненного цикла, то есть по мере необходимости от разработки до регистрации, проведения пострегистрационных исследований, обновления или снятия с рынка.
Кроме того, для обеспечения возможности успешного обмена информацией, связанной с уникальной идентификацией и характеристиками лекарственных средств, в настоящем стандарте описан контекст применения других стандартов обмена данными группы IDMP.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные документы. Для датированных ссылок применяют только указанное издание ссылочного документа, для недатированных ссылок применяют последнее издание ссылочного документа (включая все его изменения).
ИСО 639-2 Коды для представления названий языков. Часть 2. Трехбуквенный код (ISO 639-2, Codes for the representation of names of languages - Part 2: Alpha-3 code)
ИСО 3166-1 Коды для представления названий стран и единиц их административно-территориального деления. Часть 1. Коды стран (ISO 3166-1, Codes for the representation of names of countries and their subdivisions - Part 1: Country codes)
ИСО 8601 Элементы данных и форматы для обмена информацией. Обмен информацией. Представление дат и времени (ISO 8601, Data elements and interchange formats - Information interchange - Representation of dates and times)
ИСО 11616 (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах (ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information)
ИСО 11238 Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях (ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances)
ИСО 11239 Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке (ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging)
ИСО 11240 Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения (ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement)
ИСО 21090 Информатизация здоровья. Гармонизированные типы данных для обмена информацией (ISO 21090, Health informatics - Harmonized data types for information interchange)
ИСО/МЭК 5218 Информационные технологии. Коды для представления пола человека (ISO/IEC 5218, Information technology - Codes for the representation of human sexes)
3 Термины, определения и сокращения
3.1 Термины и определения
Для целей настоящего стандарта используются следующие термины и определения.
3.1.1 применяемая дозированная форма (administrable dose form): Применяемая дозированная лекарственная форма, полученная в результате всех необходимых преобразований произведенной дозированной формы.
Примеры - Раствор для инъекций, таблетка для приема внутрь, твердая капсула с порошком для ингаляции.
Примечание - Применяемая дозированная форма идентична произведенной дозированной форме в случаях, когда произведенный продукт не преобразуется (то есть когда он является лекарственным препаратом).
3.1.2 устройство для применения лекарственного средства (administration device): Устройство, предназначенное для правильного применения лекарственного средства.
Примеры - Аппликатор, оральный шприц.
Примечание - Устройство для применения может быть принадлежностью первичной упаковки или ее крышки.
[ENV 12610:1997]
3.1.3 аллергены (allergens, materials of concern): Ингредиенты устройства, способные вызвать гиперчувствительность первого типа или аллергическую реакцию у лиц с предрасположенностью к атопии.
Пример - Латекс.
3.1.4 дата разрешения (authorization date): Дата выдачи разрешения на фармацевтическую деятельность уполномоченным органом.
Пример - Дата регистрации лекарственного средства, разрешающей его гражданский оборот.
3.1.5 процедура регистрации лекарственного препарата (authorization procedure, marketing authorization procedure): Формальная процедура, выполняемая уполномоченным органом при регистрации лекарственного средства, внесении изменений в регистрационное досье, подтверждении или отмене регистрации.
Пример - Отмена регистрации в связи с выявлением риска применения лекарственного препарата, превышающего его эффективность.
Примечание - Английские термины authorization procedure и marketing authorization procedure являются синонимами.
3.1.6 состояние регистрации (authorization status): Текущее состояние регистрации лекарственного средства.
Примеры - Действует, приостановлена, истек срок действия, отменена.
3.1.7 серия (batch): Количество лекарственного средства, произведенное в результате одного технологического цикла его производителем.
3.1.8 номер серии (batch number): Идентификатор, присвоенный в определенный момент времени конкретной серии лекарственного средства, произведенного в результате одного технологического цикла.
3.1.9 характеристика (characteristic): Абстракция свойства объекта.
3.1.10 клиническое испытание (clinical trial), клиническое исследование (clinical study): Изучение лечебных, фармакологических и/или фармакодинамических свойств исследуемого лекарственного препарата в процессе его применения у человека, идентификация нежелательных реакций организма человека на применение лекарственного препарата, изучение процессов всасывания, распределения, изменения и выведения исследуемого лекарственного препарата в целях получения доказательств его безопасности и эффективности.
Примечание - Термины "клиническое испытание" и "клиническое исследование" являются синонимами.
3.1.11 разрешение на проведение клинического исследования (clinical trial authorization): Разрешение на проведение клинического исследования, выдаваемое уполномоченным органом в рамках его юрисдикции.
3.1.12 комбинированная лекарственная дозированная форма (combined pharmaceutical dose form): Единый термин, описывающий два или более произведенных продукта, которые специальным образом комбинируются для получения одного лекарственного препарата. В это описание включается информация о дозированной форме каждого произведенного продукта и о применяемой дозированной форме лекарственного препарата.
Пример - Порошок и его растворитель при изготовлении раствора для инъекций. Лекарственное средство представляет собой два произведенных продукта: растворяемый порошок и его растворитель. Лекарственный препарат, изготовленный из этих двух компонентов, представляет собой инъекционный раствор; комбинированной лекарственной дозированной формой является "порошок и растворитель для инъекционного раствора".
3.1.13 непатентованное наименование лекарственного средства (common name, generic name): Международное непатентованное наименование, рекомендованное Всемирной организацией здравоохранения; если таковое отсутствует, то непатентованное наименование, рекомендованное уполномоченным органом в своей юрисдикции.
[Резолюция 46 Всемирной ассамблеи здравоохранения "WHA46.19 Непатентованные названия для фармацевтических веществ"]
3.1.14 понятие (concept): Единица знания, представленная в словесной форме как совокупность признаков.
3.1.15 упаковка (container): Изделие, являющееся частью лекарственного средства и предназначенное для содержания, идентификации или транспортировки компонентов лекарственного средства.
3.1.16 нормативный словарь (controlled vocabulary): Конечное множество допустимых значений элемента данных.
Примечание - Допустимыми значениями могут быть коды, текст или числа.
[CDISC Clinical Research Glossary V8.0, 2009]
3.1.17 тип данных (datatype): Множество различных значений, характеризуемое их свойствами, и набор операций над этими значениями.
[ISO 11404:2007, определение 3.12]
3.1.18 организация оптовой торговли (distributor): Организация, обладающая лицензией на приобретение, хранение, поставку или экспорт лекарственных средств, исключая розничную торговлю.
Примечание - Это определение относится также к поставке лекарственных средств другим организациям оптовой торговли.
3.1.19 доза (dose): Определенное количество лекарственного средства, принимаемое однократно или через заданные интервалы времени.
3.1.20 дозированная форма (dose form, dosage form), дозированная лекарственная форма (pharmaceutical dose form): Материальное проявление лекарственного средства, содержащего фармацевтические субстанции и/или вспомогательные вещества, которое должно быть применено к пациенту.
Примечания
1 Дозированная форма и дозированная лекарственная форма являются синонимами.
2 Термин "дозированная лекарственная форма" может применяться как к применяемой дозированной лекарственной форме, так и к произведенной дозированной лекарственной форме.
3.1.21 глобальный номер предмета торговли (Global Trade Item Number): номер GTIN, присваиваемый международной ассоциацией GS1 и обеспечивающий уникальную идентификацию предметов, подлежащих продаже (например, лекарственных препаратов, медицинских изделий), для применения в цепях поставок.
________________
В ИСО 11615-2012 приведено ошибочное наименование "Global Trade Identification Number".
Примечание - Номер GTIN используется для идентификации любого товара, о котором надо получить заранее подготовленную информацию, и который может иметь определенную цену, быть заказанным или включенным в счет в конкретном звене цепи поставок. Номера GTIN могут состоять из 8, 12, 13 или 14 цифр.
3.1.22 идентификатор (identifier, ID): Описание, достаточное для выделения объекта в конкретных условиях.
Примечания
1 В контексте настоящего стандарта идентификатор представляет собой список идентифицирующих характеристик, которые в совокупности однозначно идентифицируют лекарственное средство, лекарственный препарат, фармацевтическую субстанцию, контролируемую субстанцию, путь введения, дозированную лекарственную форму или любой другой элемент, который необходимо однозначно идентифицировать.
2 Адаптированное определение из стандарта ENV 12610:1997.
3.1.23 первичная упаковка (immediate container, immediate packaging): Упаковка лекарственного средства или препарата, имеющая с ним непосредственный контакт.
Примеры - Ампула, флакон, предварительно заполненный шприц, банка, блистер.
Примечания
1 Первичная упаковка может быть вложена в устройство применения лекарственного средства или в тару либо интегрирована с ними.
2 Роль первичной упаковки может выполняться дозированной лекарственной формой. Примером может служить капсула с порошком для ингаляции. В этом случае капсула не является упаковкой.
3 Альтернативное совместимое определение первичной упаковки ("immediate packaging") приведено в Директиве 92/27/EEC.
4 Адаптированное определение из стандарта ENV 12610:1997.
3.1.24 ингредиент (ingredient): Материал, использованный при изготовлении лекарственного средства или препарата.
Примечание - Ингредиент является составной частью лекарственного средства, сам по себе или в сочетании с другими ингредиентами. Ингредиент является также компонентом лекарственного препарата. Ингредиент эквивалентен детально описанной субстанции; субстанция выполняет роль ингредиента в произведенном продукте.
3.1.25 международное непатентованное наименование, МНН (international non-proprietary name, INN): Официальное непатентованное наименование фармацевтической субстанции, присвоенное Всемирной организацией здравоохранения.
3.1.26 промежуточная упаковка (intermediate packaging): Упаковка между внешней упаковкой и первичной упаковкой.
3.1.27 торговое наименование лекарственного средства (invented name): Торговое наименование лекарственного средства, присвоенное его разработчиком и зарегистрированное органом регистрации в пределах его юрисдикции.
Примечание - Термины "invented name" и "trade name" являются синонимами.
3.1.28 исследуемое лекарственное средство (Investigational Medicinal Product): Лекарственная форма активной субстанции или плацебо, используемые в клиническом исследовании. К исследуемым лекарственным средствам относятся также новые комбинации зарегистрированных ранее лекарственных препаратов; лекарственные препараты, произведенные в других лекарственных формах, в новой дозировке; лекарственные препараты, используемые для показаний, не включенных в регистрационное удостоверение; лекарственные препараты, исследуемые в целях получения дополнительной информации.
3.1.29 идентификатор (исследуемой) серии лекарственного средства (I)BAID_1 ((Investigational) Medicinal Product Batch Identifier): Уникальный идентификатор конкретной серии (исследуемого) лекарственного средства, нанесенный на его внешнюю упаковку.
Примечания
1 Данный идентификатор конструируется как сочетание номера серии, присвоенного производителем, и срока годности.
2 Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать (исследуемое) лекарственное средство на уровне упаковки.
3.1.30 идентификатор (исследуемой) серии лекарственного средства (l)BAID_2 ((Investigational) Medicinal Product Batch Identifier): Уникальный идентификатор конкретной серии (исследуемого) лекарственного средства, нанесенный на его первичную упаковку, не являющейся внешней упаковкой.
Примечания
1 Данный идентификатор конструируется как сочетание номера серии, присвоенного производителем, и срока годности.
2 Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать (исследуемое) лекарственное средство, на уровне первичной упаковки.
3.1.31 идентификатор исследуемого лекарственного средства IMPID (Investigational Medicinal Product Identifier): Уникальный идентификатор, присвоенный исследуемому лекарственному средству в дополнение к государственному регистрационному номеру, присвоенному уполномоченным органом, или номеру, присвоенному спонсором клинического исследования.
Примечание - Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственные средства во всем мире.
3.1.32 идентификатор упаковки исследуемого лекарственного средства IPCID (Investigational Medicinal Product Package Identifier): Уникальный идентификатор, присвоенный упаковке исследуемого лекарственного средства в дополнение к государственному регистрационному номеру, присвоенному уполномоченным органом, или номеру, присвоенному спонсором клинического исследования.
Примечание - Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственные средства во всем мире.
3.1.33 юрисдикция (jurisdiction): Географическая территория или правовая сфера, на которую распространяются полномочия органа регистрации лекарственных средств.
3.1.34 юридический статус отпуска (legal status of supply): Установленные законодательством правило отпуска лекарственного средства, например, должно ли оно отпускаться по рецепту.
3.1.35 произведенная дозированная форма (manufactured dose form): Произведенная дозированная форма фармацевтической субстанции, еще не преобразованная в лекарственный препарат.
Пример - Порошок для инъекционного раствора.
Примечание - Произведенная дозированная форма идентична применяемой дозированной форме в случаях, когда произведенное лекарственное средство не преобразуется (то есть когда оно производится в готовой для использования форме).
3.1.36 произведенный продукт (manufactured item): Качественная и количественная композиция компонентов, содержащаяся в упаковке лекарственного средства.
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов.
2 Во многих случаях произведенный продукт тождественен лекарственному препарату. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного средства) и тогда он не тождественен лекарственному препарату.
3 Произведенный продукт не имеет прямого контакта с внешней упаковкой за исключением случаев, когда внешняя упаковка является также и первичной упаковкой.
3.1.37 лицензированное производство лекарственного средства (manufacturing authorization): Производство лекарственного средства субъектом, обладающим лицензией на эту деятельность.
Примечание - Лицензирование производства может требоваться как для полного, так и для частичного цикла производства и для различных процессов расфасовки, упаковки или презентации. Однако такая лицензия может не требоваться для изготовления, расфасовки, переупаковки или презентации, если эти процессы осуществляются исключительно для целей розничного отпуска аптечными организациями или частными предпринимателями, имеющими лицензию на фармацевтическую деятельность.
3.1.38 дата лицензирования производства (manufacturing authorization date): Дата выдачи лицензии на производство лекарственных средств.
3.1.39 обладатель лицензии на производство (manufacturing authorization holder): Организация, обладающая лицензией на производство лекарственных средств.
3.1.40 регистрация лекарственного препарата (marketing authorization): Лекарственные препараты вводятся в гражданский оборот, если они зарегистрированы соответствующим уполномоченным органом.
3.1.41 обладатель регистрационного удостоверения (Marketing Authorization Holder): Организация, получившая регистрационное удостоверение лекарственного препарата.
3.1.42 номер регистрации (marketing authorization number): Идентификатор, присвоенный лекарственному препарату уполномоченным органом исполнительной власти.
3.1.43 процедура регистрации (marketing authorization procedure, authorization procedure): Формальная процедура, выполняемая уполномоченным органом при регистрации лекарственного средства, внесении изменений в регистрационное досье, подтверждении или отмене регистрации.
Примечание - Английские термины marketing authorization procedure и authorization procedure являются синонимами.
3.1.44 дата регистрации (marketing start date): Дата регистрации лекарственного препарата уполномоченным органом.
Примечание - Дата фактического ввода лекарственного препарата в оборот всегда позже даты регистрации.
3.1.45 дата отмены регистрации (marketing stop date): Дата отмены регистрации лекарственного препарата уполномоченным органом.
3.1.46 материал (material): Субстанция или контролируемая субстанция, из которой состоит определенный компонент.
Примечание - Это понятие применяется к упаковке лекарственного средства (контейнеру), упаковке (компоненту) и к устройству.
3.1.47 точка измерения (measurement point): Физическое место или устройство применения, в котором измеряется количество применяемого лекарства.
3.1.48 медицинское изделие (medical device): Любой инструмент, аппарат, приспособление, программное обеспечение или иной предмет, используемый сам по себе или в сочетании с другим (включая программное обеспечение, предназначенное его производителем для использования в диагностических и/или терапевтических целях и необходимое для правильного применения прибора), который предназначен его производителем для медицинского применения в следующих целях:
- диагностика, профилактика, мониторинг, лечение или облегчение заболевания;
- диагностика, мониторинг, лечение, облегчение либо компенсация травмы или инвалидности;
- исследование, замещение или модификация анатомического или физиологического процесса;
- контроля беременности, который достигает своего ожидаемого действия в теле или на теле человека не с помощью фармакологических, иммунологических или метаболических средств, но которому эти средства могут способствовать.
[Директива ЕС 2007/47 о медицинских изделиях (ЕС Directive on Medical Devices 2007/47)]
3.1.49 лекарственное средство (Medicinal Product): Вещество или комбинация веществ, вступающее в контакт с организмом человека или животного, применяемое для лечения или профилактики заболевания с целью диагностики или реабилитации, коррекции или изменения физиологических функций.
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов и один или несколько лекарственных препаратов.
2 В некоторых юрисдикциях лекарственное средство может быть определено как любое вещество или комбинация веществ, используемых для постановки диагноза.
3 Требования настоящего стандарта применимы к патентованным лекарственным средствам, применяемым к организму человека и предназначенным для ввода в гражданский оборот, а также к промышленно производимым лекарственным средствам, для применения которых необходима регистрация уполномоченным органом. Однако эти требования не применяются к лекарственным средствам, изготовленным по рецепту, то есть изготовленным в аптеке по рецепту, предназначенным для конкретного пациента; к лекарственным средствам, изготовленным по официальной формуле, то есть изготовленным в аптеке в соответствиями с инструкциями фармакопеи и предназначенным для непосредственного отпуска пациентам, а также к медицинским средствам, предназначенным для разработки и клинических исследований (см. определение 3.1.28 "Исследуемое лекарственное средство"); к промежуточным продуктам, предназначенным для дальнейшей переработки лицензированным производителем.
[ENV 13607 и ENV 12610]
3.1.50 идентификатор лекарственного средства MPID (Medicinal Product Identifier): Уникальный идентификатор, присвоенный лекарственному средству в дополнение к любому существующему регистрационному номеру, присвоенному уполномоченным органом.
Примечание - Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственные средства во всем мире.
3.1.51 наименование лекарственного средства (Medicinal Product name): Наименование, зарегистрированное уполномоченным органом.
Примечание - Этим наименованием может быть торговое наименование, которое не должно быть перепутано с международным непатентованным наименованием, либо международное непатентованное или научное наименование, за которым следует товарный знак или иной применимый дескриптор.
3.1.52 идентификатор упаковки лекарственного средства PCID (Medicinal Product Package Identifier): Уникальный идентификатор, помещенный на упаковку лекарственного средства в дополнение к государственному регистрационному номеру, присвоенному уполномоченным органом.
Примечание - Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственные средства во всем мире.
3.1.53 уполномоченный орган (Medicines Regulatory Agency): Орган исполнительной власти, который в соответствии с действующим законодательством несет ответственность за государственную регистрацию лекарственных средств.
Примечание - В некоторых юрисдикциях в дополнение к органу регистрации лекарственных средств может назначаться дополнительный орган по контролю обращения зарегистрированных лекарственных средств (фармаконадзору). Например, в Европейском Союзе функция регистрации лекарственных средств возложена на Европейскую Комиссию, а функция фармаконадзора - на агентство ЕМЕА (European Medicines Agency - Европейское агентство по лекарственным средствам).
3.1.54 номер модели изделия (device listing number, device model number): Тип информации, идентифицирующей конкретное изделие.
3.1.55 внешняя упаковка (outer packaging): Внешний контейнер, в котором поставляется лекарственное средство.
Примеры - ящик, коробка.
Примечания
1 Лекарственный препарат или произведенный продукт не имеет непосредственного контакта с внешней упаковкой за исключением случаев, когда внешняя упаковка служит также первичной упаковкой.
2 Альтернативное совместимое определение внешней упаковки ("outer packaging") приведено в Директиве 92/27/ЕЕС.
3.1.56 единица упаковки, контейнер (package item, container): Отдельный различаемый контейнер, содержащийся в упакованном лекарственном средстве и предназначенный для поставки или продажи произведенного продукта.
3.1.57 упакованное лекарственное средство (Packaged Medicinal Product): Лекарственное средство в контейнере, являющемся частью упаковки и предназначенном для предоставления или продажи лекарственного средства.
3.1.58 лекарственный препарат (pharmaceutical product): Качественная и количественная композиция лекарственного средства в дозированной форме, предназначенная для применения и содержащая информацию о ее регистрации.
Примечания
1 Лекарственное средство может содержать один или несколько препаратов.
2 Во многих случаях лекарственный препарат идентичен произведенному продукту. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного препарата) и тогда он не тождественен лекарственному препарату.
3.1.59 фармаконадзор (pharmacovigilance): Мероприятия, связанные с научными исследованиями и мониторингом безопасности лекарственных средств и направленные на снижение возможных негативных последствий медицинского применения лекарственных средств.
Примечание - Фармаконадзор является важной функцией обеспечения общественного здоровья, включающей в себя:
- сбор и обработку сведений по безопасности лекарственных средств;
- анализ данных в целях выявления "сигналов" (любых новых или изменившихся аспектов безопасности);
- изучение данных и принятие решений по вопросам безопасности;
- деятельность по защите общественного здоровья (включая нормативную деятельность);
- информационное взаимодействие с участниками обращения лекарственных средств;
- аудит результата предпринятых мероприятий и основных процессов, составляющих эти мероприятия.
В число участников фармаконадзора входят:
- пациенты как получатели лекарственных средств;
- врачи, аптечные работники, медицинские сестры и другие медицинские работники, имеющие дело с лекарственным средствами, а также уполномоченные органы, контролирующие безопасность лекарственных средств;
- производители лекарственных средств, а также предприятия, импортирующие или поставляющие лекарственные средства.
3.1.60 идентификатор лекарственного препарата PhPID (Pharmaceutical Product Identifier): Уникальный идентификатор лекарственного препарата.
3.1.61 физические характеристики (physical characteristics): Описание высоты, веса, ширины, глубины, объема, цвета и формы предмета.
3.1.62 первичные идентификаторы (primary identifiers): Совокупность уникальных идентификаторов лекарственных средств, дополняющая регистрационный номер, присвоенный уполномоченным органом.
Примечание - Эти идентификаторы предназначены для целей учета и для повышения безопасности пациента, поскольку с их помощью можно однозначно идентифицировать лекарственные средства во всем мире.
3.1.63 номер процедуры (procedure number): Номер обеспечения прослеживаемости или идентификационный номер, присвоенный уполномоченным органом конкретному процессу регистрации лекарственного средства.
3.1.64 тип процедуры (procedure type): Тип процедуры, предусмотренной законодательством при регистрации лекарственного средства.
Примеры - Централизованная, децентрализованная, национальная, взаимное признание.
3.1.65 средство (product): Сокращенная форма упоминания в тексте лекарственного средства или исследуемого лекарственного средства.
3.1.66 классификация средства (product classification): Классификация или группировка лекарственных средств по определенным свойствам.
Примеры - Фармакологическая классификация, классификация по терапевтическому действию.
3.1.67 номер протокола (protocol number): Идентификатор или номер обеспечения прослеживаемости, присвоенный протоколу клинического исследования.
3.1.68 качественный состав (qualitative composition): Перечень всех ингредиентов исследуемого или зарегистрированного лекарственного средства, полученный после их восстановления и реагирования компонентов:
- описание фармацевтической субстанции и контролируемой субстанции;
- состав вспомогательных веществ, независимо от их природы или количества, включая красители, консерванты, адъюванты, стабилизаторы, сгустители, эмульгаторы, вкусовые и ароматизирующие субстанции и т.д.
3.1.69 количественный состав (quantitative composition): Количества фармацевтической субстанции и компонентов контролируемой субстанции в исследуемом или зарегистрированном лекарственном средстве, выраженные в относительных единицах.
Примечания
1 В описании количественного состава конечного исследуемого или зарегистрированного лекарственного средства (в зависимости от его формы) необходимо указать массу или количество единиц биологической активности в расчете на единицу дозы, массы или объема для каждой субстанции или контролируемой субстанции.
2 Субстанция или контролируемая субстанция, существующая в форме соединения или производного вещества, обязательно должна быть описана количественно с указанием общей массы и, если это необходимо или уместно, массы активного компонента или компонентов молекулы.
3 См. также активность (определение 3.1.76).
3.1.70 референтная активность (reference strength): Активность субстанции или субстанций, используемая в качестве эталона, по отношению к которому определяется активность исследуемого или зарегистрированного лекарственного средства.
Примеры
1 Если ингредиент имеет форму соли или гидрата, то количественный состав может быть выражен в терминах массы (или биологической активности в международных (или иных) единицах, если это принято) активного вещества (базового вещества, кислоты или ангидрида), к примеру, в описании "60 мг торемифена (в виде цитрата)", или "цитрат торемифена, эквивалентный 60 мг торемифена" активным ингредиентом является "цитрат торемифена", а референтым веществом - "торемифен".
2 Если активный ингредиент является эфиром или метаболическим предшественником, то количественный состав может быть выражен в терминах этого эфира или предшественника, например, 75 мг фосфенитоина, эквивалентные 50 мг фенитоина. Референтным веществом в этом случае является "фенитоин".
Примечание - Активность субстанции или контролируемой субстанции должна быть описана как количество субстанции, присутствующее в лекарственном препарате или в произведенном продукте.
3.1.71 регистрационный номер клинического исследования (registration number): Идентификатор клинического исследования, присвоенный уполномоченным органом регистрации, в целях обеспечения прослеживаемости.
3.1.72 документ регистрационного досье (regulated document): любой документ, включаемый уполномоченным органом в регистрационное досье лекарственного средства, либо документ, необходимый для получения разрешения на проведение клинического исследования и надзора за исследованием.
Примеры - Инструкция по применению лекарственного средства (SmPC - Summary of Product Characteristics), информационный листок пациента (PIL - Patient Information Leaflet).
3.1.73 путь введения (route of administration): Путь введения лекарственного препарата в тело или контакта с телом.
Примеры - Пероральный, внутривенный, в полость рта, в конъюнктивальный мешок глаза.
3.1.74 контролируемая субстанция (specified substance): Фармацевтическая субстанция, характеризуемая группой элементов, которые описывают комплексное вещество или указывают дополнительную информацию о лекарственных средствах.
Примечания
1 Примерами дополнительных элементов описания могут служить качество, единицы измерения, физическая форма, компоненты, производитель, критические этапы производственного процесса (к примеру, экстракция, процессы синтеза и рекомбинации).
2 Для описания контролируемой субстанции могут использоваться четыре различные группы элементов, между которыми существуют определенные отношения.
3.1.75 спонсор (sponsor): Физическое лицо, фирма, институт или организация, несущая ответственность за инициирования, организацию или финансирование клинического исследования.
3.1.76 активность (strength): Содержание субстанции или контролируемой субстанции, выраженное в форме количества в единице дозы, единице представления, единице объема или массы в соответствии с дозированной формой.
Примечание - См. также количественный состав (определение 3.1.69).
3.1.77 субстанция (substance): Любое вещество биологического, минерального или химического происхождения, способное к отдельному существованию и имеющее определенный состав.
Для описания контролируемой субстанции могут использоваться четыре различные группы элементов, между которым существуют определенные отношения.
Примечания
1 Субстанции могут быть простыми, смешанными или принадлежать к одной из групп контролируемых субстанций. Простые субстанции описываются с помощью минимально достаточного набора данных и делятся на пять типов: химические, белки, нуклеиновые кислоты, полимеры и структурно-разнородные субстанции. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы. По возможности должны использоваться терминология и определяющие характеристики из фармакопейных статей. Определяющие элементы зависят от типа субстанции.
2 Отдельное существование означает способность субстанции существовать отдельно от любой другой субстанции. Субстанции могут представлять собой хорошо определенные вещества, имеющие определенную химическую структуру, синтетические вещества (например, смеси изомеров), встречающиеся в природе смеси химических веществ, имеющих определенные молекулярные структуры (например, конъюгаты эстрогенов), вещества, произведенные из растений, животных, микроорганизмов или неорганического вещества, химическая структура которых может быть неизвестной или трудно определяемой. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы.
3.1.78 инструкция по применению лекарственного средства (SMPC - Summary of Product Characteristics, product labelling): Информация о лекарственном средстве, представленная для его регистрации в уполномоченный орган.
Примечания
1 Содержание инструкции по применению может быть изменено только с ведома уполномоченного органа, зарегистрировавшего данное лекарственное средство.
2 Инструкция по применению предоставляет медицинским специалистам базовую информацию о безопасном и эффективном использовании лекарственного средства.
3.1.79 целевая популяция (target population): Тип пациентов или потребителей, для которого показано применение зарегистрированного лекарственного средства.
3.1.80 терапевтические показания (therapeutic indication): Предназначение лекарственного средства, зарегистрированного в уполномоченном органе.
Примечание - При проведении клинических исследований терапевтическими показаниями является исследуемое применение, описанное в протоколе клинического исследования.
3.1.81 торговый знак (trademark): Отличительный знак или символ, используемый физическим лицом, предприятием или другим юридическим лицом в качестве опознавательного знака уникального источника товаров или услуг, по которому потребитель может отличить их от товаров и услуг других физических или юридических лиц.
3.1.82 единица представления (unit of presentation): Качественный термин, описывающий отдельную исчислимую сущность, представляющую лекарственный препарат или произведенный продукт, с экземпляром которой производится сравнение при оценке активности или количества.
Примеры
1 При описании активности - доза, спрей или таблетка "содержит 100 мкг в расчете на спрей" (единица представления = спрей).
2 При описании качества: пузырек, коробка или флакон "содержит 100 мл в расчете на пузырек" (единица представления = пузырек).
Примечание - Единица представления может иметь то же название, что и другой элемент словаря данных, например, основная дозированная форма или контейнер, но эти два понятия не эквивалентны и должны иметь в словаре разные уникальные идентификаторы терминов.
3.1.83 версия (version): Механизм, позволяющий учесть, что на определенную дату некоторые свойства исследуемого или зарегистрированного лекарственного средства изменились, и позволяющий отслеживать эти изменения на протяжении всего жизненного цикла продукта.
3.1.84 словарь (vocabulary): Терминологический словарь, содержащий термины и определения из одной или более конкретных областей знаний (ISO 1087-1:2000, определение 3.7.2).
3.2 Сокращения
3.2.1 BAID_1 - идентификатор серии лекарственного средства (на внешней упаковке).
3.2.2 BAID_2 - идентификатор серии лекарственного средства (на первичной упаковке).
3.2.3 BRIDG - модель Группы интегрированной предметной области биомедицинских исследований (The Biomedical Research Integrated Domain Group Model).
________________
Дополнительную информацию см. на сайте //www.bridgmodel.org.
3.2.4 DIBD - международная дата рождения разработки, МДРР (Development International Birth Date).
3.2.5 DSUR - отчет по безопасности разработки (Development Safety Update Report).
3.2.6 GTIN - Глобальный номер предмета торговли (Global Trade Item Number
)
.
________________
В ИСО 11615-2012 приведено ошибочное наименование "Global Trade Identification Number".
Дополнительная информация размещена на сайте Международной ассоциации GS1: //www.gs1.org.
3.2.7 IBAID_1 - идентификатор серии исследуемого лекарственного средства (на внешней упаковке).
3.2.8 IBAID_2 - идентификатор серии исследуемого лекарственного средства (на первичной упаковке).
3.2.9 IBD - Международная дата рождения лекарственного средства, МДР (International Birth Date).
3.2.10 ID - идентификатор (Identifier).
3.2.11 IDMP - идентификация/лекарственных средств (Identification of Medicinal Products).
3.2.12 IMPID - идентификатор исследуемого лекарственного средства (Investigational Medicinal Product Identifier).
3.2.13 INN - международное непатентованное наименование, MHH (International non-proprietary name).
3.2.14 IMDRF - Международный форум органов регистрации медицинских изделий (International Medical Devices Regulators' Forum).
3.2.15 IPCID - идентификатор упаковки исследуемого лекарственного средства (Investigational Medicinal Product Package Identifier).
3.2.16 MPID - идентификатор лекарственного средства (Medicinal Product Identifier).
3.2.17 OID - объектный идентификатор, ОИД (Object identifier).
3.2.18 PBRER - периодический отчет об оценке соотношения пользы и риска (Periodic Benefit-Risk Evaluation Report).
3.2.19 PCID - идентификатор упаковки лекарственного средства (Medicinal Product Package Identifier).
3.2.20 PhPID - идентификатор лекарственного препарата (Pharmaceutical Product Identifier).
3.2.21 PSUR - периодический отчет по безопасности лекарственного средства, ПОБЛС (Periodic Safety Update Report).
3.2.22 SPC/SmPC - инструкция по применению лекарственного средства (Summary of Product Characteristics).
3.2.23 UML - Унифицированный язык моделирования (Unified Modeling Language [Object Management Group, Inc.]) .
________________
Дополнительную информацию см. на сайте //www.uml.org.
3.2.24 UDI - уникальный идентифицирующий код медицинского изделия (Unique Device Identification Code (Форум IMDRF)).
3.2.25 WHO - Всемирная организация здравоохранения, ВОЗ (World Health Organization) .
________________
Дополнительную информацию см. на сайте //www.who.int.
4 Требования
4.1 Понятия, необходимые для уникальной идентификации лекарственных средств
4.1.1 Общие положения
В настоящем стандарте даются определения понятий, необходимых для уникальной идентификации лекарственных средств на международном уровне, когда она необходима (например, для фармаконадзора и международных отчетов о нежелательных реакциях и управлении рисками).
В каждой юрисдикции существуют системы присвоения регистрационных номеров лекарственным препаратам, уникальной нумерации упаковок, нумерации серий, штрих-кодирования и т.д. Дополнительные идентификаторы, определяемые в настоящем стандарте, предлагают средства идентификации, которые не заменяют эти системы, а дополняют их.
Такая идентификация должна следовать описанным ниже принципам.
4.1.2 Зарегистрированные лекарственные средства
Уникальная идентификация зарегистрированного лекарственного средства и описание его основных характеристик должны быть основаны на следующих принципах:
a) лекарственному средству должен присваиваться уникальный идентификатор (MPID), обеспечивающий возможность надежного определения лекарственного средства, а также мониторинга и отслеживания его применения;
b) упаковке лекарственного средства должен присваиваться уникальный идентификатор (PCID), обеспечивающий возможность надежного определения и отслеживание упакованного лекарственного средства в процессе поставки или продажи;
c) серии лекарственного средства должен присваиваться уникальный идентификатор (BAID_1), размещаемый на внешней упаковке лекарственного средства и обеспечивающий возможность надежного определения и отслеживания номера серии лекарственного средства, произведенной изготовителем, в соответствии с требованиями органа регистрации;
d) серии лекарственного средства должен присваиваться уникальный идентификатор (BAID_2), размещаемый на первичной упаковке лекарственного средства, не являющейся внешней упаковкой. Этот идентификатор должен обеспечивать возможность надежного определения и отслеживания номера серии лекарственного средства, произведенной изготовителем, в соответствии с требованиями органа регистрации.
Основными свойствами, связанными с идентификаторами MPID, PCID, BAID_1 и BAID_2, являются:
- наименование лекарственного средства;
- юридический статус отпуска;
- срок действия регистрации;
- разрешение уполномоченного органа;
- производитель (производители);
- качественный и количественный состав;
- ингредиенты, активность, форма препарата, путь введения;
- медицинское изделие (изделия), являющиеся частью лекарственного средства;
- фармакологические свойства;
- классификация (классификации) лекарственного средства;
- описание упаковки (например, контейнер, медицинское изделие или устройство применения и количество упаковок);
- регистрационное досье.
4.1.3 Исследуемые лекарственные средства
Уникальная идентификация исследуемого лекарственного средства и описание его основных характеристик должны быть основаны на следующих принципах:
a) лекарственному средству должен присваиваться уникальный идентификатор (IMPID), обеспечивающий возможность надежного определения лекарственного средства, а также мониторинга и отслеживания его применения в клиническом исследовании;
b) упаковке исследуемого лекарственного средства должен присваиваться уникальный идентификатор (IPCID), обеспечивающий возможность надежного определения и отслеживание упакованного лекарственного средства в процессе клинического исследования;
c) серии исследуемого лекарственного средства должен присваиваться уникальный идентификатор (IBAD_1), размещаемый на внешней упаковке лекарственного средства и обеспечивающий возможность надежного определения и отслеживания номера серии лекарственного средства в соответствии с требованиями органа регистрации клинических исследований;
d) серии исследуемого лекарственного средства должен присваиваться уникальный идентификатор (IBAID_2), размещаемый на первичной упаковке лекарственного средства, не являющейся внешней упаковкой. Этот идентификатор должен обеспечивать возможность надежного определения и отслеживания номера серии лекарственного средства в соответствии с требованиями органа регистрации клинических исследований.
Основными свойствами, связанными с идентификаторами IMPID, IPCID, IBAID_1 и IBAID_2, являются:
- наименование (наименования) или код исследуемого лекарственного средства;
- спонсор клинического исследования;
- производитель (производители);
- разрешение уполномоченного органа;
- качественный и количественный состав;
- активность (с учетом различных стадий разработки лекарства и максимальной дозы), форма препарата, путь введения;
- медицинское изделие (изделия), являющиеся частью лекарственного средства;
- фармакологические свойства;
- классификация (классификации) лекарственного средства;
- описание упаковки (например, контейнер, медицинское изделие или устройство применения и количество упаковок для целей клинического исследования).
4.1.4 Понятия, необходимые для уникальной идентификации лекарственного средства и его связи с идентификаторами лекарственных препаратов PhPID
В настоящем стандарте определены понятия, необходимые для описания связи зарегистрированного или исследуемого лекарственного средства с соответствующим идентификатором лекарственного препарата (препаратов), описанным в стандарте ISO 11616. Описание такой связи должно включать в себя все нижеперечисленное:
a) связь лекарственного средства с одним или несколькими лекарственными препаратами как компонентами способа применения (например, комплект из вагинальных таблеток 500 мг и вагинального крема 10%);
b) характеристику лекарственного препарата (препаратов), описывающую активную субстанцию (субстанции) или контролируемую субстанцию (субстанции), их (референтную) активность, (применяемую) форму лекарственного препарата, любое медицинское изделие, являющегося неотъемлемой частью лекарственного средства (например, подложка для клеточного лекарственного средства);
c) описание лекарственного препарата (препаратов) в дозированной лекарственной форме, разрешенной для применения, если необходимо, после восстановления, в соответствии с описанием применения в регистрационном досье;
d) связь между зарегистрированным (исследуемым) лекарственным средством и лекарственным препаратом (препаратами) в форме одного или нескольких идентификаторов PhPID.
4.1.5 Понятия, необходимые для уникальной идентификации лекарственного средства и его связи с регистрационным номером
Регистрационный номер, присваиваемый лекарственному средству уполномоченным органом, может назначаться в соответствии со следующими основными принципами.
Он может назначаться лекарственному средству без учета различных размеров упаковки (например, лекарству Б - урсодезоксихолевая кислота 50 таблеток с пленочным покрытием 250 мг - присвоен регистрационный номер 15.2YZ; лекарство Б. Этому же лекарству в упаковке 100 таблеток с пленочным покрытием форме 250 мг присвоен тот же самый номер 15.2YZ).
________________
Это подходящий пример коммерчески доступного лекарства. Его название приведено для удобства чтения настоящего стандарта и не означает какую-либо поддержку этого лекарства со стороны ИСО.
Регистрационный номер может назначаться отдельно лекарственному средству и одной или нескольким его упаковкам, чтобы различать уровень лекарственного средства и уровень упаковок (например, лекарству B - амоксициллин в капсулах , в соответствии с фармакопеей, для приема внутрь, содержание 250 мг - присвоен регистрационный номер 0XYZ1-20Z0 (на уровне лекарства); пузырьку по 100 капсул - регистрационный номер 0XYZ1-20Z0-01 (на уровне упаковки), а пузырьку по 500 капсул - регистрационный номер 0XYZ1-20Z0-05. Лекарству B - амоксициллин в капсулах, в соответствии с фармакопеей, для приема внутрь, содержание 500 мг - присвоен регистрационный номер 0XYZ1-20K0 (на уровне лекарства); пузырьку по 100 капсул - регистрационный номер 0XYZ1-20K0-01 (на уровне упаковки), а пузырьку по 500 капсул - регистрационный номер 0XYZ1-20K0-05.
________________
Это подходящий пример коммерчески доступного лекарства. Его название приведено для удобства чтения настоящего стандарта и не означает какую-либо поддержку этого лекарства со стороны ИСО.
Регистрационный номер может назначаться представлению лекарственного средства, то есть каждому представлению лекарства назначается отдельный номер (например, лекарству A - суспензия для подкожных инъекций 40 ЕД/мл в стеклянном флаконе 10 мл (1,4 мг/мл), 1 флакон - присвоен регистрационный номер V/00/1YX/001; лекарству А - суспензия для подкожных инъекций 100 ЕД/мл в стеклянном флаконе 10 мл (3,5 мг/мл), 1 флакон - присвоен регистрационный номер V/00/1YX/003).
Примечание - Некоторые лекарственные средства могут распространяться без регистрации на данной территории (например, лекарства, введенные в обращение до создания уполномоченного органа). Таким лекарствам присваивается лицензионный номер, размещаемый на упаковке, на коробке или печатаемый на вкладыше в упаковку.
В настоящем стандарте определяются понятия, необходимые для установления связи между идентификаторами MPID и PCID с релевантными регистрационными номерами, присвоенными уполномоченной организацией. Такая связь должна удовлетворять следующим двум принципам:
- идентификатор MPID всегда должен быть связан с соответствующим регистрационным номером лекарственного средства (например, идентификатор MPID "Страна-055-0957" лекарства Б - таблетки с пленочным покрытием 250 мг, которое поставляется в упаковках по 50 и 100 таблеток, должен быть связан с регистрационным номером "Страна 15.2YZ";
- идентификатор PCID всегда должен быть связан с соответствующим регистрационным номером специфичной упаковки или представления лекарственного средства (например, идентификатор PCID "Страна-0787-2550-05" должен быть связан с регистрационным номером - таблетки с пленочным покрытием 250 мг, которое поставляется в упаковках по 50 и 100 таблеток, должен быть связан с регистрационным номером "0XYZ1-20Z0-05", присвоенным амоксициллину в капсулах, в соответствии с фармакопеей, для приема внутрь, содержание 250 мг.
4.1.6 Понятия, необходимые для уникальной идентификации лекарственных средств и связи с идентификаторами в носителях данных
Идентификаторы в носителях данных однозначно идентифицируют предметы, подлежащие продаже (например, лекарственные препараты или медицинские изделия), в цепи поставок. Например, глобальный номер предмета торговли (GTIN) используется для идентификации любого предмета торговли, для которого необходимо получить по запросу заранее определенную для него информацию, и который может быть оценен, заказан или на него может быть выставлен счет в любой точке любой цепи поставок. Номера GTIN могут состоять из 8, 12, 13 или 14 цифр. Глобальная группа пользователей GS1 в области здравоохранения (GS1 Healthcare User Group) способствует применению глобальной стандартизации в целях обеспечения совместимости нормативных требований всех стран. Следует заметить, что национальные, федеральные или местные нормативные требования могут применяться и иметь преимущественное значение по отношению к любому стандарту GS1.
Базовыми заранее определенными характеристиками идентификаторов для идентификаторов в носителях данных могут быть:
- наименование, торговый знак и описание продукции,
- рецептура (активные ингредиенты),
- активность,
- дозировка (или применение),
- количество нетто (вес, объем или другие величины, используемые в сфере торговли),
- конфигурация упаковки,
- форма, пригодность или функция,
- для групп, число элементарных предметов торговли в составе группы, подразделение в единицах промежуточной упаковки, способ группирования (коробка, блистер, ячейка блистера).
Изменение любого из этих базовых элементов, характеризующих предмет торговли, обычно влечет за собой изменение идентификатора в носителе данных. К идентификатору в носителе данных могут быть добавлены дополнительные данные, например, номер серии и срок годности.
5 Описание принципов и методов информационного моделирования
5.1 Общие положения
Для построения информационной модели, представленной в настоящем стандарте, использован Унифицированный язык моделирования UML (Unified Modelling Language), развиваемый Группой моделирования объектов OMG (Object Modelling Group).
Как и во всех языках, с помощью UML одно и то же содержание можно представить несколькими разными способами, придерживаясь разных стилей и шаблонов представления. В настоящем стандарте выбран очень простой способ представления, использующий только классы, атрибуты и ассоциации базовых типов. В целях простоты некоторые конструкции языка (например, стереотипы и сложные ассоциации) не применяются. В следующих разделах описан стиль моделирования, принятый в настоящем стандарте.
Кроме того, в диаграммах используется цветовое кодирование, помогающее визуальному восприятию групп сущностей, связанных между собой.
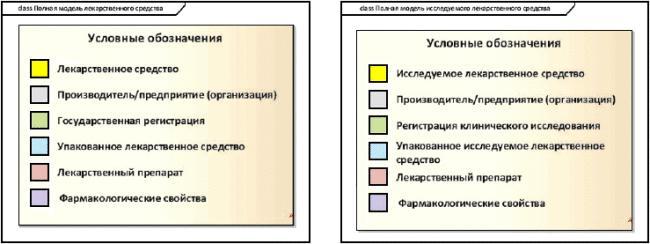
Рисунок 1 - Условные цветовые обозначения классов модели
|
Рисунок 1 - Условные цветовые обозначения классов модели
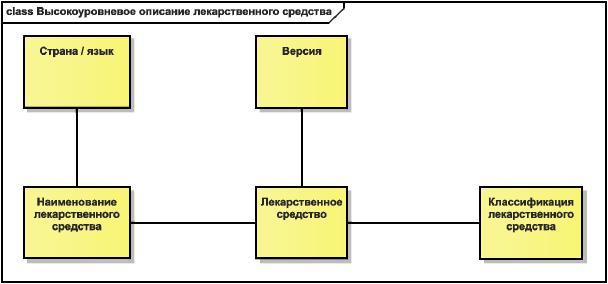
5.2 Концептуальные обзорные диаграммы
В стандарте приведены две концептуальные диаграммы (по одной для лекарственного средства и исследуемого лекарственного средства), дающие общие представления, которые далее будут раскрыты более детально.
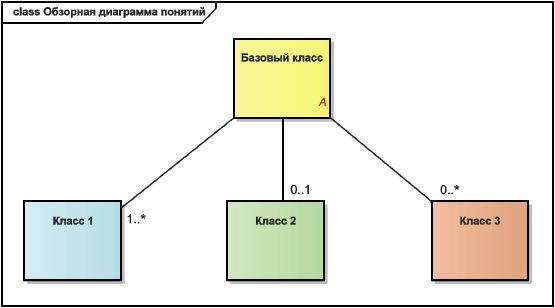
Эти диаграммы показывают по одному представительному классу из каждого информационного раздела, связанному с базовым понятием (с лекарственным средством или с исследуемым лекарственным средством).
На них показаны базовые кратности связей между (исследуемым) лекарственным средством и этими представительными классами, но не показаны ни другие сущности, ни другие ассоциации, ни атрибуты.
Рисунок 2 - Пример концептуальной обзорной диаграммы
|
Рисунок 2 - Пример концептуальной обзорной диаграммы
5.3 Высокоуровневые диаграммы разделов
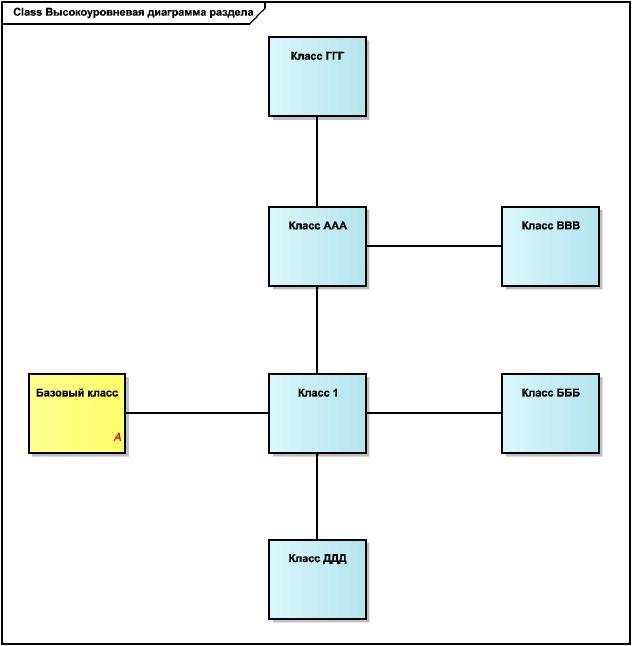
В начале каждого информационного раздела приводятся высокоуровневые диаграммы, на которых показаны все классы, описанные в этом разделе, и все концептуальные отношения между этими классами. Исходной точкой всегда служит (исследуемое) лекарственное средство.
На этих концептуальных диаграммах не показаны ни кратности, ни атрибуты, поскольку их основной целью является описание общей картины, которая далее будет раскрыта в более детальных диаграммах.
Рисунок 3 - Пример высокоуровневой диаграммы раздела
|
Рисунок 3 - Пример высокоуровневой диаграммы раздела
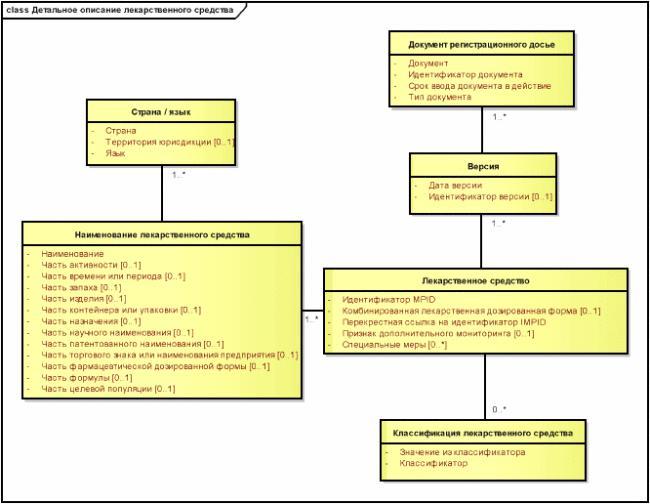
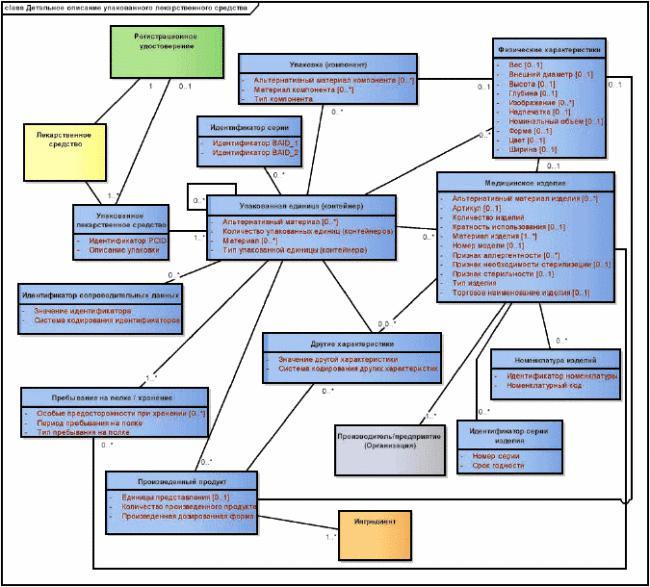
5.4 Детальные диаграммы
5.4.1 Общие положения
На детальных диаграммах, приведенных в каждом разделе, показаны все классы и все атрибуты, необходимые для представления содержания этого раздела, а также детали концептуальных отношений между этими классами.
5.4.2 Отношения между классами
В целях сохранения простоты модели отношения между классами описаны в контексте (исследуемого) лекарственного средства просто как ассоциации, не уточняя ни их роль, ни тип. (В то же время, к примеру, в модели BRIDG дается явное описание семантики связей, скажем, "имеет функцию" или "выполняется с помощью").
Кратности отношений описаны только в одном направлении, а именно, от (исследуемого) лекарственного средства как прямого или косвенного источника. Это вызвано тем, что целью настоящего стандарта является описание (исследуемого) лекарственного средства и сопутствующей ему информации, поэтому использование (исследуемого) лекарственного средства в качестве источника отношений вносит больше ясности и позволяет избежать сложных связей многие-ко-многим, которые могли бы возникнуть, если бы отношения были направлены от вспомогательного класса к (исследуемому) лекарственному средству.
Обозначения кратности "1" и "1..1" являются синонимами.
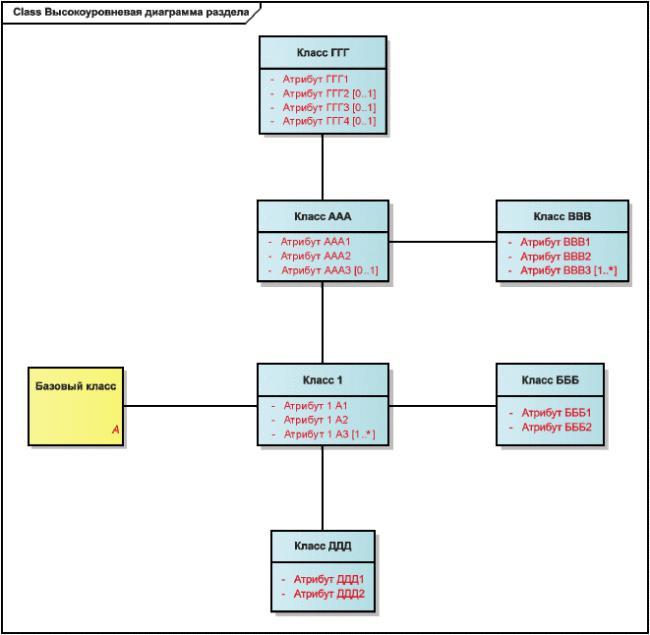
Рисунок 4 - Пример детальной диаграммы
|
Рисунок 4 - Пример детальной диаграммы
Кратность сущности "1", означает, что эта сущность должна быть указана и что должен существовать ровно один экземпляр информации, описывающей эту сущность.
Кратность сущности "1..*", означает, что эта сущность должна быть указана и что должен существовать один экземпляр информации, описывающей эту сущность, и может существовать еще несколько таких экземпляров.
Кратность сущности "0..1", означает, что эта сущность может быть указана и что может существовать один экземпляр информации, описывающей эту сущность.
Кратность сущности "0..*", означает, что эта сущность может быть указана и что может существовать несколько экземпляров информации, описывающей эту сущность.
5.4.3 Атрибуты классов
Атрибуты класса описаны в модели с помощью имен. Определение атрибута, его описание и примеры значений приводятся в тексте вслед за диаграммой классов.
Если кратность атрибута явно не задана, подразумевается, что этот атрибут обязателен и должен иметь одно значение (что эквивалентно кратности [1..1]).
Кратность атрибута [1..*] означает, что он обязателен и может иметь одно или несколько значений.
Кратность атрибута [0..1] означает, что он может не иметь значения или имеет одно значение.
Кратность атрибута [0..*] означает, что он может не иметь значения или имеет одно или несколько значений.
Типы данных, которые должны иметь значения атрибутов, в модели явно не указаны. Однако в тексте описания каждого атрибута указана форма, в которой должно быть указано его значение.
В приложении E приведены некоторые указания, каким образом эти разные формы или образцы значений, описанные в тексте, могут быть представлены, используя типы данных в здравоохранении, специфицированные в стандарте ИСО 21090.
5.4.4 Обобщенные классы и шаблоны
При построении диаграммам использован один обобщенный класс, с помощью которого однократно определенный шаблон информации используется в нескольких дочерних классах. Простоты ради формальное отношение генерализации, принятое в языке UML, не используется. Вместо этого в каждой специализации используется имя этого класса.
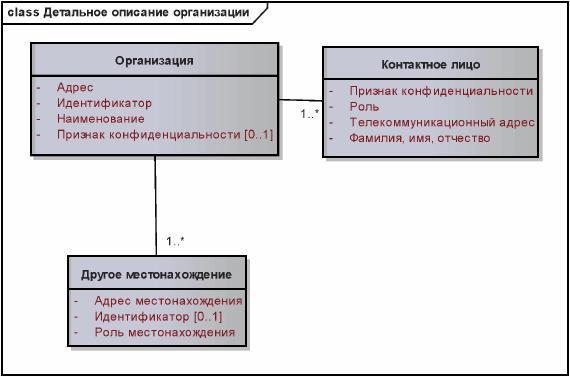
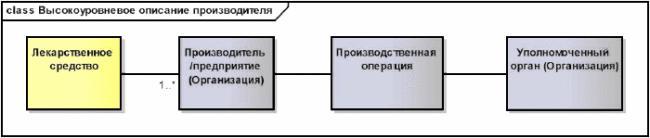
Детальное описание классов "Организация", "Контактное лицо" и "Другие местонахождения" дается однократно в соответствующем подразделе. Где бы далее не использовалась информация типа "Организация", "Контактное лицо" или "Другие местонахождения", например, в классах "Производитель/предприятие (Организация)" или "Уполномоченная организация (Организация)", скобки "(Организация)" будут указывать, что соответствующая информация наследуется от обобщенного класса "Организация".
В диаграммах несколько раз используется еще один обобщенный шаблон, а именно, там, где в достаточно общих классах требуется описать сущность, использующую (не специфицированную) классификацию, или номенклатуру, или систему идентификации. Чтобы сделать это на концептуальном уровне, в модели показан класс с двумя атрибутами: первый идентифицирует систему (классификация, номенклатура или система идентификации), а второй - используемый термин или значение из этой системы.
5.4.5 Перевод и язык
За исключением особого указания, касающегося наименования лекарственного средства (см. 7.2.2.5), других описаний перевода информации, описанной в настоящем стандарте, нет. Предполагается, что при глобальном применении стандарта перевод потребуется и будет выполнен при реализации его положений.
6 Идентифицирующие характеристики зарегистрированных лекарственных средств
6.1 Первичные идентификаторы
6.1.1 Общие положения
Для соответствия требованиям, указанным в 4.1, должны быть указаны следующие четыре идентификатора:
a) MPID - идентификатор лекарственного средства;
b) PCID - идентификатор упаковки лекарственного средства;
c) BAID_1 - уникальный идентификатор серии лекарственного средства, нанесенный на его внешнюю упаковку;
d) BAID_2 - уникальный идентификатор серии лекарственного средства, нанесенный на его первичную упаковку, не являющуюся внешней упаковкой.
Кроме того, используется связь с идентификаторами лекарственных препаратов (PhPID), описанная в стандарте ISO 11616.
В руководстве по применению стандарта могут быть приведены дополнительные детали применения этих идентификаторов.
6.2 Идентификатор лекарственного средства (MPID)
6.2.1 Общие положения
Каждому зарегистрированному лекарственному средству должен быть присвоен уникальный идентификатор MPID в дополнение к любому существующему регистрационному номеру, присвоенному уполномоченным органом. Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственные средства во всем мире.
Структура идентификатора MPID должна следовать общему шаблону сегментов данных о лекарственном средстве, в котором каждый заполненный сегмент должен определять специфичный компонент идентификатора. Этот шаблон содержит:
a) кодированный сегмент страны (двухбуквенный код страны в соответствии со стандартом ИСО 3166);
b) кодированный сегмент владельца регистрационного удостоверения (идентификатор организации);
c) кодированный сегмент лекарственного средства (уникальный идентификатор лекарственного средства).
Любые изменения значений этих кодированных сегментов должны приводить к присваиванию нового идентификатора MPID.
6.2.2 Кодированные сегменты идентификатора MPID
Кодированные сегменты идентификатора MPID должны формироваться по описанным ниже правилам.
6.2.2.1 Кодированный сегмент страны
Кодированный сегмент страны должен содержать код страны той территории, на которую распространяются полномочия уполномоченного органа по регистрации лекарственных средств. Код страны выбирается из таблицы двухбуквенных кодов, определенных в стандарте ИСО 3166.
6.2.2.2 Кодированный сегмент владельца регистрационного удостоверения (идентификатор организации)
Этот сегмент должен содержать уникальный идентификатор владельца регистрационного удостоверения, выданного данному лекарственному средству (идентификатор организации). Этот идентификатор можно взять из международной системы уникальной идентификации владельцев регистрационного удостоверения (организаций), если таковая имеется.
6.2.2.3 Кодированный сегмент лекарственного средства
Этот кодированный сегмент должен содержать уникальный идентификатор, присваиваемый лекарственному средству. С этим идентификатором должен быть связан следующий набор атрибутов лекарственного средства, которому он присвоен:
a) регистрационный номер, присвоенный уполномоченным органом;
b) юридический статус отпуска (например, по рецепту или без рецепта);
c) наименование лекарственного средства;
d) дозированная лекарственная форма;
е) ингредиенты и их активность;
f) медицинские изделия в случае, если лекарственное средство комбинируется с таким изделием и достигаемый фармакологический, иммунологический и метаболический эффект рассматривается как основной способ применения; такое медицинское изделие считается компонентом лекарственного средства;
g) терапевтические показания, указанные в регистрационном удостоверении.
Любые изменения значений этих атрибутов, учитываемые в процессе регистрации уполномоченным органом, должны приводить к присваиванию нового уникального идентификатора MPID.
Пример: при изготовлении сезонной вакцины от гриппа штамм вируса может зависеть от сезона. При каждом изменении штамма вакцине должен присваиваться новый идентификатор MPID.
Выполнение этого правила может приводить к изменению идентификатора MPID, даже если существующие юридические идентификаторы (например, регистрационный номер) не изменяются. Настоящий стандарт не требует, чтобы такие юридические идентификаторы менялись вместе с идентификатором MPID. Каждая страна может придерживаться сложившейся практики присвоения регистрационных номеров.
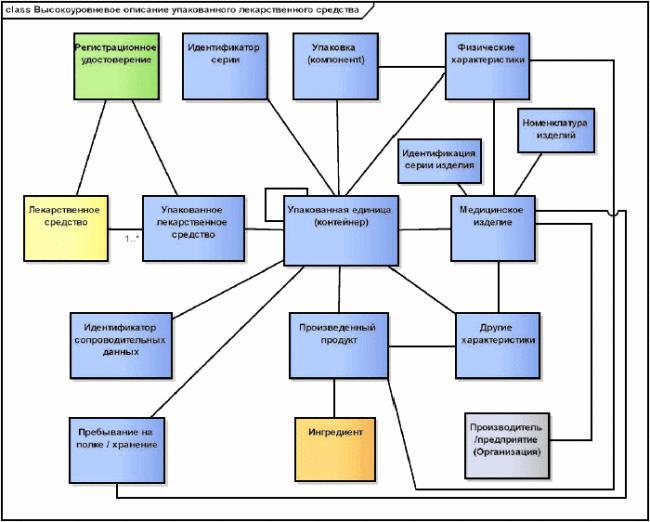
6.3 Идентификатор упакованного лекарственного средства (PCID)
6.3.1 Общее описание
Каждому упакованному лекарственному средству должен быть присвоен уникальный идентификатор PCID в дополнение к любому существующему регистрационному номеру уровня упаковки, присвоенному уполномоченным органом.
Структура идентификатора PCID должна следовать общему шаблону сегментов данных об упакованном лекарственном средстве, в котором каждый заполненный сегмент должен определять специфичный компонент идентификатора. Этот шаблон содержит:
a) идентификатор лекарственного средства MPID,
b) кодированный сегмент описания упаковки, который задает уникальный идентификатор каждому типу упаковки.
Любые изменения значений этих кодированных сегментов должны приводить к присваиванию нового идентификатора PCID.
6.3.2 Кодированные сегменты идентификатора PCID
Кодированный сегмент идентификатора PCID должен формироваться по описанным ниже правилам.
6.3.2.1 Кодированный сегмент описания упаковки
Этот кодированный сегмент должен содержать уникальный идентификатор, присваиваемый конкретному типу упаковки лекарственного средства. С этим идентификатором должен быть связан следующий набор атрибутов:
- единица упаковки (контейнер или контейнеры) - тип, количество (единиц в упаковке), материалы и альтернативные материалы;
- компонент или компоненты упаковки - тип, материалы и альтернативные материалы;
- произведенный продукт (продукты) - произведенная дозированная форма, единицы представления, количество (единиц продукта в упаковке).
Любые изменения значений этих атрибутов, учитываемые в процессе регистрации уполномоченным органом, должны приводить к присваиванию нового уникального идентификатора упакованного лекарственного средства PCID.
Выполнение этого правила может приводить к изменению идентификатора PCID, даже если существующие юридические идентификаторы (например, регистрационный номер) не изменяются. Настоящий стандарт не требует, чтобы такие юридические идентификаторы менялись вместе с идентификатором PCID. Каждая страна может придерживаться сложившейся практики присвоения регистрационных номеров.
6.4 Идентификатор серии лекарственного средства (BAID_1)
Каждой серии зарегистрированного лекарственного средства должен быть присвоен идентификатор BAID_1. Этот идентификатор должен быть образован из номера серии, срока годности и идентификатора PCID. В идентификатор BAID_1 должен быть включен тот номер серии, который указан на внешней упаковке конкретной серии лекарственного средства.
Идентификатор BAID_1 должен иметь общий набор атрибутов, относящихся к упакованному лекарственному средству. Если все эти атрибуты имеют значения, то их сочетание определяет специфичное понятие, отличаемое с помощью идентификатора BAID_1:
- идентификатор PCID;
- номер серии (указанный на внешней упаковке);
- срок годности (месяц/год) в формате даты, соответствующем стандарту ИСО 8601.
6.5 Идентификатор серии лекарственного средства (BAID_2)
Каждой серии зарегистрированного лекарственного средства должен быть присвоен идентификатор BAID_2. Этот идентификатор должен быть образован из номера серии, срока годности и идентификатора PCID. В идентификатор BAID_2 должен быть включен тот номер серии, который указан на первичной упаковке конкретной серии лекарственного средства, не являющейся внешней упаковкой.
Идентификатор BAID_2 должен иметь общий набор атрибутов, относящихся к упакованному лекарственному средству. Если все эти атрибуты имеют значения, то их сочетание определяет специфичное понятие, отличаемое с помощью идентификатора BAID_2:
- идентификатор PCID;
- номер серии (указанный на первичной упаковке, не являющейся внешней упаковкой);
- срок годности (месяц/год) в формате даты, соответствующем стандарту ИСО 8601.
7 Информация о зарегистрированном лекарственном средстве
7.1 Обзор информации о зарегистрированном лекарственном средстве
7.1.1 Общее описание
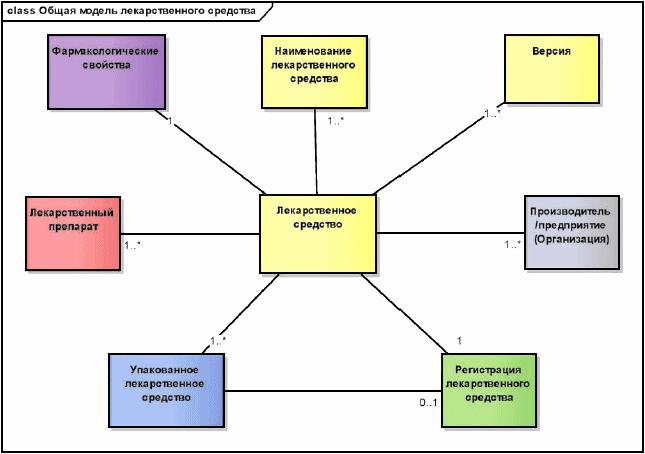
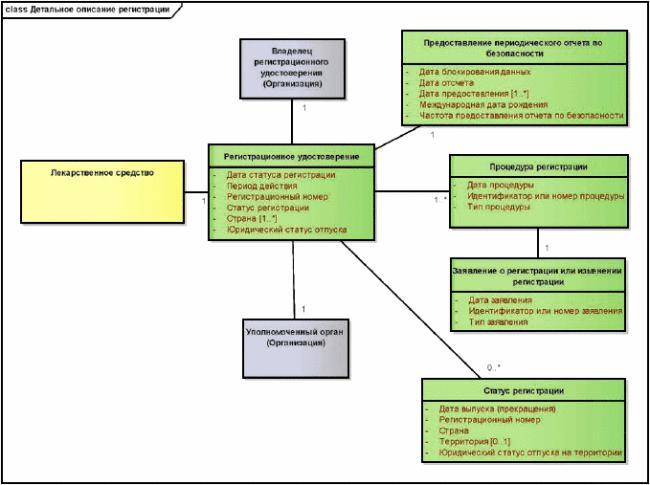
Для описания характеристик зарегистрированного лекарственного средства, имеющего идентификатор MPID, в дополнение к описанным выше идентификаторам должны использоваться основные понятия, модель которых представлена на рисунке 5 и описана ниже в тексте.
Рисунок 5 - Общая модель информации о лекарственном средстве
|
Рисунок 5 - Общая модель информации о лекарственном средстве
7.1.2 Лекарственное средство
В этом разделе описан идентификатор MPID вместе с информацией, которая уникально идентифицирует лекарственное средство и описывает его свойства, внесенные в регистрационное досье.
7.1.3 Наименование лекарственного средства
В этом разделе описано наименование лекарственного средства, присвоенное уполномоченным органом, которое внесено в регистрационное досье, а также разбиение этого наименования на различные части.
7.1.4 Версия
В этом разделе описана версионность основных идентификаторов, относящихся к лекарственному средству в данной юрисдикции, а также свойств, ассоциированных с лекарственным средством, и документации.
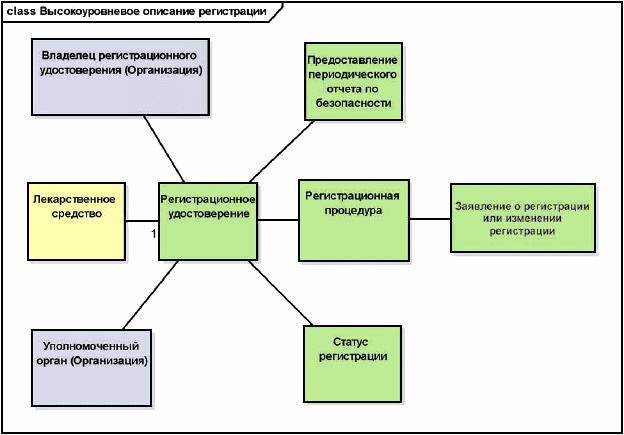
7.1.5 Регистрация лекарственного средства
Этот раздел содержит информацию о регистрации уполномоченным органом, позволяющей фармацевтической организации ввести лекарственное средство в оборот на территории юрисдикции уполномоченного органа.
7.1.6 Производитель/предприятие
В этом разделе указаны характеристики производственного процесса и других сопутствующих процессов и их лицензирование уполномоченным органом, выдающим производителю или предприятию разрешение на производство и выполнение сопутствующих процессов на территории юрисдикции уполномоченного органа.
7.1.7 Упакованное лекарственное средство
Этот раздел описывает информацию об упаковке и контейнере (контейнерах), в которые помещено лекарственное средство, а также о любых медицинских изделиях, которые являются неотъемлемой частью лекарственного средства или продаются либо поставляются производителем в комплекте с ним. В нем также указана информация об ингредиентах произведенного продукта.
7.1.8 Лекарственный препарат
Этот раздел содержит информацию о лекарственном средстве в дозированной форме, предназначенной для приема пациентом и указанной в регистрационное досье. Он также содержит ссылку на соответствующий набор (наборы) идентификаторов PhPID и ингредиенты. Он также содержит информацию о медицинском изделии, если оно является неотъемлемой частью лекарственного средства (например, подложка или сетка для клеточного лекарственного средства).
7.1.9 Фармакологические свойства
Этот раздел описывает информацию о фармакологических свойствах лекарственного средства, включенных в регистрационное досье.
7.2 Лекарственное средство
7.2.1 Общее описание
В этом разделе описан идентификатор MPID вместе с присвоенной уполномоченным органом информацией, которая уникально идентифицирует лекарственное средство и описывает его свойства.
Рисунок 6 - Высокоуровневая информация о лекарственном средстве
|
Рисунок 6 - Высокоуровневая информация о лекарственном средстве
Лекарственное средство имеет наименование, которое может иметь разные варианты для разных стран/языков. В течение жизненного цикла лекарственное средство (с идентификатором MPID) имеет одну или несколько версий соответствующей информации и свойств, которые могут меняться с течением времени. Лекарственное средство может быть включено в один или несколько классификаторов.
7.2.2 Детальное описание информации о лекарственном средстве
7.2.2.1 Лекарственное средство
Этот класс представляет зарегистрированное уполномоченным органом лекарственное средство и имеет описанные ниже атрибуты.
7.2.2.1.1 Идентификатор MPID
Этот атрибут содержит текстовое представление идентификатора MPID лекарственного средства. Он обязательно должен быть указан.
7.2.2.1.2 Комбинированная лекарственная дозированная форма
Комбинированная лекарственная дозированная форма является общим термином для описания двух или более произведенных продуктов, которые должны специальным образом сочетаться для получения единого лекарственного препарата. Этот атрибут включает в себя информацию о произведенной дозированной форме каждого произведенного продукта и применяемой дозированной форме лекарственного препарата. Если для лекарственного средства требуется описание комбинированной лекарственной дозированной формы, то оно может быть указано в этом атрибуте, используя термин и идентификатор термина в соответствии со стандартом ИСО 11239 и результирующей терминологией.
Рисунок 7 - Детальная диаграмма описания раздела лекарственного средства
|
Рисунок 7 - Детальная диаграмма описания раздела лекарственного средства
Пример - Порошок и его растворитель при изготовлении раствора для инъекций. Лекарственное средство представляет собой два произведенных продукта: растворяемый порошок и его растворитель. Лекарственный препарат, изготовленный из этих двух компонентов, представляет собой инъекционный раствор; дозой и формой применяемого комбинированного лекарственного средства является "порошок и растворитель для инъекционного раствора".
7.2.2.1.3 Перекрестная ссылка на идентификатор IMPID
Этот атрибут может содержать перекрестную ссылку между идентификатором MPID зарегистрированного лекарственного средства и одним или несколькими идентификаторами IMPID, присвоенными этому лекарственному средству на этапах разработки и клинического исследования. Соответствующие идентификаторы IMPID могут быть указаны в текстовой форме.
7.2.2.1.4 Признак дополнительного мониторинга
Если лекарственное средство является предметом дополнительного мониторинга, то это может быть указано в данном атрибуте, используя термин из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Пример - Мониторинг лекарств со знаком черного треугольника в Европейском Союзе.
7.2.2.1.5 Специальные меры
Если лекарственное средство является предметом специальных мер, то это может быть указано в данном атрибуте, используя термин из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Пример - Необходимость проведения пострегистрационного клинического исследования.
7.2.2.2 Версия
Определенные в настоящем стандарте характеристики зарегистрированного лекарственного средства должны обладать версионностью. Имеется в виду тот факт, что начиная с определенной даты версии некоторые характеристики лекарственного средства могли измениться, но не настолько, чтобы потребовалось присвоить лекарственному средству новый первичный идентификатор в соответствии с правилами, изложенными в подразделе "Первичные идентификаторы". Тем не менее требуется регистрировать и отслеживать эти изменения в привязке к идентификатору MPID.
7.2.2.2.1 Дата версии
В этом атрибуте должна быть указана дата регистрации или последнего изменения информации о регистрируемом продукте (например, изменения элементов, относящихся к инструкции, которые используются по ссылке для уникальной идентификации лекарственных средств и их характеристик). Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в стандарте ИСО 8601.
7.2.2.2.2 Идентификатор версии
Этот атрибут может содержать текстовое представление идентификатора или номера версии.
7.2.2.3 Документ регистрационного досье
В этом разделе должен быть описан документ, включенный уполномоченным органом в регистрационное досье и относящийся к данной версии описания лекарственного средства, связанного с идентификатором MPID.
Примечание - нормативные документы в данной юрисдикции могут уточнять требования, относящиеся к реализации стандарта в части документа регистрационного досье, например, требовать, чтобы эта информация представлялась только по запросу.
7.2.2.3.1 Тип документа
В этом атрибуте должен быть указан тип документа, поддерживающего версионность. Тип должен быть взят из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Инструкция по применению лекарственного средства, листовка упаковки, решение о регистрации лекарственного средства, регистрационное удостоверение, вкладыш в упаковку, описание применения.
7.2.2.3.2 Идентификатор документа
В этом атрибуте должна быть указана текстовая ссылка на документ уполномоченного органа, разрешающего изменение документа регистрационного досье, или текстовая ссылка на последнее изменение этого документа.
7.2.2.3.3 Документ
Этот атрибут должен содержать документ регистрационного досье, поддерживающий версионность. Формат содержания атрибута должен быть определен при реализации стандарта.
7.2.2.3.4 Срок ввода документа в действие
Этот атрибут должен содержать дату, указанную в документе уполномоченного органа, разрешающего изменение документа регистрационного досье, или срок ввода в действие последнего изменения документа регистрационного досье. Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в стандарте ИСО 8601.
7.2.2.4 Классификация лекарственного средства
Лекарственное средство может быть включено в различные классификаторы, как местные, так и международные. В этом разделе может быть указаны одна или несколько таких классификаций.
7.2.2.4.1 Классификатор
Этот атрибут должен содержать обозначение классификатора, взятое из соответствующей системы идентификации классификаторов.
7.2.2.4.2 Значение из классификатора
Этот атрибут должен содержать конкретное значение из классификатора, относящееся к данному лекарственному средству. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
Примеры:
- классификатор: Анатомическая терапевтическая и химическая классификационная система (АТХ классификация) ВОЗ; значение из классификатора: A10BA02 - метформин;
- классификатор: VHA National Drug File Reference Terminology (NDF-RT); значение из классификатора: N0000000072 - 14-alpha Demethylase Inhibitors.
7.2.2.5 Наименование лекарственного средства
Наименование лекарственного средства, представленное на одном или нескольких языках, является одной из определяющих характеристик лекарственного средства и его идентификатора MPID.
Соглашения об именовании лекарственного средства могут отличаться у уполномоченных органов с разными территориями юрисдикции. Как правило, регистрационное удостоверение лекарственного средства выдается одному владельцу, ответственному за ввод лекарственного средства в оборот. Регистрационное удостоверение содержит наименование лекарственного средства, в которое может входить, например, одно патентованное или научное наименование (по возможности, международное непатентованное наименование активной субстанции или субстанций), дополненное торговым знаком или другими характеристиками.
Другие характеристики наименования могут относиться к активности, лекарственной форме, показаниям или устройству применения и т.д.
В дополнение к полному и завершенному наименованию лекарственного средства, указанному в регистрационном удостоверении, оно должно быть разбито на части для представления в структурированном виде. В зависимости от нормативных требований наименование лекарственного средства должно быть представлено на всех официальных языках.
Примечания
1 Представление наименования лекарственного средства в структурированной форме облегчает построение индексов наименований и кодирование наименований, которое часто бывает неполным в спонтанных сообщениях о нежелательных реакциях.
2 В связи с деловыми требования к упомянутым выше индексам, это единственная часть настоящего стандарта, которая явно описывает и моделирует перевод информации, указывая язык ее представления (и территорию, если это необходимо).
7.2.2.5.1 Наименование
В этом атрибуте должно быть представлено в форме текста полное и завершенное наименование лекарственного средства, утвержденное уполномоченным органом.
7.2.2.5.2 Часть патентованного наименования
Этот атрибут должен содержать патентованное наименование (например, торговое наименование) лекарственного средства в текстовой форме, если таковое наименование присутствует. Оно должно быть указано без торгового знака или аналогичного обозначения.
Пример - В наименовании лекарственного средства "Лекарство XYZ Precisehaler 200 мг для взрослых" часть патентованного (торгового) наименования имеет значение "Лекарство XYZ".
7.2.2.5.3 Часть научного наименования
Этот атрибут должен содержать научное или непатентованное наименование лекарственного средства в текстовой форме, если таковое наименование присутствует.
Пример - В наименовании лекарственного средства "Гидрохлоротиазид/Ирбесартан Фарма КК" часть научного (непатентованного) наименования имеет значение "Гидрохлоротиазид/Ирбесартан".
7.2.2.5.4 Часть активности
Активность, если она приведена в наименовании лекарственного средства, должна быть указана в этом атрибуте в форме текста. Как описано в подразделе 7.7, эта часть наименования может отличаться от понятия "Активность".
Примеры
1 В наименовании лекарственного средства "Лекарство К Форте, таблетки" часть имени, означающая активность, имеет значение "Форте".
2 В наименовании лекарственного средства "SoothingMed 2,5%, крем" часть имени, означающая активность, имеет значение "2,5%".
7.2.2.5.5 Часть лекарственной дозированной формы
Лекарственная дозированная форма, если она приведена в наименовании лекарственного средства, должна быть указана в этом атрибуте в форме текста. Как описано соответственно в подразделах 7.8.2.1.1 и 7.6.2.10.2, часть лекарственной дозированной формы может отличаться от понятий применяемой дозированной формы и произведенной дозированной формы.
Пример - В наименовании лекарственного средства "Ново-лекарство X, легко глотаемые каплеты" часть лекарственной дозированной формы имеет значение "легко глотаемые каплеты".
7.2.2.5.6 Часть формулы
Формула, если она приведена в наименовании лекарственного средства, должна быть указана в этом атрибуте в форме текста.
Пример - В наименовании лекарственного средства "Сироп от кашля СпецМед без сахара" часть формулы имеет значение "без сахара".
7.2.2.5.7 Часть назначения
Назначение, если оно приведено в наименовании лекарственного средства, должно быть указано в этом атрибуте в форме текста.
Пример - В наименовании лекарственного средства "Лекарство-БИ от изжоги, каплеты" часть назначения имеет значение "от изжоги".
7.2.2.5.8 Часть целевой популяции
Целевая популяция, если она приведена в наименовании лекарственного средства, должна быть указана в этом атрибуте в форме текста.
Пример - В наименовании лекарственного средства "Бронхо-лекарство капсулы 3,5 мг для детей" часть целевой популяции имеет значение "для детей".
7.2.2.5.9 Часть контейнера или упаковки
Контейнер или упаковка, если они приведены в наименовании лекарственного средства, должны быть указаны в этом атрибуте в форме текста.
Примеры
1 В наименовании лекарственного средства "LXA 10 мг/мл раствор для подкожных инъекций 4 мл 1 флакон" часть контейнера имеет значение "флакон (стекло)".
2 В наименовании лекарственного средства "Сердечное лекарство, упаковка для титрования" часть контейнера имеет значение "упаковка для титрования".
3 В наименовании лекарственного средства "Бактериальная вакцина мультидозный флакон" часть контейнера имеет значение "мультидозный флакон".
7.2.2.5.10 Часть изделия
Медицинское изделие, если оно приведено в наименовании лекарственного средства, должно быть указано в этом атрибуте в форме текста.
Пример - В наименовании лекарственного средства "Лекарство XYZ Precisehaler 200 мг для взрослых" часть изделия имеет значение "Precisehaler".
7.2.2.5.11 Часть торгового знака или наименования предприятия
Торговый знак, если он приведен в наименовании лекарственного средства, должен быть указан в этом атрибуте в форме текста.
Пример - В наименовании лекарственного средства "Clopidrogel Pharma" часть торгового знака или наименования предприятия имеет значение "Pharma
".
7.2.2.5.12 Часть времени или периода
Время или период, если они приведены в наименовании лекарственного средства, должны быть указаны в этом атрибуте в форме текста.
Пример - В наименовании противогриппозной вакцины "Противогриппозная вакцина сезона 2008-2009" часть времени или периода имеет значение "2008-2009".
7.2.2.5.13 Часть запаха
Запах, если он приведен в наименовании лекарственного средства, должен быть указан в этом атрибуте в форме текста.
Пример - В наименовании лекарственного средства "Микстура от кашля с запахом апельсина" часть запаха имеет значение "апельсин".
7.2.2.6 Страна/язык
При необходимости должны быть указаны на официальном языке страна и необязательная территория, где зарегистрировано наименование лекарственного средства.
7.2.2.6.1 Страна
Страна, в которой используется данное наименование лекарственного средства, должна быть указана с помощью двух- или трехбуквенных кодов в соответствии со стандартом ISO 3166-1.
7.2.2.6.2 Юрисдикция
При необходимости в этом атрибуте может быть указана территории страны, на которой используется данное наименование лекарственного средства. Должны быть указаны идентификатор и наименование территории, взятые из нормативного словаря.
Пример - Для Канады в этом атрибуте может быть указана провинция Квебек.
7.2.2.6.3 Язык
При необходимости в этом атрибуте может быть указан код языка наименования лекарственного средства, взятый из стандарта ISO 639-2.
7.3 Регистрация лекарственного средства
7.3.1 Общее описание
В этом разделе описана информация о регистрации лекарственного средства.
Разрешение на ввод лекарственного средства в оборот на данной территории выдается уполномоченным органом. В соответствии с законодательством и другими нормативными актами, действующими на этой территории, разрешение обычно выдается до того, как лекарство поступает в оборот. К некоторым категориям лекарственных средств могут применяться исключения (например, для лекарств, выпущенных в обращение до начала функционирования уполномоченного органа). К этим категориям лекарственных средств применяются те же принципы предоставления информации (описанные в настоящем разделе), что и к зарегистрированным лекарственным средствам. Если данное лекарственное средство не подлежало регистрации, то вместо формального владельца регистрационного удостоверения должен быть указан поставщик.
Рисунок 8 - Высокоуровневая модель информации о регистрации
|
Рисунок 8 - Высокоуровневая модель информации о регистрации
На лекарственное средство выдается регистрационное удостоверение (у некоторых лекарств, например, выпущенных в обращение до начала функционирования уполномоченного органа, формальное удостоверение отсутствует, но соответствующий информационный объект должен быть описан).
Это регистрационное удостоверение выдается уполномоченным органом организации, именуемой владельцем регистрационного удостоверения. Владелец регистрационного удостоверения может назначить конкретное лицо ответственным за деятельность по обеспечению фармаконадзора данного лекарственного средства (например, в странах ЕС такое лицо именуется "уполномоченным по фармаконадзору").
Первичная регистрация, возобновление регистрации, изменение регистрационных данных и отмена регистрации осуществляются в соответствии с определенными регистрационными процедурами, инициируемыми заявлениями о регистрации или изменении регистрации.
В течение срока жизни лекарственного средства его регистрация может претерпевать различные изменения. Поэтому статус регистрации может с течением времени изменяться и должен соответствующим образом регистрироваться.
Статус регистрации указывает, действительно ли лекарственное средство выпущено в оборот или более недоступно в стране или на территории. Он также описывает юридический статус отпуска (например, рецептурный отпуск).
Раздел предоставления периодического отчета по безопасности описывает информацию о сроках представления периодического отчета по безопасности данного лекарственного средства или периодического отчета об оценке соотношения его пользы и риска.
Примечание - Могут быть случаи, когда дополнительная информация о статусе регистрации лекарственного средства может определяться местными правилами территории юрисдикции (например, правилами штатов, провинций или территорий). В особенности это относится к юридическому статусу отпуска или к регистрационному номеру.
7.3.2 Детальное описание информации о регистрации
Рисунок 9 - Детальная модель информации о регистрации
|
Рисунок 9 - Детальная модель информации о регистрации
Для каждого лекарственного средства должна быть указана соответствующая информация о его регистрации.
При необходимости информация о регистрации должна быть указана также для упакованного лекарственного средства (см. ниже). В этих случаях должна использоваться описанная ниже структура информации за тем исключением, что информация об уполномоченном органе и владельце регистрационного удостоверения не обязательно должна быть указана заново, поскольку она наследуется от информации о регистрации данного лекарственного средства.
7.3.2.1 Регистрационное удостоверение
Лекарственное средство выпускается в оборот, когда уполномоченный орган выдает на него регистрационное удостоверение или его эквивалент.
7.3.2.1.1 Регистрационный номер
В этом атрибуте должен быть указан регистрационный номер, присвоенный уполномоченным органом страны или территории данному лекарственному средству. Формат представления - текст. Для лекарственных средств, которые в соответствии с законодательством могут обращаться без регистрации (например, в США - лекарства, выпущенные в обращение до начала функционирования уполномоченного органа) и у которых формальный регистрационный номер отсутствует, вместо него должен быть указан номер лицензии, нанесенный на упаковку или контейнер либо напечатанный на вкладыше в упаковку.
7.3.2.1.2 Страна
Страна, в которой действует регистрационное удостоверение, должна быть указана с помощью двух- или трехбуквенных кодов в соответствии с ISO 3166-1.
Если действие регистрационного удостоверения распространяется на несколько стран, то должны быть указаны все эти страны (территории юрисдикции).
7.3.2.1.3 Юридический статус отпуска
В этом атрибуте должен быть указан юридический статус отпуска лекарственного средства в соответствии с классификацией, принятой уполномоченным органом (например, отпуск по рецепту или без рецепта). Юридический статус отпуска должен быть взят из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры
1 Лекарство отпускается по рецепту.
2 Лекарство отпускается без рецепта.
7.3.2.1.4 Статус регистрации
В течение срока жизни лекарственного средства его регистрация может претерпевать различные изменения в зависимости от процедур регистрации, принятых на данной территории юрисдикции. Эти изменения должны быть указаны с помощью значений из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Активная (действительная), срок действия завершен, возобновлена, не возобновлена, отменена.
7.3.2.1.5 Дата статуса регистрации
Этот атрибут должен содержать дату начала действия данного статуса. Она должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
Пример - Срок действия регистрации истек 2011-01-01.
7.3.2.1.6 Период действия
Этот атрибут должен содержать период действия данного статуса, выраженный в терминах дат начала и срока действия регистрации. Эти даты должны быть указаны с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
Пример - Регистрация действительна в периоде с 2011-01-01 по 2015-01-01.
7.3.2.2 Владелец регистрационного удостоверения
Структура информации о владельце регистрационного удостоверения, выданного уполномоченным органом, должна соответствовать структуре класса "Организация", описанной в 7.4.
Для лекарственных средств, которые в соответствии с действующим законодательством не подлежат регистрации, вместо детальных сведений о формальном владельце регистрационного удостоверения должны быть указаны детальные сведения о поставщике, нанесенные на упаковку или контейнер либо напечатанные на вкладыше в упаковку.
7.3.2.3 Уполномоченный орган
Структура информации об уполномоченном органе, выдавшем регистрационное удостоверение на данное лекарственное средство, должна соответствовать структуре класса "Организация", описанной в 7.4.
7.3.2.4 Процедура регистрации
В этом атрибуте должна быть указана информация о процедуре регистрации, примененной для первичной регистрации лекарственного средства или для изменения регистрации.
Примечание - Нормативные документы на данной территории юрисдикции могут уточнять требования, относящиеся к реализации стандарта в части документа регистрационного досье, например, требовать, чтобы эта информация представлялась только по запросу.
7.3.2.4.1 Идентификатор или номер процедуры
В этом атрибуте должен быть указан уникальный идентификатор конкретного факта применения процедуры. Формат представления - текст.
7.3.2.4.2 Тип процедуры
В этом атрибуте должен быть указан тип процедуры, примененной при регистрации или изменении регистрации. Тип должен быть взят из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Централизованная, децентрализованная, национальная, взаимное признание.
7.3.4.2.3* Дата процедуры
_________________
* Нумерация соответствует оригиналу. - .
В этом атрибуте должны быть указаны даты начала и завершения процедуры. Эти даты должны быть указаны с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.3.2.5 Заявление о регистрации или изменении регистрации
Первичная регистрация, а также изменение существующей регистрации (например, возобновление, вариация или отмена) осуществляются по заявлениям.
Детали заявления о регистрации или изменении регистрации должны быть описаны, используя структуру этого класса.
7.3.2.5.1 Идентификатор или номер заявления
В этом атрибуте должен быть указан уникальный идентификатор конкретного заявления. Обычно идентификаторы или номера заявлений присваивает уполномоченный орган.
7.3.2.5.2 Тип заявления
Этот атрибут должен содержать тип заявления, взятый из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Первичная регистрация, возобновление регистрации, вариация, расширение.
7.3.2.5.3 Дата заявления
Этот атрибут должен содержать дату заявления о регистрации или изменении регистрации. Она должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.3.2.6 Статус регистрации
Этот класс описывает статус регистрации на дату, когда лекарственное средство действительно было выпущено в оборот, или на дату, когда оно перестало быть доступным. Он также содержит информацию о юридическом статусе отпуска (например, по рецепту или без рецепта).
Примечание - Могут быть случаи, когда дополнительная информация о лекарственном средстве (статус регистрации или юридический статус отпуска) может регулироваться местными правилами территории юрисдикции (например, правилами штатов, провинций или территорий). Структура класса статуса регистрации позволяет указать наличие такого особого регулирования.
7.3.2.6.1 Страна
Страна, в которой действует данное регистрационное удостоверение, должна быть указана с помощью двух- или трехбуквенных кодов в соответствии с ISO 3166-1.
Примечание - Для обозначения Европейского союза можно использовать код EU, не являющийся официальным кодом страны из ИСО 3166-1. Европейский союз является не государством, а организацией, членами которой являются суверенные государства. По этой причине код EU не может быть официально включен в ИСО 3166-1. Учитывая, однако, что у многих пользователей ИСО 3166-1 есть реальная потребность в применении кода EU, Агентство по ведению ИСО 316 зарезервировало этот код для идентификации Европейского союза вне рамок ИСО 3166-1.
7.3.2.6.2 Территория
Когда уполномоченный орган выдает регистрационное удостоверение, в котором предусмотрены особенности его территориального применения, то соответствующая территория может быть указана с помощью значения из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Пример - В разных провинциях Канады юридический статус отпуска лекарственного средства может отличаться. В то время как страной регистрации остается Канада, в этом атрибуте могут быть указаны названия провинций и юридический статус отпуска в каждой провинции.
7.3.2.6.3 Территориальный регистрационный номер
Этот атрибут должен содержать регистрационный номер, присвоенный уполномоченным органом на данной территории. Формат представления - текст.
7.3.2.6.4 Дата выпуска (прекращения)
Этот атрибут должен содержать дату, на которую владелец регистрационного удостоверения (или, если такового нет, производитель либо поставщик) ввел лекарственное средство в обращение в данной стране и/или на данной территории, а также дату, когда это лекарственное средство "перестало быть доступным на данном рынке". Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в стандарте ИСО 8601.
Примечание - "Ввел в обращение" означает инициирование цепи поставок лекарственного средства. "Перестало быть доступным" означает, что владелец регистрационного удостоверения принял решение более не продавать данное лекарственное средство или что действие регистрационного удостоверения прекращено.
7.3.2.6.5 Юридический статус отпуска
В этом атрибуте должен быть указан юридический статус отпуска лекарственного средства в соответствии с классификацией, принятой уполномоченным органом. Юридический статус отпуска должен быть взят из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры
1 POM - только по рецепту (Prescription only medicine).
2 Р - отпуск только через аптеку (Pharmacy only medicine).
3 GSL - общая продажа (General sales list medicine).
7.3.2.7 Предоставление периодического отчета по безопасности
Периодические отчеты по безопасности лекарственного средства (ПОБЛС) и периодические отчеты об оценке соотношения его пользы и риска предоставляются владельцем регистрационного удостоверения через определенные интервалы времени, заданные при регистрации лекарственного средства или определенные действующим законодательством. Эти отчеты содержат сводную информацию о профиле соотношения пользы и риска лекарственного средства.
Примечание - Нормативные документы на данной территории юрисдикции могут уточнять требования, относящиеся к информации, включаемой в периодические отчеты по безопасности лекарственного средства, например, требовать, чтобы определенная информация представлялась только по запросу.
7.3.2.7.1 Частота предоставления отчета по безопасности
Частота предоставления отчетов по безопасности или отчетов об оценке соотношения пользы и риска лекарственного средства может задаваться законодательством или уполномоченным органом, регистрирующим лекарственное средство на данной территории. Этот атрибут должен указывать интервал повторения как числовое значение с единицей измерения времени. Единицы измерения должны быть указаны в соответствии с ИСО 11240 и результирующей терминологией. Должны использоваться символ единицы измерения и идентификатор этого символа.
Пример - Частота предоставления ПОБЛС задается как через каждые шесть месяцев в течение первых двух лет от начала обращения лекарственного средства и раз в год в течение следующих двух лет.
7.3.2.7.2 Дата предоставления
Этот атрибут должен содержать даты предоставления ПОБЛС или отчетов об оценке соотношения пользы и риска вместе с заданной частотой предоставления. Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.3.2.7.3 Международная дата рождения
Международная дата рождения (МДР) дата первой регистрации продукта в мире, единая для всех стран. Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.3.2.7.4 Дата отсчета
Если лекарственные средства зарегистрированы в разное время, но содержат одну и ту же активную субстанцию или комбинацию активных субстанций, то уполномоченный орган данной территории может изменить и гармонизировать частоту и даты представления ПОБЛС и периодических отчетов об оценке соотношения пользы и риска, например, инициировать представление общего отчета по этим лекарственным средствам и установить новую дату отсчета периодов предоставления. Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.3.2.7.5 Дата блокирования данных
Дата блокирования данных означает дату прекращения приема новых данных для включения в ПОБЛС или периодический отчет об оценке соотношения пользы и риска. Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.4 Организация
7.4.1 Общее описание
Те классы, в имени которых указано "Организация", должны иметь общую структуру, описывающую организацию конкретного типа.
7.4.2 Детальное описание информации об организации
Рисунок 10 - Детальная модель информации об организации
|
Рисунок 10 - Детальная модель информации об организации
7.4.2.1 Организация
7.4.2.1.1 Идентификатор
Этот атрибут должен содержать уникальный идентификатор организации. Можно использовать международную систему уникальной идентификации организаций.
7.4.2.1.2 Наименование
Этот атрибут должен содержать наименование организации в текстовом формате.
7.4.2.1.3 Адрес
Этот атрибут должен содержать адрес организации в стандартизованном структурированном формате адреса.
7.4.2.1.4 Признак конфиденциальности
Этот атрибут может содержать категорию конфиденциальности информации об организации. Категория должна быть взята из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Конфиденциальная, без ограничений.
7.4.2.2 Контактное лицо
Этот класс используется для указания контактного лица в организации и его роли.
Примечание - Нормативные документы на данной территории юрисдикции могут уточнять требования, относящиеся к информации о контактном лице, например, требовать, чтобы эта информация представлялась только по запросу.
7.4.2.2.1 Фамилия, имя, отчество
Этот атрибут должен содержать фамилию, имя, отчество контактного лица в стандартизованном формате, описывающем структурированное представление фамилии, имени, отчества.
7.4.2.2.2 Телекоммуникационный адрес
Этот атрибут должен содержать телекоммуникационный адрес контактного лица (телефон, электронная почта и т.д.) в стандартизованном формате, описывающем структурированное представление телекоммуникационного адреса.
7.4.2.2.3 Роль
В этом атрибуте должна быть указана роль контактного лица в организации, связанная с контекстом данного лекарственного средства. Роль должна быть взята из подходящего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры
1 Уполномоченный по фармаконадзору (организационный контекст: владелец регистрационного удостоверения).
2 Уполномоченный по выпуску серии (организационный контекст: производитель).
3 Официальный представитель спонсора (организационный контекст: спонсор).
7.4.2.2.4 Признак конфиденциальности
Этот атрибут может содержать категорию конфиденциальности информации о контактном лице. Категория должна быть взята из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Конфиденциальная, без ограничений.
7.4.2.3 Другое местонахождение
Этот класс используется для указания одного или нескольких значимых местонахождений организации и роли этого местонахождения.
Примечание - Нормативные документы на данной территории юрисдикции могут уточнять требования, относящиеся к информации о других местонахождениях, например, требовать, чтобы эта информация представлялась только по запросу.
7.4.2.3.1 Адрес местонахождения
Этот атрибут должен содержать адрес местонахождения организации в стандартизованном структурированном формате адреса.
7.4.2.3.2 Роль местонахождения
В этом атрибуте должна быть указана роль местонахождения организации в контексте данного лекарственного средства. Роль должна быть взята из подходящего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Местонахождение нормативно-справочной информации системы фармаконадзора (организационный контекст: владелец регистрационного удостоверения).
7.4.2.3.3 Идентификатор
Этот атрибут должен содержать уникальный идентификатор местонахождений организации. Можно использовать международную систему уникальной идентификации местонахождений организаций.
7.5 Производитель/предприятие
7.5.1 Общее описание
В этом разделе описана информация о производителе или предприятии по производству лекарственного средства.
Рисунок 11 - Высокоуровневая модель информации о производителе или предприятии
|
Рисунок 11 - Высокоуровневая модель информации о производителе или предприятии
Лекарственное средство ассоциировано с информацией об одном или нескольких производителях или предприятиях, выполняющих различные производственные операции по производству этого лекарственного средства. Надзор за этой деятельностью осуществляет соответствующий уполномоченный орган.
7.5.2 Детальное описание информации о производителе или предприятии
Рисунок 12 - Детальная модель информации о производителе или предприятии
|
Рисунок 12 - Детальная модель информации о производителе или предприятии
Лекарственное средство должно быть ассоциировано с одним или несколькими производителями или предприятиями.
Примечание - Нормативные документы на данной территории юрисдикции могут уточнять требования, относящиеся к информации о производителях или предприятиях, например, требовать, чтобы эта информация представлялась только по запросу.
7.5.2.1 Производитель/предприятие (Организация)
Информация о производителе/предприятии, выполняющем конкретную производственную операцию, должна быть указана, следуя шаблону информации об организации, описанному в 7.4.
Примеры
1 Операция "выпуск серии" выполняется производителем "Фирма АБВ".
2 Операция "перемаркировка" выполняется предприятием "Фирма ГДЕ".
7.5.2.2 Производственная операция
Этот класс должен содержать информацию о производственной операции, выполняемой конкретной организацией производителя/предприятия.
7.5.2.2.1 Тип операции
Этот атрибут должен содержать тип производственной операции, взятый из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Перемаркировка, переупаковка, выпуск серии.
7.5.2.2.2 Номер лицензии на фармацевтическую деятельность
В этом атрибуте должен быть указан номер лицензии на фармацевтическую деятельность или его эквивалент. Формат представления - текст.
7.5.2.2.3 Дата начала действия
В этом атрибуте должна быть указана дата начала действия лицензии на фармацевтическую деятельность, идентифицированной в предыдущем атрибуте. Дата должна быть указана с точностью до дня (год, месяц, день) в соответствии с форматом, описанным в ИСО 8601.
7.5.2.2.4 Признак конфиденциальности
Этот атрибут может содержать категорию конфиденциальности информации о производственной операции. Категория должна быть взята из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Конфиденциальная, без ограничений.
7.5.2.3 Уполномоченный орган (Организация)
Информация об уполномоченном органе, осуществляющем надзор за конкретной производственной операцией, должна быть указана, следуя шаблону информации об организации, описанному в 7.4.
7.6 Упакованное лекарственное средство, включая произведенный продукт и медицинское изделие
7.6.1 Общие положения
В этом разделе приведено описание лекарственного средства в терминах упакованного лекарственного средства, предназначенного для поставки или продажи.
Описание упакованного лекарственного средства должно охватывать все слои упаковки от внешней до первичной, одну или несколько единиц, вложенных в упаковку, и собственно описание отдельных единиц.
Класс "Упакованное лекарственное средство" действует как коллектор для более детальных классов. В частности, каждой отдельной упакованной единице соответствует один экземпляр класса "Упакованная единица".
Класс "Упакованная единица" имеет рекурсивное отношение с самим собой; эта сложность необходима для описания упаковок внутри упаковок, например, картриджи в блистерном рукаве в коробке. Упакованная единица может быть идентифицирована с помощью одного или нескольких идентификаторов в носителях данных.
Упакованная единица может иметь составные части, например, колпачки; для описания этого факта используется класс "Упаковка (компонент)".
Самым нижним уровнем упакованной единицы (контейнера), на котором заканчивается рекурсия, является тот, который имеет непосредственный контакт с физическим лекарственным средством, представленный классом "Произведенный продукт". Произведенные продукты описываются в терминах своих ингредиентов, что более детально обсуждается в 7.7.
Упакованное лекарственное средство может дополняться медицинским изделием. Им может быть устройство для применения лекарственного средства, например, оральный шприц. Такое устройство описывается классом "Медицинское изделие" (имеющим тип "Устройство для применения"). Если изделие является неотъемлемой часть упакованного лекарственного средства, например, предварительно заполненный шприц, то оно также описывается классом "Медицинское изделие" (имеющим тип "Интегрированное устройство"). Для классификации подобных изделий используются различные системы кодирования, которые могут быть представлены классом "Номенклатура изделий", а информация о серии может быть указана с помощью класса "Идентификатор серии". Производственные операции, связанные с медицинским изделием, могут быть указаны с помощью структур данных "Производитель/предприятие (Организация)", описанных в 7.5.
При необходимости может быть описано также пребывание на полке или хранение лекарственного средства или медицинского изделия.
Рисунок 13 - Высокоуровневое описание раздела упакованного лекарственного средства
|
Рисунок 13 - Высокоуровневое описание раздела упакованного лекарственного средства
Упакованная единица (в особенности внешняя упаковка), или составная часть упаковки, а также медицинское изделие и произведенный продукт могут иметь физические характеристики, включая при необходимости изображение упакованной единицы.
Кроме того, упакованное лекарственное средство, медицинское изделие и произведенный продукт могут иметь ряд других характеристик.
При необходимости с упакованным лекарственным средством можно связать идентификаторы серии, то есть BAID_1 и BAID_2.
В ряде случаев информация о регистрации специфична для упакованного лекарственного средства, например, когда юридический статус отпуска отдельных типов упаковок лекарственного средства отличается (например, упаковка из пяти таблеток не может быть указана в рецепте, а из 30 может). В этих случаях информация о регистрации может быть связана непосредственно с упакованным лекарственным средством, используя структуры, описанные в 7.3.
7.6.2 Детальное описание информации об упакованном лекарственном средстве
7.6.2.1 Упакованное лекарственное средство
7.6.2.1.1 Идентификатор PCID
Этот атрибут должен содержать идентификатор упакованного лекарственного средства, конструируемый в соответствии с правилами, изложенными выше в подразделе 6.3.
7.6.2.1.2 Описание упаковки
В этом атрибуте должно быть указано текстовое описание упакованного лекарственного средства.
Рисунок 14 - Детальное описание информации об упакованном лекарственном средстве
|
Рисунок 14 - Детальное описание информации об упакованном лекарственном средстве
7.6.2.2 Упакованная единица (контейнер)
Упакованная единица может быть неделимой или представлять собой упаковку, содержащую несколько других единиц. Эти единицы могут быть однотипными или разнотипными.
Для каждого вида упакованных единиц, входящих в состав упакованного лекарственного средства, должна быть описана хотя бы одна упакованная единица. Если в упакованное лекарственное средство входит несколько идентичных упакованных единиц, должно быть указано их количество.
Последующее более детальное описание ассоциированных классов должно быть связано только с отдельной единицей.
Если упакованная единица содержит другую упаковку, то для получения правильного представления должно быть описано вложение упаковок.
Примеры
1 Упакованное лекарственное средство, заключенное в единственную упаковку (например, пузырек с оральным раствором, внешняя коробка отсутствует), будет связано с одной упакованной единицей (которая в свою очередь связана с одним произведенным продуктом).
2 Упакованное лекарственное средство, имеющее внешнюю упаковку, в которую вложены внутренние упаковки (ящик, содержащий два блистерных рукава по 20 капсул или коробка с 4 флаконами раствора для инъекций), будет связано с двумя рекурсивными упакованными единицами: родительская упакованная единица, описывающая ящик или коробку, и дочерняя упакованная единица, описывающая блистерный рукав или флакон (последняя в свою очередь связана с произведенным продуктом).
3 Упакованное лекарственное средство, представляющее собой комплект из нескольких внутренних единиц разного типа, вложенных в общую внешнюю упаковку (например, ящик, содержащий тюбик с кремом и блистерный рукав с таблетками), будет связано с двумя рекурсивными упакованными единицами: родительская упакованная единица, описывающая ящик или коробку, и две дочерних упакованных единицы, описывающие соответственно тюбик и блистерный рукав (каждая из дочерних единиц в свою очередь связана с произведенным продуктом).
7.6.2.2.1 Тип упакованной единицы (контейнера)
В этом атрибуте должен быть указан тип упакованной единицы (контейнера), описывающий физический тип контейнера для лекарств в соответствии с ИСО 11239 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Ящик, флакон, блистерный рукав, предварительно заполненный шприц.
7.6.2.2.2 Количество упакованных единиц (контейнеров)
В этом атрибуте должно быть указано количество (или число штук) упакованных единиц.
Примечание - Поскольку класс "Упакованная единица" имеет рекурсивную связь, позволяющую описывать контейнеры внутри контейнера, то первый (самый внешний) контейнер обязательно должен иметь количество "1", что означает инициирование цепи поставок лекарственного средства.
7.6.2.2.3 Материал
В этом атрибуте должен быть описан материал (материалы) упаковки лекарственного средства в соответствии с ИСО 11239 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в этом словаре.
7.6.2.2.4 Альтернативный материал
В этом атрибуте должен быть описан альтернативный материал (материалы) упаковки лекарственного средства в соответствии с ИСО 11239 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примечание - Указание альтернативного материала используется, когда при производстве упаковки разрешено использовать альтернативные материалы (например, разные типы пластика для блистерного рукава).
7.6.2.3 Идентификатор в носителях данных
Идентификаторы в носителях данных, например, штрих-коды, могут присутствовать на каждом уровне упаковки. При необходимости идентификатор в носителях данных должен быть указан.
Примеры
1 Идентификатор в носителях данных для таблетки в блистерной ячейке (первичная упаковка).
2 Идентификатор в носителях данных для коробки с двумя блистерными рукавами (вторичная упаковка).
3 Идентификатор в носителях данных для групповой упаковки четырех коробок (третичная упаковка).
7.6.2.3.1 Система кодирования идентификаторов в носителях данных
В этом атрибуте должна быть указана система кодирования идентификаторов в носителях данных, используя подходящую систему идентификации систем кодирования.
7.6.2.3.2 Значение идентификатора в носителях данных
Этот атрибут должен содержать отдельное значение, взятое из системы кодирования идентификаторов и применимое к упакованному лекарственному средству.
Пример - Система кодирования идентификаторов в носителях данных: GTIN; значение идентификатора: 123459876511.
Информация о пребывании на полке и хранении упакованной единицы (контейнера) может быть описана с помощью класса "Пребывание на полке/хранение" (см. ниже 7.6.2.6).
Физические характеристики (высота, ширина, глубина, вес, форма и т.д.) упакованной единицы (контейнера) могут быть описаны с помощью класса "Физические характеристики" (см. 7.6.2.11). При необходимости они могут включать в себя одно или несколько изображений упакованной единицы (контейнера).
Другие характеристики упакованной единицы (контейнера) могут быть описаны с помощью класса "Другие характеристики" (см. 7.6.2.12).
7.6.2.4 Идентификатор серии
7.6.2.4.1 Идентификатор BAID_1
В этом атрибуте может быть указан идентификатор BAID_1, который наносится на внешнюю упаковку конкретной серии лекарственного средства (см. 6.4). В одном упакованном лекарственном средстве может быть несколько разных серий и указание идентификатора серии может требоваться не для всех типов упакованных лекарственных средств. Поэтому отношение между классом "Упакованное лекарственное средство" и "Идентификатор серии" имеет кратность 0...*. В случаях, когда упакованное лекарственное средство содержит более одного произведенного продукта и/или содержит медицинское изделие, в качестве идентификатора BAID_1 используется тот номер, что указан на самой внешней упаковке.
7.6.2.4.2 Идентификатор BAID_2
В этом атрибуте может быть указан идентификатор BAID_2, который наносится на первичную упаковку, не являющуюся внешней (см. 6.5).
7.6.2.5 Упаковка (компонент)
Любая часть упаковки упакованного лекарственного средства может быть описана с помощью класса "Упаковка (компонент)". Это описание может относиться к контейнеру в целом или к его части, например, к колпачку.
7.6.2.5.1 Тип компонента
В этом атрибуте должен быть указан тип компонента, чей материал подлежит описанию. Тип должен быть взят из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры - Крышка для защиты от детей, флакон, пробка.
7.6.2.5.2 Материал компонента
В этом атрибуте может быть указан материал (материалы) компонента. Материалы должны быть описаны в соответствии с ИСО 11238 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
7.6.2.5.3 Альтернативный материал компонента
В этом атрибуте могут быть указаны альтернативные материалы компонента. Материалы должны быть описаны в соответствии с ИСО 11238 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
Примечание - Указание альтернативного материала используется, когда при производстве упаковки разрешено использовать альтернативные материалы (например, разные типы резины для пробки).
Физические характеристики (высота, ширина, глубина, масса, форма и т.д.) упаковки (компонента) могут быть описаны с помощью класса "Физические характеристики" (см. 7.6.2.11). При необходимости они могут включать в себя одно или несколько изображений упаковки (компонента).
7.6.2.6 Пребывание на полке/хранение
Информация о пребывании на полке и хранении может быть описана с помощью класса "Пребывание на полке /хранение".
7.6.2.6.1 Тип пребывания на полке
Этот атрибут описывает информацию о типе пребывания на полке, принимая во внимание различные сценарии, например, пребывание на полке исходного упакованного лекарственного средства, пребывание после преобразования, если таковое было необходимо, после первого открытия пузырька и т.д. Эта информация должна быть выбрана из соответствующего контролируемого словаря. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
Примеры - После первого открытия, не открывавшегося, после преобразования.
Период пребывания на полке может быть указан с помощью числового значения длины периода времени и его единиц измерения. Единицы измерения должны быть указаны в соответствии с ИСО 11240 и результирующей терминологией. Должны использоваться символ единицы измерения и идентификатор этого символа.
Примеры - Три года в закрытом состоянии, 28 дней после открытия.
7.6.2.6.2 Особые предосторожности при хранении
Особые предосторожности при хранении, если таковые имеются, могут быть выбраны из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в нормативном словаре.
Пример - Не хранить при температуре выше 25°C или ниже 2°C, хранить в оригинальной упаковке, чтобы не подвергать действию света.
7.6.2.7 Медицинское изделие
Лекарственные средства могут быть зарегистрированы в сочетании с сопутствующими изделиями, информация о которых может быть описана с помощью класса "Медицинское изделие". Такие изделия могут быть разных типов (см. 7.6.2.7.1), например, могут быть отдельными устройствами применения, неотъемлемыми устройствами применения или компонентом лекарственного средства. Если лекарственное средство комбинируется с таким изделием и достигаемый фармакологический, иммунологический и метаболический эффект рассматривается как основной способ применения; медицинское изделие в этом случае считается компонентом лекарственного средства.
7.6.2.7.1 Тип изделия
В этом атрибуте должен быть указан тип изделия, взятый из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
Примеры - Устройство применения (например, вагинальный аппликатор, капельная пипетка), неотъемлемое устройство (например, предварительно заполненный шприц, аэрозольный ингалятор), медицинское изделие (например, подложка для клеточного лекарственного средства), другое устройство (например, различные помазки).
7.6.2.7.2 Торговое наименование изделия
В этом атрибуте может быть указано торговое наименование изделия, если таковое имеется, в форме текста.
7.6.2.7.3 Количество изделий
Этот атрибут содержит количество изделий в упаковке.
Примеры
1 Упаковка, содержащая пять стерильных помазков для обработки инъекционного поля: количество = 5.
2 Упаковка, содержащая ложку 5 мл для лекарства: количество = 1.
7.6.2.7.4 Артикул
В этом атрибуте может быть указан артикул устройства, если таковой имеется, в текстовой форме.
7.6.2.7.5 Номер модели
В этом атрибуте может быть указана модель устройства или ее номер, если таковые имеются, в текстовой форме.
7.6.2.7.6 Материал изделия
В этом атрибуте может быть указан материал (материалы) изделия. Материалы должны быть описаны в соответствии с ИСО 11238 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
7.6.2.7.7 Альтернативный материал изделия
В этом атрибуте может быть указан альтернативный материал (материалы) изделия. Материалы должны быть описаны в соответствии с ИСО 11238 и результирующей терминологией. Должны быть указаны сам термин и его идентификатор в контролируемом словаре.
Примечание - Указание альтернативного материала используется, когда при производстве упаковки разрешено использовать альтернативные материалы (например, разные типы пластика для ложки).
7.6.2.7.8 Признак аллергенности
При необходимости в этом атрибуте может быть указано, что изделие содержит аллергены или материалы, которые могут вызывать аллергию. Аллергены и/или материалы, которые могут вызывать аллергию, должны быть описаны в соответствии с ИСО 11238 и результирующей терминологией.