ГОСТ Р 52858-2007
Группа П46
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИМПЛАНТАТЫ ОФТАЛЬМОЛОГИЧЕСКИЕ ИНТРАОКУЛЯРНЫЕ ЛИНЗЫ
Часть 5
Биологическая совместимость
Ophthalmic implants. Intraocular lenses.
Part 5. Biocompatibility
ОКС 11.040.40
ОКП 94 4480
Дата введения 2009-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "ТКС-оптика" на основе собственного аутентичного перевода стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 296 "Оптика и оптические приборы"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 декабря 2007 г. N 504-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 11979-5:2006 "Имплантаты офтальмологические. Интраокулярные линзы. Часть 5. Биосовместимость" (ISO 11979-5:2006 "Ophthalmic implants - Intraocular lenses - Part 5: Biocompatibility") путем:
- изменения его структуры. Сравнение структуры настоящего стандарта со структурой указанного международного стандарта приведено в дополнительном приложении Н;
- введения дополнительных слов (фраз). При этом дополнительные слова (фразы), включенные в текст стандарта для учета потребностей национальной экономики Российской Федерации и/или особенностей российской национальной стандартизации, выделены курсивом.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в справочном приложении К
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на переднекамерные и заднекамерные интраокулярные линзы (далее - ИОЛ) независимо от материала, из которого они изготовлены, места локализации их в глазу пациента и их функционального назначения (протез хрусталика глаза или линза, предназначенная для коррекции афакии и аномалий рефракции).
Стандарт устанавливает требования к оценке биологической совместимости материалов для изготовления ИОЛ, а также методы физико-химических и биологических испытаний.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 10993-1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ Р ИСО 10993-3-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию
ГОСТ Р ИСО 10993-5-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro
ГОСТ Р ИСО 10993-6-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследование местного действия после имплантации
ГОСТ Р ИСО 10993-10-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия
ГОСТ Р ИСО 10993-12-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы
ГОСТ Р ИСО 14971-2006 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
ГОСТ Р 51892-2002 (ИСО 11979-1-99) Имплантаты офтальмологические. Интраокулярные линзы. Часть 1. Термины и определения
ГОСТ Р 52038-2003 (ИСО 11979-2-99) Имплантаты офтальмологические. Интраокулярные линзы. Часть 2. Оптические свойства и методы испытаний
ГОСТ Р 52039-2003 (ИСО 11979-3-99) Имплантаты офтальмологические. Интраокулярные линзы. Часть 3. Механические свойства и методы испытаний
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины, определения и сокращения
3.1 В настоящем стандарте применены термины по ГОСТ Р 51892 и следующие термины с соответствующими определениями:
3.1.1 испытание деградации материала (material degradation test): Испытание, которое определяет потенциал деградации материала.
3.1.2 растворитель (solvent): Вещество (химикат, наполнитель, среда), используемое для смачивания, разбавления, суспензирования, экстрагирования или растворения испытуемого материала.
3.1.3 контрольный раствор (reference solution): Растворитель, который оценивается одновременно со смоченным, разбавленным, суспензированным, экстрагированным или растворенным испытуемым материалом.
3.2 В настоящем стандарте применяют следующие сокращения:
Nd-YAG - аллюмо-иттриевый гранат, активированный неодимом;
In vivo - в естественных условиях;
In vitro - в лабораторных условиях;
УФ-излучение - ультрафиолетовое излучение;
ВЭЖХ - высокомолекулярный жидкостной хроматограф высокого давления;
ГХ - газовый хроматограф;
ГХ/МС - газовый хроматомасс-спектрометр;
СЭМ - сканирующий электронный микроскоп.
4 Общие требования к оценке биологической совместимости
4.1 Оценку биологической совместимости испытуемого материала следует начинать с первоначальной оценки риска в соответствии с ГОСТ Р ИСО 14971, проводя следующие действия:
1) рассматривают результаты физико-химических испытаний по разделу 5;
2) проводят оценку испытуемого материала на биологическую безопасность по ГОСТ Р ИСО 10993-1 и [1], учитывая результаты физико-химических испытаний по разделу 5.
4.2 Оценка риска включает в себя оценку потенциальной возможности изменения свойств испытуемого материала, например, затвердение, поэтому при оценке биологической совместимости необходимо изучить предысторию клинического использования материала и моделей животных для испытания стойкости материала.
4.3 При оценке биологической совместимости необходимо также провести оценку биологического действия материала по ГОСТ Р ИСО 10993-3, ГОСТ Р ИСО 10993-5, ГОСТ Р ИСО 10993-6, ГОСТ Р ИСО 10993-10 и по разделам 5-6 настоящего стандарта.
4.4 Все полученные результаты оценки по 4.1-4.3 необходимо объединить в общую оценку риска/пользы в соответствии с ГОСТ Р ИСО 14971.
5 Физико-химические испытания
5.1 Общие требования
5.1.1 К физико-химическим испытаниям относятся следующие испытания на:
а) полную экстракцию;
b) выщелачиваемые продукты;
c) гидролитическую стойкость;
d) фотостабильность (стойкость к УФ-/видимому излучению);
e) стойкость к воздействию излучения Nd-YAG лазера;
f) оценку нерастворимых неорганических веществ.
5.1.2 Целями испытаний по 5.1.1 являются:
а) определить количество низкомолекулярных веществ ИОЛ, способных при их эксплуатации в глазу выделяться в среду тканей глаза;
b) определить количество продуктов деструкции в результате гидролиза;
c) определить количество выщелачиваемых химических продуктов;
d) облегчить проведение анализа рисков, вызываемых токсичными продуктами, которые появляются в результате изготовления, при использовании и/или старении испытуемого материала.
Примечание - Под низкомолекулярными веществами понимают: остаточный мономер, различные роды добавок, используемых при синтезе мономера, а также возможные примеси, попадающие в полимер при изготовлении ИОЛ и их упаковке.
5.1.3 Результаты испытаний по 5.1.1 должны быть зарегистрированы испытателями и включены в оценку риска по ГОСТ Р ИСО 14971.
Если какое-либо испытание по 5.1.1 не было проведено, необходимо представить документальное обоснование, подтверждающее решение испытателя о непроведении этого испытания.
5.2 Испытание на полную экстракцию
5.2.1 Испытуемый материал должен быть проверен на экстрагируемые вещества в условиях полной экстракции по методу приложения А.
Данный метод содержит несколько условий экстракции, включая среды, температуру и длительность.
Допускается использовать альтернативные методы испытания при условии совпадения оценки результатов.
5.2.2 При испытании необходимо соблюдать следующие условия:
a) причины, по которым был выбран каждый растворитель, должны быть обоснованы и документально оформлены;
b) среды для экстракции должны быть проанализированы в качественном и количественном отношении в конце экстракции на возможные экстрагируемые компоненты материала. Например, загрязняющие вещества процесса, остаточные мономеры, добавки и другие компоненты. Уровень обнаружения экстрагируемых веществ должен быть установлен на основании оценки риска суммарного воздействия на пациента и должен быть выражен в мкг/г материала;
c) испытуемый материал необходимо взвесить до и после экстракции. Любое изменение массы должно быть зафиксировано.
5.2.3 Результаты испытаний должны быть зарегистрированы для последующей оценки риска на потенциально вредные воздействия экстрагируемых материалов.
5.3 Испытание на выщелачиваемые вещества
5.3.1 Испытуемый материал должен быть проверен на выщелачиваемые вещества в имитированных физиологических условиях по методу приложения Б.
Данный метод содержит несколько условий экстракции, включая среды, температуру и длительность.
5.3.2 При испытании необходимо соблюдать условия 5.2.2 и требования 5.2.3.
5.4 Испытание на гидролитическую стойкость
5.4.1 Испытание на гидролитическую стойкость необходимо проводить по методу приложения В.
5.4.2 При испытании необходимо соблюдать следующие условия:
a) оценить стойкость материала в водной среде при температуре (35±2) °С в течение пяти лет или при повышенной температуре в течение имитированного времени воздействия также в течение пяти лет;
b) имитированное время воздействия необходимо определить путем умножения действительного времени исследования на коэффициент , рассчитываемый по формуле
![]() , (1)
, (1)
где - повышенная температура, °С;
- температура внутри глаза, равная 35 °С;
c) проанализировать воздействующую среду в качественном и количественном отношении на наличие химических веществ в конце периода воздействия;
d) провести исследование испытуемого материала до и после испытания:
- с помощью светового микроскопа при увеличении 10 и выше;
- с помощью растрового микроскопа при увеличении 500 и выше.
Испытуемый материал необходимо сравнить с материалом, который не подвергался воздействию водной среды. При сравнении во внешнем виде поверхностей испытуемого материала не должно быть пузырьков, дендритов, разрывов и трещин;
e) зарегистрировать коэффициенты спектрального пропускания испытуемого материала в УФ и видимой областях спектра до и после испытания. Путем сопоставления спектров убедиться в том, что коэффициент спектрального пропускания существенно не изменился. В случае использования при испытании готовых ИОЛ определить оптическую силу ИОЛ до и после испытания. В случае использования исходного материала необходимо определить показатель преломления материала. Оптическая сила ИОЛ или показатель преломления исходного материала до и после испытания не должны существенно различаться (±0,25 дптр - для ИОЛ с оптической силой равной 20 дптр).
5.4.3 Результаты испытания должны быть зарегистрированы для последующей оценки риска на потенциально вредные воздействия из-за нестабильности материала в водной среде.
5.5 Испытание на фотостабильность
5.5.1 Испытание на фотостабильность проводят по методу приложения Г.
5.5.2 При проведении испытания переднекамерных ИОЛ на стойкость к УФ- и видимому излучению необходимо подтвердить, что механические свойства испытуемого материала, подвергнутого УФ-излучению, идентичны механическим свойствам не подвергаемого УФ-излучению испытуемого материала.
5.5.3 Спектральные диапазоны испытуемого материала, подвергаемого действию УФ- и видимого излучения, и контрольных материалов, не подвергаемых действию излучения, должны быть идентичными.
Примечания
1 Переднекамерные ИОЛ, подвергнутые излучению, должны быть испытаны на механические свойства по ГОСТ Р 52039.
2 Установлено, что при испытании ИОЛ действию УФ-излучения допустимы следующие параметры:
a) интенсивность излучения УФ-А in vivo в диапазоне длин волн от 300 до 400 нм при освещении ИОЛ диффузным светом 0,3 мВт/см
.
Принятая в международном масштабе оценка полной интенсивности солнечного света составляет среднее от 1 кВт/м =100 мВт/см
в солнечных регионах, близких к экватору. Часть длин волн излучения близкого к УФ в диапазоне от 300 до 400 нм составляет приблизительно 6,5% от суммарной интенсивности, т.е. около 6,5 мВт/см
. ИОЛ подвергаются действию солнечных лучей, которые достигают участков позади роговицы и внутриглазной жидкости. В пределах солнечного спектра та часть излучения, близкого к УФ-излучению, которая не поглощается роговицей и внутриглазной жидкостью и которая может потенциально разрушить ИОЛ посредством фотохимической деструкции, составляет приблизительно от 40% до 50% суммарного УФ-А излучения. Предположив, что роговица и внутриглазная жидкость поглощают 50% УФ-А излучения, ИОЛ подвергаются действию излучения в 3,25 мВт/см
в диапазоне от 300 до 400 нм при полной интенсивности солнечного света. Считается, что интенсивность диффузно отраженного света составляет одну десятую вышеуказанного значения. Следовательно, интенсивность облучения ИОЛ in vivo составляет приблизительно 0,3 мВт/см
;
b) ежедневная продолжительность облучения солнечным светом t составляет 3 ч;
c) продолжительность воздействия in vivo 20 лет;
d) коэффициент интенсивности 1 (т.е., максимальная интенсивность, если иметь в виду солнечные регионы).
Продолжительность испытаний in vitro , в днях, можно рассчитать по формуле
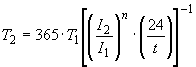 , (2)
, (2)
где - интенсивность источника излучения in vitro в диапазоне длин волн от 300 до 400 нм [2].
Пример - Если 10 мВт/см
,
27,4 дня.
5.5.4 Результаты испытания должны быть зарегистрированы для последующей оценки риска на потенциально вредные воздействия из-за продуктов деструкции, обнаруженных при проведении испытания.
5.6 Испытание на воздействие излучения Nd-YAG лазера
5.6.1 Испытание на воздействие излучения Nd-YAG лазера на испытуемый материал проводят методом по приложению Д.
5.6.2 При воздействии излучения лазера не должны выделяться цитотоксические вещества.
5.7 Оценка нерастворимых неорганических веществ
5.7.1 Материал для изготовления ИОЛ должен быть оценен на наличие остаточного содержания нерастворимых неорганических веществ на поверхности и внутри ИОЛ, появляющихся при изготовлении материала или внесении технологических добавок. Если остаточное содержание нерастворимых неорганических веществ идентифицировано, ИОЛ следует оценивать в отношении таких остаточных веществ. Методы испытания, используемые для проведения такой оценки, должны быть идентифицированы, оценены и обоснованы. Следует применять методы с пределом обнаружения 0,2 мкг/г (внутри ИОЛ) или 10 мкг/г (на поверхности ИОЛ с растворителем).
5.7.2 Результаты оценки должны быть зарегистрированы для последующей оценки риска на потенциально вредные воздействия остаточных нерастворимых неорганических веществ на поверхности и внутри ИОЛ.
6 Биологические испытания
6.1 Общие положения
6.1.1 Оценка биологической безопасности должна быть проведена в соответствии с требованиями ГОСТ Р ИСО 10993-1 с учетом результатов физико-химических испытаний по разделу 5. Необходимо учитывать следующие основные моменты:
- воздействие на рост клеток и разрушение клеток;
- генотоксичность;
- местное действие после имплантации;
- потенциал сенсибилизации.
6.1.2 Если установлено что проводить испытание необходимо, применяют ГОСТ Р ИСО 10993-3, ГОСТ Р ИСО 10993-6, ГОСТ Р ИСО 10993-10 с дополнительными испытаниями по 6.2-6.3 стандарта.
6.1.3 Подготовку образца следует проводить в соответствии с ГОСТ Р ИСО 10993-12 с учетом дополнительного испытания по 6.4 настоящего стандарта.
6.1.4 Если в результате проведения оценки риска идентифицирована in vivo возможность изменения свойства материала под воздействием окружающей среды, необходимо провести испытание, чтобы оценить обратную толерантность испытуемого материала и местной ткани. Примером такого испытания является испытание на местное действие материала после имплантации по ГОСТ Р ИСО 10993-6 с дополнительными условиями по приложению Е.
Примечание - Так как масса ИОЛ обычно составляет только около 20 мг, то испытание на систематическую или хроническую токсичность проводить не требуется.
6.2 Испытание на генотоксичность
6.2.1 Испытание на генотоксичность следует проводить в соответствии с ГОСТ Р ИСО 10993-3 с дополнениями, изложенными в настоящем подразделе.
6.2.2 Следует приготовить две отдельные вытяжки из испытуемого материала с экстрагирующими веществами: физиологическим раствором, масляным или полярным растворителем. Масляный или полярный растворитель не должен растворять или разрушать материал.
6.2.3 Вытяжку следует приготовить перемешиванием 1 г материала на 10 мл экстрагирующего вещества при температуре (37±2) °С в течение (72±2) ч.
6.3 Испытание на сенсибилизацию
6.3.1 Испытание на сенсибилизацию должно быть проведено в соответствии с ГОСТ Р ИСО 10993-10 с дополнениями, изложенными в настоящем подразделе.
6.3.2 Для проведения испытания можно использовать либо метод максимального сенсибилизирующего воздействия, либо местную пробу лимфатического узла.
6.3.3 Вытяжку из испытуемого материала готовят с добавлением экстрагирующих растворителей, одним из которых является физиологический раствор, а другим - масляный или полярный растворитель. Масляный или полярный растворитель не должен растворять или разрушать испытуемый материал. Растворитель не должен иметь раздражающего или сенсибилизирующего действия.
6.4 Испытание имплантацией внутрь глаза
6.4.1 Испытание имплантацией внутрь глаза должно проводиться в том случае, если у изготовителя нет документального подтверждения о безопасности материала во внутриглазной среде.
6.4.2 Испытание следует проводить в соответствии с ГОСТ Р ИСО 10993-6 с дополнениями по приложению Ж.
6.4.3 Если установлено, что проводить это испытание необязательно, оценка риска должна содержать обоснованную гарантию в том, что риски, возникающие в результате нового использования материала, считаются приемлемыми на основании информации о предыдущем клиническом использовании и/или на основании других источников данных.
Приложение А
(обязательное)
Метод испытания на полную экстракцию
А.1 Общие положения
А.1.1 Целью данного испытания является обнаружение и количественное определение добавок и других выщелачиваемых веществ, экстрагируемых из испытуемого материала в условиях полной экстракции.
А.1.2 При испытании следует применять аналитические методы, использование которых оправдано с точки зрения хорошей обоснованности и обладающих достаточной чувствительностью для обнаружения значительных концентраций.
А.1.3 В приведенном методе экстракции применяют аппарат Сокслета.
А.1.4 При выборе растворителя особое внимание следует уделить способности растворителя вызывать набухание материала, чтобы выполнить экстракцию без разрушения полимерной структуры или без растворения материала, а также растворимости потенциального остаточного содержания мономеров в растворителе, чтобы достигнуть полной экстракции.
А.1.5 Для экстракции следует использовать водный раствор или органический растворитель. Для экстракции некоторых материалов, например, гидрогелевых ИОЛ, могут потребоваться и водная экстракция, и экстракция органическим растворителем, чтобы обеспечить экстракцию гидрофильных (солей) и гидрофобных (мономеров, УФ- поглотителей и т.д.) компонентов.
А.1.6 Материал, экстрагируемый из ИОЛ, должен быть исследован с помощью ГХ, спектрофотометра и ВЭЖХ, чтобы идентифицировать остаточное содержание мономеров, веществ, вызывающих образование межмолекулярных связей, катализаторов и т.д., используемых в процессе изготовления.
Метод можно использовать, когда растворитель вызывает набухание материала, достаточное, чтобы гарантировать полную экстракцию.
А.2 Требования к испытуемым образцам
А.2.1 Вес стерильных готовых ИОЛ должен быть не менее 200 мг.
А.З Требования к вспомогательным элементам (реактивам)
А.3.1 Вода, дистиллированная или деионизированная.
А.3.2 Органический растворитель, аналитической чистоты или более чистый.
А.3.3 Нагревательные камни или гранулы, предотвращающие пульсирующее кипение.
А.3.4 Активный десикант (влагопоглотитель).
А.4 Требования к средствам испытания
А.4.1 Экстракционный аппарат Сокслета, состоящий из конденсора, колбы с круглым дном и нагревательной оболочкой со стеклянными компонентами, изготовленными из стандартного боросиликатного лабораторного стекла.
А.4.2 Экстракционный патрон с пробкой из стекловаты или другим запорным элементом. Экстракционный патрон может быть изготовлен из перфорированной нержавеющей стали, спеченного стекла и т.п.
А.4.3 Вакуумная печь или другой сушильный аппарат.
А.4.4 Аналитические весы, с точностью до 0,1 мг и/или выше.
А.4.5 ВЭЖХ.
А.4.6 ГХ.
А.4.7 ГХ/МС.
А.4.8 Роторный испаритель.
А.4.9 Приведенные по А.4.2-А.4.8 средства испытания являются рекомендуемыми. Допускается применять другие средства испытания.
Примечание - При использовании летучего или горючего растворителя средства испытания следует установить в вытяжной шкаф.
А.5 Порядок проведения испытания
А.5.1 Сушат ИОЛ до получения постоянной массы в сушильном аппарате при температуре (60±5) °С. Охлаждают ИОЛ до комнатной температуры в сушильном аппарате перед взвешиванием. Если ИОЛ гигроскопичны, перекладывают их из сушильного аппарата в активный десикант и охлаждают.
А.5.2 Взвешивают высушенные ИОЛ с точностью до 0,1 мг.
А.5.3 Помещают ИОЛ в экстракционный патрон, нагревательные камни - в колбу аппарата, если необходимо, и вливают в колбу соответствующий растворитель до 70% ее объема.
А.5.4 Устанавливают экстракционный патрон в аппарат Сокслета и монтируют колбу, аппарат Сокслета и конденсор. Ставят колбу в нагревательную оболочку.
А.5.5 В течение часа 4-6 раз наполняют растворителем, сливают растворитель из патрона и проводят экстракцию ИОЛ в течение четырех часов.
А.5.6 Оборачивают экстракционный аппарат фольгой, чтобы получить желаемую скорость экстракции при использовании таких растворителей, как вода.
А.5.7 Дают растворителю остыть до комнатной температуры.
А.6 Правила анализа испытуемых образцов
А.6.1 Вынимают ИОЛ из экстракционного патрона.
А.6.2 Сушат ИОЛ до получения постоянной массы по А.5.1.
А.6.3 Определяют общую массу ИОЛ после экстракции и вычисляют изменение массы.
А.6.4 В случае, если ИОЛ поставляют на рынок в гидратированном состоянии, следует скорректировать содержание соли в гидратирующей среде путем добавления соли в экстрагируемый материал.
Принято гидратировать и поставлять гидрогелевые ИОЛ в растворе, содержащем неорганические соли. Чтобы точно определить действие содержания соли на вычисляемые результаты, необходимо знать или измерить содержание воды в ИОЛ в соответствии с [3]. ИОЛ можно привести в равновесие при двух изменениях содержания воды в течение 24 ч при комнатной температуре перед проведением испытания.
А.7 Правила анализа вытяжек
А.7.1 Удаляют среду для экстракции из аппарата Сокслета и дают прийти в равновесие при комнатной температуре.
А.7.2 Концентрируют вытяжку до 10 мл посредством роторного испарителя.
А.7.3 Проводят качественный и количественный анализы выщелачиваемых веществ, таких как УФ-поглотители, добавки, продукты деструкции и другие примеси, образующиеся при изготовлении с применением ВЭЖХ, ГХ, ГХ/МС.
А.7.4 Проводят качественный и количественный анализы растворителей, которые прошли ту же процедуру экстрагирования.
А.7.5 Сравнивают результаты качественного и количественного анализов вытяжек испытуемого материала с вытяжками растворителя и документируют полученные данные в контексте возможных изменений материала.
А.8 Правила оформления результатов испытания
А.8.1 Отчет об испытании должен содержать следующую информацию:
- все данные, необходимые для идентификации испытуемого образца;
- ссылку на настоящий стандарт;
- среду для экстракции;
- результаты испытания;
- любые отклонения от приведенного метода;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату экстрагирования и дату проведения анализов по А.6 и А.7.
Приложение Б
(обязательное)
Метод испытания на выщелачиваемые вещества
Б.1 Общие положения
Б.1.1 Испытание предназначено для определения количества экстрагируемых примесей и других выщелачиваемых продуктов из материала для ИОЛ в физиологических условиях.
Б.1.2 Следует выбрать аналитические методы, использование которых оправдано с точки зрения хорошей обоснованности проверки и достаточной чувствительности для обнаружения значимых концентраций.
Б.2 Требования к испытуемым образцам
Б.2.1 Используют стерильные готовые ИОЛ или материал типичного образца весом не более 4 г.
Б.3 Требования к контрольному материалу
Б.3.1 Для проведения сравнения с экстрактами испытуемого материала используют растворитель, который прошел процедуры экстракции по Б.5.1.
Б.4 Требования к средствам испытания
Б.4.1 Стеклянные пробирки гидролитического класса 1 в соответствии с ГОСТ Р ИСО 10993.12.
Б.4.2 Лабораторная стеклопосуда.
Б.4.3 Шприцы.
Б.4.4 Аналитические весы.
Б.4.5 Шейкер.
Б.4.6 Термостат.
Б.4.7 Центрифуга.
Б.4.8 ВЭЖХ.
Б.4.9 ГХ.
Б.4.10 УФ-спектрофотометр, спектрофотометр видимого излучения.
Б.4.11 Приведенный перечень средств испытаний является рекомендуемым. Допускается использовать другие средства испытания.
Б.5 Порядок проведения испытания
Б.5.1 Правила процедуры экстракции
Б.5.1.1 Выбирают две различные среды для экстракции: одну - водную, другую - из олеофильного растворителя, подходящего для испытуемого материала.
Б.5.1.2 Разделяют испытуемый материал на две равные части для обработки в термостате в двух средах. Определяют массу каждой части.
Б.5.1.3 Помещают испытуемый материал в стеклянные пробирки, в которых содержатся среды для экстракции в соотношении 10 г испытуемого материала на 100 мл среды. Используют по две пробирки для каждой среды. Встряхивают пробирки, убеждаются, что все поверхности испытуемого материала готовы к экстракции в течение всего периода времени.
Б.5.1.4 Экстрагируют испытуемый материал в термостате при температуре (35±2) °С в течение (72±1) ч.
Б.5.2 Правила анализа экстрактов
Б.5.2.1 Вынимают пробирки из термостата и оставляют при комнатной температуре на (2,00±0,25) ч. Вынимают испытуемый материал из пробирок и проводят анализ по Б.5.3.
Б.5.2.2 Проводят качественный и количественный анализы на наличие выщелачиваемых веществ, таких как УФ-поглотители, примеси и продукты распада с применением аппаратуры по А.4.7 и/или Б.4.8, Б.4.9.
Б.5.2.3 Анализируют экстракты отдельно в каждой пробирке.
Б.5.2.4 Проводят соответствующие качественный и количественный анализы на растворителях, которые подверглись той же операции.
Б.5.2.5 Сравнивают результаты качественного и количественного анализов экстрактов испытуемого материала с экстрактами растворителя и документируют полученные данные в контексте возможного изменения материала.
Б.5.3 Правила анализа испытуемого материала
Б.5.3.1 Берут произвольно пять фрагментов испытуемого материала из каждого условия экстракции и определяют их спектральный коэффициент пропускания по ГОСТ Р 52038.
Б.5.3.2 Сравнивают спектральный коэффициент пропускания экстрагированного материала со спектральным коэффициентом неэкстрагированного материала и регистрируют изменения.
Б.6 Правила оформления результатов испытания
Б.6.1 Отчет об испытании должен содержать следующую информацию:
- все данные, необходимые для идентификации испытуемого образца;
- ссылку на настоящий стандарт;
- среду для экстракции;
- результаты испытания;
- любые отклонения от приведенного метода испытаний;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату по проведению процедуры экстракции и даты анализов по Б.5.2 и Б.5.3.
Приложение В
(обязательное)
Метод испытания на гидролитическую стойкость
В.1 Общие положения
В.1.1 Данное испытание предназначено для определения стойкости материала ИОЛ в водной среде путем обнаружения и определения количества возможных продуктов деструкции, возникающих при гидролизе, и изменений физического внешнего вида, оптических свойств и хроматографических характеристик.
В.1.2 Следует выбирать аналитические методы, использование которых оправдано с точки зрения хорошей обоснованности и достаточной чувствительности для обнаружения значимых концентраций.
В.2 Требования к испытуемым образцам
В.2.1 Используют стерильные готовые ИОЛ или материал типичного образца. Требуется не менее 15 фрагментов испытуемого материала для каждой комбинации температуры и длительности гидролиза.
В.3 Требования к контрольному материалу
В.3.1 Заготовки растворителя, которые прошли экстракцию по В.5.1, используют в качестве контрольного материала при сравнении с растворителем, используемым при испытании.
В.4 Требования к средствам испытания
В.4.1 Гидролизная среда в термостате (водный растворитель).
В.4.2 Стеклянные пробирки гидролитического класса 1 в соответствии с ГОСТ Р ИСО 10993.12.
В.4.3 Лабораторная стеклянная посуда.
В.4.4 Шприцы.
В.4.5 Аналитические весы.
В.4.6 Шейкер.
В.4.7 Термостат.
В.4.8 Центрифуга.
В.4.9 ВЭЖХ.
В.4.10 ГХ.
В.4.11 Спектрофотометр для УФ-излучения и видимого излучения.
В.4.12 Оптический микроскоп.
В.4.13 Сканирующий электронный микроскоп (СЭМ).
В.4.14 Приведенный перечень средств испытания является рекомендуемым. Допускается использовать другие средства испытания.
В.5 Порядок проведения испытания
В.5.1 Правила процедуры экстракции
В.5.1.1 Помещают испытуемый материал в стеклянные пробирки, в которых содержится водная среда в соотношении 10 г испытуемого материала на 100 мл среды.
В.5.1.2 Выдерживают в термостате при температуре, подходящей для испытуемого материала, например: (37±2) °С и (50±2) °С.
В.5.1.3 Используют по две пробирки для каждой комбинации температуры и длительности испытания, например: (30±2) дней и (90±2) дней,
В.5.1.4 Встряхивают пробирки, убеждаются, что все поверхности испытуемого материала доступны к экстракции в течение всего периода испытания.
В.5.2 Правила анализа растворителя после экстракции в термостате
В.5.2.1 Удаляют пробирки из термостата и оставляют при комнатной температуре на (2,00±0,25) ч.
В.5.2.2 Вынимают испытуемый материал из растворителя и исследуют его по В.5.3.
В.5.2.3 Проводят качественный и количественный анализы поверхностного слоя растворителя с применением средств испытаний ВЭЖХ, ГХ или СЭМ, установленных в плане испытания.
В.5.2.4 Верхний слой растворителя следует анализировать отдельно из каждой пробирки.
В.5.2.5 Проводят соответствующие качественный и количественный анализы на наличие контрольных растворителей, которые подверглись той же процедуре выдерживания в термостате.
В.5.2.6 Сравнивают результаты качественного и количественного анализа среды в термостате с результатами качественного и количественного анализа растворителя и документируют полученные данные в контексте возможных изменений материала.
Примечание - Если экстракцию проводят при повышенной температуре, необходимо сделать анализ, чтобы оценить действие, оказываемое температурой.
В.5.3 Правила анализа испытуемого материала
В.5.3.1 После выдерживания в термостате промывают и обсушивают испытуемый материал.
В.5.3.2 Берут произвольно пять фрагментов испытуемого материала из каждого условия экстракции и определяют их спектральный коэффициент пропускания по ГОСТ Р 52038. Сравнивают спектры пропускания испытуемых материалов со спектрами пропускания контрольных образцов и регистрируют изменения.
В.5.3.3 Берут произвольно ИОЛ и определяют оптическую силу по ГОСТ Р 52038. Если используют для испытания материал типового образца, следует определить показатель преломления на пяти образцах с применением оценочного метода. Сравнивают оптическую силу или показатель преломления испытуемого материала с оптической силой или показателем преломления контрольного материала и регистрируют изменения.
В.5.3.4 Осматривают и фотографируют испытуемый и контрольный материалы с помощью оптического микроскопа с увеличением 10, а затем с помощью растрового электронного микроскопа с увеличением 500
. Если необходимо, высушивают испытуемый материал перед проведением фотографии, чтобы провести сравнение с контрольным материалом.
В.5.3.5 Сравнивают результаты наблюдения и фотографии испытуемого и контрольного материалов, чтобы обнаружить какие-либо изменения внешнего вида, например, пузыри, сколы, складки и трещины.
Примечание - Если экстракцию проводят при повышенной температуре, необходимо провести анализ, чтобы оценить действие, оказываемое температурой.
В.6 Правила оформления результатов испытания
В.6.1 Отчет об испытании должен содержать следующую информацию:
- данные, необходимые для идентификации испытуемого образца;
- ссылку на настоящий стандарт;
- температуру и длительность гидролиза;
- результаты испытания, включая результаты отдельных определений и их средства, если они проводились;
- любые отклонения от приведенного метода испытания;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату воздействия гидролизной средой и дату проведения анализов по В.5.2, В.5.3.
Приложение Г
(обязательное)
Метод испытания на фотостабильность
Г.1 Общие положения
Г.1.1 Данное испытание предназначено для определения фотостабильности материала ИОЛ (светостойкости) при воздействии излучения в диапазоне длин волн от 300 до 400 нм.
Г.2 Требования к испытуемым образцам
Г.2.1 Десять готовых ИОЛ или 10 фрагментов материала типового образца толщиной, равной толщине готовой ИОЛ.
Г.З Требования к контрольному материалу
Г.3.1 Десять готовых ИОЛ или 10 фрагментов типового материала ИОЛ, толщиной, равной толщине ИОЛ, которая не подвергается действию УФ-излучения.
Г.4 Требования к среде для экстракции
Г.4.1 В качестве среды для экстракции используют физиологический раствор.
Г.5 Требования к средствам испытания
Г.5.1 Пробирка вместимостью 5 мл, прозрачная для излучения длиной волны от 300 до 800 нм, химически инертная и стойкая. Например, пробирка, изготовленная из гидролитического стекла класса 1 в соответствии с ГОСТ Р ИСО 10993.12.
Г.5.2 Ксеноновая дуговая лампа, снабженная фильтром, исключающим излучение длиной волны менее 300 нм.
Г.6 Порядок проведения испытания
Г.6.1 Погружают испытуемый материал в пробирку, содержащую 2 мл физиологического раствора. Подвергают пробирку действию излучением ксеноновой дуговой лампы в течение периода времени, установленного в 5.5.3, примечание 2, при этом необходимо, чтобы температура испытуемого материала в пробирке поддерживалась на уровне (35±2) °С.
Г.6.2 Интенсивность источника излучения должна быть не более 30 мВт/см, чтобы не вызвать избыточную фотодеградацию материала.
Примечание - При вычислении интенсивности УФ-излучения используют только интенсивность ксеноновой дуговой лампы при длине волны от 300 до 400 нм.
Г.6.3 Следует принять меры, предотвращающие микробное загрязнение для устранения роста микроорганизмов в пробирках в течение периода действия излучения.
Г.6.4 Подвергают такой же процедуре контрольный материал, гарантируя, что материал защищен от излучения.
Г.7 Правила оценки результатов испытания
Г.7.1 По завершении рассчитанного времени действия излучением ксеноновой лампы следует исследовать раствор на наличие блуждающих компонентов и провести цитотоксическое испытание по ГОСТ Р ИСО 10993-5.
Г.7.2 Определяют спектры поглощения в УФ- и видимой области излучения по ГОСТ Р 52038 пяти подвергнутых излучению и пяти не подвергнутых излучению образцов. Исследуют спектры на наличие различий и регистрируют изменения, появившиеся в результате воздействия УФ-излучения. Измеряют оптическую силу и разрешающую способность ИОЛ.
Г.7.3 Для переднекамерных ИОЛ определяют механические свойства по ГОСТ Р 52039 не менее, чем на пяти подвергнутых УФ-излучению образцов. Сопоставляют результаты с полученными результатами не подвергнутых излучению ИОЛ, чтобы убедиться, что не произошло существенного ухудшения их механических свойств.
Г.8 Правила оформления результатов испытания
Г.8.1 Отчет об испытании должен содержать следующую информацию:
- все данные, необходимые для идентификации испытуемого образца;
- ссылку на настоящий стандарт;
- используемую интенсивность источника излучения;
- длительность воздействия излучением;
- результаты испытания, включая результаты отдельных определений и их средства (если они проводились);
- любые отклонения от приведенного метода;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату воздействия излучением и даты проведения последующих анализов.
Приложение Д
(обязательное)
Метод испытания на воздействие излучения Nd-YAG лазера
Д.1 Общие положения
Д.1.1 Данное испытание предназначено для определения физического и химического действия, оказываемого излучением Nd-YAG лазера на испытуемый материал, для гарантии того, что при применении лазера Nd-YAG в процессе имплантации ИОЛ не происходит утечка токсичных веществ.
Д.2 Требования к испытуемым образцам
Д.2.1 Пять стерильных готовых ИОЛ.
Д.3 Требования к среде для экстракции
Д.3.1 В качестве среды для экстракции используют физиологический раствор.
Д.4 Требования к средствам испытания
Д.4.1 Оптическая кювета вместимостью 2 мл.
Д.4.2 Nd-YAG лазер, установленный на микроскопе со щелевой лампой.
Д.5 Порядок проведения испытания
Д.5.1 Погружают ИОЛ в оптическую кювету, содержащую 2 мл физиологического раствора, и подвергают действию 50 одиночных импульсов Nd-YAG лазера, энергия излучения которого - 5 мДж.
Д.5.2 Фокусируют излучение Nd-YAG лазера на заднюю поверхность ИОЛ. Перефокусируют лазер после каждого импульса, равномерно распределяя лучи воздействия в пределах 3 мм центральной зоны ИОЛ.
Д.5.3 Удаляют ИОЛ из кюветы и собирают среду для экстракции для проведения анализа. Повторяют процедуру для других ИОЛ.
Д.6 Правила оценки результатов испытания
Д.6.1 Проводят химический анализ и испытание на цитотоксичность среды для экстракции ИОЛ по ГОСТ Р ИСО 10993-5.
Д.6.2 Испытывают среду для экстракции на цитотоксичность после воздействия излучением лазера Nd-YAG по ГОСТ Р ИСО 10993-5.
Д.7 Правила оформления результатов испытания
Д.7.1 Отчет об испытании должен содержать следующую информацию:
- все данные, необходимые для идентификации испытуемого образца;
- ссылку на настоящий стандарт;
- энергию излучения лазера;
- результаты испытания, включая результаты отдельных определений и их средства (если проводились);
- любые отклонения от приведенного метода;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату проведения испытания и даты проведения последующих анализов.
Приложение Е
(рекомендуемое)
Дополнительные условия испытания на местное действие
материала после имплантации к ГОСТ Р 10993-6
Е.1 Требования к условиям испытания
Е.1.1 Испытание на местное действие материала после имплантации проводят по ГОСТ Р 10993-6 с дополнительными требованиями к условиям испытания по Е.1.2-Е.1.5 настоящего приложения.
Е.1.2 Испытуемый материал имплантируют подкожно или внутримышечно.
Е.1.3 Испытуемым материалом являются готовые ИОЛ толщиной в центральной зоне от 0,8 до 1,0 мм или пластинки из типичного материала ИОЛ, размер которых позволяет произвести необходимые оценки после изъятия.
Е.1.4 Длительность имплантации составляет четыре недели.
Е.1.5 Испытуемый материал вынимают в конце периода имплантации и оценивают в отношении изменений свойств материала и его целостности. Материал оценивают с помощью оптического микроскопа при соответствующем увеличении, позволяющем оценить помутнения и поверхностные аномалии. Половину образцов последовательно оценивают с помощью СЭМ при соответствующем увеличении в отношении изменений поверхности или с помощью СЭМ для оценки поверхностных налетов. Оптический микроскоп применяют, если испытуемый материал не подходит для исследования с помощью СЭМ.
Е.2 Правила оформления результатов испытания
Е.2.1 Отчет об испытании должен содержать следующую информацию:
- все данные, необходимые для идентификации испытуемого образца;
- ссылку на ГОСТ Р 10993-6 и настоящий стандарт;
- модель животного;
- метод имплантации подкожно или внутримышечно;
- результаты испытания, включая результаты отдельных определений и их средства, если проводились;
- любые отклонения от условий испытания метода;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату исследования и даты проведения последующих анализов.
Приложение Ж
(обязательное)
Метод испытания имплантацией внутрь глаза
Ж.1 Общие положения
Ж.1.1 Испытание предназначено для оценки биологической совместимости испытуемого материала и ткани внутри глаза путем хирургической имплантации материала в глаз модели животного в течение соответствующего периода времени. Оценивают обратную толерантность испытуемого материала и тканей глаза после имплантации.
Ж.2 Требования к испытуемым образцам
Ж.2.1 Испытуемым образцом является стерильная готовая ИОЛ. Материал типового образца может быть имплантирован, если его применение обосновано.
Ж.2.2 Соблюдают те же методы изготовления, которые предусмотрены для ИОЛ, поставляемых на рынок. Материал типового образца имеет массу, равную массе готовой ИОЛ или больше, а форма и размер позволяют провести необходимые оценки после извлечения ИОЛ.
Примечание - Чтобы предусмотреть размерные различия между глазами человека и животного, может потребоваться индивидуальный заказ на изготовление ИОЛ для анатомической совместимости с глазом животного, либо использовать для имплантации фрагмент ИОЛ, включающий в себя оптическую и гаптическую части.
Ж.3 Требования к контрольному материалу
Ж.3.1 Контрольным материалом является стерильная готовая ИОЛ, конструкция которой подобна конструкции ИОЛ, широко реализуемых на рынке в течение пяти лет и не связанных с неблагоприятными событиями в отношении материала.
Ж.3.2 Материал типового образца может быть использован, если его применение обосновано. Материал типового образца должен иметь массу, равную массе готовой ИОЛ или больше, а форма и размер должны позволять провести необходимые оценки после извлечения. Для оценки совместимости контрольная ИОЛ может быть непригодной в силу кратковременного клинического использования. Требование к использованию контрольного материала определяют в зависимости от конкретного случая и обосновывают.
Ж.4 Требования к средствам испытания
Ж.4.1 Физиологический раствор поваренной соли или сбалансированный солевой раствор.
Ж.4.2 Анестезирующее средство.
Ж.4.3 Лекарственные средства для пред- и послеоперационного лечения.
Ж.4.4 Операционный микроскоп.
Ж.4.5 Микроскоп со щелевой лампой.
Ж.4.6 Прибор для обратной офтальмоскопии.
Ж.4.7 Блок факоэмульсификации (эмульсификационный блок).
Ж.4.8 Векорасширитель.
Ж.4.9 Нити для наложения швов.
Ж.4.10 Хирургические инструменты.
Перечень средств измерений по Ж.4.1-Ж.4.10 является рекомендуемым. Допускается использовать другие средства испытания.
Ж.5 Требования к экспериментальной модели животного
Ж.5.1 Кролик считается самой подходящей моделью животного для проведения испытаний.
Ж.6 Порядок проведения испытания
Ж.6.1 Число животных, используемых для проведения исследований, должно быть минимальным и соответствовать установленному в [1]. С учетом процента отсева и других явлений в отношении здоровья и условий содержания животных следует использовать такое число животных, чтобы в конце периода наблюдения в наличии было шесть испытуемых глаз и шесть контрольных глаз.
Ж.6.2 Имплантируют в глаз одного из животных испытуемый образец (материал). Имплантация в два глаза предпочтительнее, но допустима имплантация в один глаз.
Ж.6.3 Имплантацию должны проводить лица, обученные технике имплантации и имеющие соответствующий опыт в имплантации ИОЛ.
Ж.6.4 Методика имплантации должна быть приближена к клиническому испытанию. Анатомические различия между животным и человеком и хирургические трудности, связанные со структурой (геометрией) глаза, могут потребовать размещения ИОЛ или материала типичного образца в другом месте глаза животного. Если материал ИОЛ оценивается не в предусмотренном месте размещения у животного, необходимо дать обоснование и провести анализ риска, чтобы идентифицировать потенциальные участки, когда ИОЛ размещается в предусмотренном месте у человека.
Ж.6.5 В течение всего периода испытания необходимо осуществлять контроль глаз с помощью микроскопа с щелевой лампой.
Ж.7 Требования к наблюдениям, проводимым во время испытания
Ж.7.1 Наблюдения, проводимые во время испытания, включают оценку следующих явлений:
- контакт между испытуемым материалом и роговичным эндотелием;
- коллапс передней камеры;
- кровотечение из передней камеры;
- повреждение радужной оболочки;
- положение гаптической части ИОЛ и оптическая децентрация;
- необычные хирургические проблемы.
Ж.7.2 Все наблюдения и проблемы должны быть зарегистрированы.
Ж.8 Требования к периоду имплантации
Ж.8.1 Если для имплантации глаза выбран кролик, период исследования должен длиться шесть месяцев. Кролику свойственно образование фибрина и возобновление роста ИОЛ, что затрудняет проводить оценку более длительной биологической совместимости. Поскольку известно, что глаз кролика быстрее реагирует на раздражение, для проведения исследования достаточно шести месяцев.
Ж.8.2 Если для проведения исследований выбран не кролик, а другое животное, длительность исследования составляет один год. Любые отклонения от требования к длительности исследований в один год, вызванные конкретными ограничениями, должны быть обоснованы.
Ж.9 Правила оценки результатов испытания
Ж.9.1.1 Послеоперационные оценки заключаются в выполнении и регистрации следующих действий:
а) макроскопических исследований оперированных глаз через день после операции;
б) проведение биологической микроскопии с использованием щелевой лампы через 7 дней, 4 недели, 3 мес, 6 мес и в конце периода наблюдения.
Ж.9.1.2 Исследуются следующие явления:
- фибрин;
- прилив крови;
- клетки;
- адгезии;
- неоваскуляризация;
- отек роговицы;
- прозрачность материала;
- расположение гаптической части;
- центрирование ИОЛ.
Ж.9.1.3 Если требуется, можно сделать фотоснимки щелевой лампой для документального оформления исследования.
Ж.9.2 Оценка энуклеированного глаза
Ж.9.2.1 Умертвляют животное в конце периода наблюдения и энуклеируют глаза. Также энуклеируют глаза животных, которые умерли или были безболезненно умерщвлены во время проведения исследования из-за болезней, не связанных с глазами.
Ж.9.2.2 Для проведения оценки энуклеированных глаз возможны две альтернативы:
а) энуклеированные глаза немедленно погружаются в фиксирующий раствор для хранения, чтобы позже произвести диссекацию глаза и последующую оценку, как указано в перечислении б) Ж.9.2.2;
б) проводят диссекацию глаза сразу после энуклеирования, и проводят внутреннее исследование. Следует отмечать все аномалии, размещение имплантата и центрирование, если необходимо. Особо следует исследовать места контакта ИОЛ и окулярной ткани, если необходимо. Следует сделать фотографии, чтобы подтвердить наблюдения.
Ж.9.2.3 Осторожно удаляют ИОЛ или образец материала и затем проводят гистопатологические исследования передней и задней камер глаза.
Примечание - Хранение энуклеированного глазного яблока в фиксирующем растворе может привести к изменению материала ИОЛ.
Ж.9.3 Оценка эксплантируемых ИОЛ
Ж.9.3.1 Исследуют эксплантируемые ИОЛ или образцы материала с помощью оптического микроскопа на наличие клеток (гигантских клеток, макрофагов и т.д.), продуктов распада клеток и фибриозных отложений, особенно в точках крепления петель и внутри позиционных отверстий.
Ж.9.3.2 Затем половину образцов следует тщательно очистить, не повреждая оптические поверхности, и оценить оптические свойства в соответствии с ГОСТ Р 52038.
Другую половину образцов следует оценить на наличие поверхностных отложений и изменений и на наличие признаков кальцификации.
Ж.9.3.3 Результаты заносят в отчет. Если некоторые данные пропущены или не могут быть получены, следует установить причины.
Ж.10 Правила оформления результатов испытания
Ж.10.1 Отчет об испытании должен содержать следующую информацию:
- все данные, необходимые для идентификации испытуемого образца;
- ссылку на настоящий стандарт;
- место размещения ИОЛ;
- результаты испытания, включая результаты отдельных определений и их средства, если проводились;
- любые отклонения от указанной методики;
- необычные признаки (аномалии), наблюдаемые во время проведения испытания;
- дату реального проведения испытания и даты проведения последующих анализов.
Приложение И
(справочное)
Сопоставление структуры настоящего стандарта
со структурой примененного в нем международного стандарта
И.1 Сопоставление структуры настоящего стандарта со структурой примененного в нем международного стандарта представлено в таблице И.1.
Таблица И.1 - Сопоставление структуры настоящего стандарта со структурой примененного в нем международного стандарта
Структура международного стандарта | Структура настоящего стандарта |
1 Область распространения | 1 Область применения |
2 Нормативные ссылки | 2 Нормативные ссылки |
3 Термины и определения | 3 Термины определения и сокращения |
4 Общие требования, применяемые к оценке биологической совместимости ИОЛ | 4 Общие требования к оценке биологической совместимости |
5 Физико-химические испытания | 5 Физико-химические испытания |
5.1 Общие сведения | 5.1 Общие требования |
5.2 Испытание на полную экстракцию | 5.2 Испытание на полную экстракцию |
5.3 Испытание на выщелачиваемые вещества | 5.3 Испытание на выщелачиваемые вещества |
5.4 Испытание на гидролитическую стойкость | 5.4 Испытание на гидролитическую стойкость |
5.5 Испытание на светостойкость | 5.5 Испытание на фотостабильность |
5.6 Испытание на воздействие излучения Nd-YFG лазера | 5.6 Испытание на воздействие излучения Nd-YFG лазера |
5.7 Оценка нерастворимых неорганических веществ | 5.7 Оценка нерастворимых неорганических веществ |
6 Биологические испытания | 6 Биологические испытания |
6.1 Общие положения | 6.1 Общие положения |
6.2 Испытание на генотоксичность | 6.2 Испытание на генотоксичность |
6.3 Испытание на сенсибилизацию | 6.3 Испытание на сенсибилизацию |
6.4 Испытание на имплантацию внутрь глаза | 6.4 Испытание имплантацией внутрь глаза |
Приложение А (обязательное) Испытание на полную экстракцию | Приложение А (обязательное) Метод испытания на полную экстракцию |
А.1 Назначение | А.1 Общие положения |
А.2 Общие соображения | А.2 Требования к испытуемым образцам |
А.З Принцип | А.З Требования к вспомогательным элементам (реактивам) |
А.4 Испытываемые образцы | А.4 Требования к средствам испытания |
А.5 Реактивы | А.5 Порядок проведения испытания |
А.6 Аппарат | А.6 Правила анализа испытуемого образца |
А.7 Методика испытания | А.7 Правила анализа вытяжек |
А.8 Анализ испытываемого материала | А.8 Правила оформления результатов испытания |
А.9 Анализ вытяжек | - |
А. 10 Отчет об испытании | - |
Приложение В (обязательное) Испытание на выщелачиваемые вещества | Приложение Б (обязательное) Метод испытания на выщелачиваемые вещества |
В.1 Назначение | Б.1 Общие положения |
В.2 Общие соображения | Б.2 Требования к испытуемым образцам |
В.3 Испытываемый материал | Б.3 Требования к контрольному материалу |
В.4 Контрольный материал | Б.4 Требования к средствам испытания |
В.5 Аппарат | Б.5 Порядок проведения испытания |
В.6 Методика испытания | Б.6 Правила оформления результатов испытания |
В.7 Отчет об испытании | - |
Приложение С (обязательное) Гидролитическая стойкость | Приложение В (обязательное) Метод испытания на гидролитическую стойкость |
С.1 Назначение | В.1 Общие положения |
С.2 Общие соображения | В.2 Требования к испытуемым образцам |
С.3 Испытываемый материал | В.3 Требования к контрольному материалу |
С.4 Контрольный материал | В.4 Требования к средствам испытаний |
С.5 Аппарат | В.5 Порядок проведения испытания |
С.6 Методика испытания | В.6 Правила оформления результатов испытания |
С.7 Отчет об испытании | - |
Приложение D (обязательное) Испытание на фотостабильность | Приложение Г (обязательное) Метод испытания на фотостабильность |
D.1 Назначение | Г.1 Общие положения |
D.2 Испытываемый материал | Г.2 Требования к испытуемым образцам |
D.3 Контрольный материал | Г.3 Требования к контрольному материалу |
D.4 Реактивы | Г.4 Требования к среде для экстракции |
D.5 Аппарат | Г.5 Требования к средствам испытания |
D.6 Методика испытания | Г.6 Порядок проведения испытания |
D.7 Оценка результатов после экспозиции | Г.7 Правила оценки результатов испытания |
D.8 Отчет об испытании | Г.8 Правила оформления результатов испытания |
Приложение Е (обязательное) Испытание на воздействие излучения Nd-YAG лазера | Приложение Д (обязательное) Метод испытания на воздействие излучения Nd-YAG лазера |
Е.1 Назначение | Д.1 Общие положения |
Е.2 Испытываемый материал | Д.2 Требования к испытуемым образцам |
Е.3 Реактивы | Д.3 Требования к среде для экстракции |
Е.4 Аппарат | Д.4 Требования к средствам испытания |
Е.5 Методика испытания | Д.5 Порядок проведения испытания |
Е.6 Оценка результатов после обработки | Д.6 Правила оценки результатов испытания |
Е.7 Отчет об испытании | Д.7 Правила оформления результатов испытания |
Приложение F (справочное) Дополнительные условия испытания на местное действие после имплантации к ИСО 10993-6 | Приложение Е (рекомендуемое) Дополнительные условия испытания на местное действие материала после имплантации к ГОСТ Р ИСО 10993-6 |
F.1 Дополнительные условия испытания в соответствии со стандартом ИСО 10993-6 | Е.1 Требования к условиям испытания |
F.2 Отчет об испытании | Е.2 Правила оформления результатов испытания |
Приложение G (обязательное) Испытание на имплантацию внутрь глаза | Приложение Ж (обязательное) Метод испытания на имплантацию внутрь глаза |
G.1 Назначение | Ж.1 Общие положения |
G.2 Испытываемый материал | Ж.2 Требования к испытуемым образцам |
G.3 Контрольный материал | Ж.3 Требование к контрольному материалу |
G.4 Реактивы и материалы | Ж.4 Требования к средствам испытания |
G.5 Аппарат | Ж.5 Требования к экспериментальной модели животного |
G.6 Экспериментальная модель животного | Ж.6 Порядок проведения испытания |
G.7 Методика испытания | Ж.7 Требования к наблюдениям, проводимым во время испытания |
G.8 Наблюдения, проводимые во время операции | Ж.8 Требования к периоду имплантации |
G.9 Период имплантации | Ж.9 Правила оценки результатов испытания |
G.10 Оценка испытания | Ж.10 Правила оформления результатов испытания |
G.11 Отчет об испытании | - |
- | Приложение И (справочное) Сопоставление структуры настоящего стандарта со структурой примененного в нем международного стандарта |
- | Приложение К (справочное) Сведения о соответствии ссылочных международных (региональных) стандартов национальным стандартам Российской Федерации, использованным в настоящем стандарте в качестве нормативных ссылок |
Библиография | Библиография |
Примечание - В настоящий стандарт включены термины и определения, не содержащиеся в ГОСТ Р 51892, и введены сокращения, применяемые в тексте стандарта. _____________ * Соответствует оригиналу. - . | |
Приложение К
(справочное)
Сведения о соответствии ссылочных международных стандартов
национальным стандартам Российской Федерации, использованным
в настоящем стандарте в качестве нормативных ссылок
Таблица К.1
Обозначение ссылочного национального стандарта Российской Федерации | Обозначение и наименование ссылочного международного стандарта |
ГОСТ ИСО 14971-1-2006 | ИСО 14971:2005 "Медицинские изделия. Применение управления рисками к медицинским изделиям" (IDT) |
ГОСТ Р 51892-2002 (ИСО 11979-1:99) | ИСО 11979-1:1999 "Офтальмологические имплантаты. Интраокулярные линзы. Часть 1: Словарь" (MOD) |
ГОСТ Р 52038-2003 (ИСО 11979-2:99) | ИСО 11979-2:1999 "Офтальмологические имплантаты. Интраокулярные линзы. Часть 2: Оптические свойства и методы испытаний" (MOD) |
ГОСТ Р 52039-2003 (ИСО 11979-3:99) | ИСО 11979-3:1999 "Офтальмологические имплантаты. Интраокулярные линзы. Часть 3: Механические свойства и методы испытаний" (MOD) |
ГОСТ Р ИСО 10993-1-1999 | ИСО 10993-1:2003 "Оценка биологического действия медицинских изделий. Часть 1: Оценка и испытание в системе управления рисками" (IDT) |
- | ИСО 10993-2:2006 "Оценка биологического действия медицинских изделий. Часть 2: Требования к благополучию животных" |
ГОСТ Р ИСО 10993-3-1999 | ИСО 10993-3:2003 "Оценка биологического действия медицинских изделий. Часть 3: Испытания на генотоксичность, канцерогенность и репродуктивную токсичность" (IDT) |
ГОСТ Р ИСО 10993-5-1999 | ИСО 10993-5:1999 "Оценка биологического действия медицинских изделий. Часть 5: Исследование in vitro цитотоксичности" (IDT) |
ГОСТ Р ИСО 10993-6-1999 | ИСО 10993-6:1994 "Оценка биологического действия медицинских изделий. Часть 6: Испытания на местное действие после имплантации" (IDT) |
ГОСТ Р ИСО 10993-10-1999 | ИСО 10993-10:2002 "Оценка биологического действия медицинских изделий. Испытания на раздражение и запоздалую сверхчувствительность" (IDT) |
ГОСТ Р ИСО 10993-12-1999 | ИСО 10993-12:2002 "Оценка биологического действия медицинских изделий. Часть 12: Подготовка образцов и материала сравнения" (IDT) |
Библиография
[1] ИСО 10993-2:2006 | Оценка биологического действия медицинских изделий. Часть 2: Требования к благополучию животных |
[2] Журнал Cataract Refract Surg. 13, 1987, с.297-301, Sliney, D.H. "Оценка воздействия солнечного УФ-излучения на ИОЛ" | |
[3] ИСО 10339:1997 | Оптика и оптические приборы. Контактные линзы. Определение содержания воды в гидрогелевых контактных линзах |
Электронный текст документа
и сверен по:
, 2008

