ГОСТ 33456-2015
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КАРАНТИН РАСТЕНИЙ
Методы выявления и идентификации тутовой щитовки
Plant quarantine. Methods of detection and identification of white peach scale
МКС 01.040.65
65.020.20
Дата введения 2016-07-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский центр карантина растений" (ФГБУ "ВНИИКР")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 августа 2015 г. N 79-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Туркмения | ТМ | Главгосслужба "Туркменстандартлары" |
(Поправка), (Поправка. ИУС N 7-2022).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 4 сентября 2015 г. N 1269-ст межгосударственный стандарт ГОСТ 33456-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2016 г.
5 ВВЕДЕН ВПЕРВЫЕ
6 ИЗДАНИЕ (Май 2020 г.) с Поправкой (ИУС N 7-2019)
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
ВНЕСЕНА поправка, опубликованная в ИУС N 7, 2022 год
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на плодовые и декоративные культуры и устанавливает методы выявления и идентификации (далее - исследование) тутовой щитовки Pseudaulacaspis pentagona (Targioni-Tozzetti) (далее - тутовая щитовка).
Примечание - Общие сведения о тутовой щитовке приведены в приложении А.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.004 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ 12.4.009 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 61 Реактивы. Кислота уксусная. Технические условия
ГОСТ OIML R 76-1 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 490 Кислота молочная пищевая. Технические условия
ГОСТ 1770 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118 Реактивы. Кислота соляная. Технические условия
ГОСТ ISO 3520 Масло эфирное бергамотовое [Citrus aurantium L. subsp. bergamia (Wight et Arnott) Engler], Итальянский тип. Технические условия
ГОСТ 5556 Вата медицинская гигроскопическая. Технические условия
ГОСТ 6259 Реактивы. Глицерин. Технические условия
ГОСТ 6672 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 9147 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9284 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 12026 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 12430 Карантин растений. Методы и нормы отбора образцов подкарантинной продукции при карантинном фитосанитарном досмотре и лабораторных исследованиях
ГОСТ ISO/IES 17025* Общие требования к компетентности испытательных и калибровочных лабораторий
________________
* Вероятно, ошибка оригинала. Следует читать: ГОСТ ISO/IEC 17025, здесь и далее по тексту. - .
ГОСТ 18300 Спирт этиловый ректификованный технический. Технические условия*
________________
* В Российской Федерации действует ГОСТ Р 55878-2013 "Спирт этиловый технический гидролизный ректификованный. Технические условия".
ГОСТ 20562 Карантин растений. Термины и определения
ГОСТ 21240 Скальпели и ножи медицинские. Общие технические требования и методы испытаний
ГОСТ 21507 Защита растений. Термины и определения
ГОСТ 24363 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25706 Лупы. Типы, основные параметры. Общие технические требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации (www.easc.by) или по указателям национальных стандартов, издаваемым в государствах, указанных в предисловии, или на официальных сайтах соответствующих национальных органов по стандартизации. Если на документ дана недатированная ссылка, то следует использовать документ, действующий на текущий момент, с учетом всех внесенных в него изменений. Если заменен ссылочный документ, на который дана датированная ссылка, то следует использовать указанную версию этого документа. Если после принятия настоящего стандарта в ссылочный документ, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение применяется без учета данного изменения. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ 20562 и ГОСТ 21507, а также следующие термины с соответствующими определениями:
3.1 аттрактивность (в энтомологии): Способность природных и синтетических веществ привлекать насекомых.
3.2 бедро (в энтомологии): Один из члеников ног насекомых, расположенный между вертлугом и голенью.
3.3 брюшной отдел [брюшко, абдомен] (в энтомологии): Задний, следующий за грудью, отдел тела насекомого, состоящий из сегментов.
3.4 брюшной сегмент (в энтомологии): Часть брюшка насекомого.
3.5 вертлуг (в энтомологии): Один из члеников ног насекомых, расположенный между тазиком и бедром.
3.6 вырезки (в энтомологии, применительно к щитовкам семейства Diaspididae): Участки края пигидия между дольками.
Примечание - Между дольками первой пары расположена первая вырезка. Промежуток между долькой первой пары и долькой второй пары называется второй вырезкой пигидия.
3.7 голень (в энтомологии): Один из члеников ног насекомых, расположенный между бедром и лапкой.
3.8 головной отдел [голова] (в энтомологии): Передний отдел тела насекомого, состоящий из нескольких слившихся склеритов и несущий на себе ротовые части и органы чувств.
3.9 гребешки (в энтомологии, применительно к щитовкам семейства Diaspididae): Пленчатые, слабо склеротизированные отростки различной формы, расположенные в вырезках пигидия между дольками и очень часто по краю пигидия спереди от крайних долек.
3.10 грудной отдел [грудь] (в энтомологии): Отдел тела насекомого, следующий за головой и состоящий из трех сегментов - переднегруди, среднегруди и заднегруди.
3.11 диапауза (в энтомологии): Состояние временного физиологического покоя насекомого, во время которого все биохимические процессы в его организме сведены к минимуму.
3.12 дольки (в энтомологии, применительно к щитовкам семейства Diaspididae): Широкие, сильно склеротизированные выступы, расположенные симметрично по краю пигидия.
Примечание - Пара долек, находящаяся на вершине пигидия, называется первой парой. Следующие две дольки, расположенные по одной с каждой стороны от долек первой пары, называются второй парой. За ними следуют дольки третьей и четвертой пар. Дольки обозначают заглавной латинской буквой L, а нумерация идет от первой пары долек.
3.13 дорсальные железы (в энтомологии, применительно к щитовкам семейства Diaspididae): Железы, расположенные косыми рядами, группами или беспорядочно на дорсальной, реже на вентральной поверхности пигидия и на поверхности других сегментов - брюшка и груди.
Примечание - Дорсальные железы могут встречаться одновременно с краевыми.
3.14 жировое тело (в энтомологии): Мезодермальное образование неопределенной формы у насекомого, служащее для накопления и синтеза резервных и транспортных веществ, выделения и ряда других функций.
3.15 имаго (в энтомологии): Взрослая дефинитивная стадия индивидуального развития насекомого.
3.16 индивидуальное развитие [онтогенез] (в энтомологии): Совокупность преобразований, претерпеваемых насекомым от зарождения до конца жизни.
3.17 краевые железы (в энтомологии, применительно к щитовкам семейства Diaspididae): Короткие и широкие железы, устьица которых расположены по краю дорсальной поверхности пигидия.
Примечание - Длина краевых желез превосходит ширину не более чем в четыре раза.
3.18 лапка (в энтомологии): Последний из члеников ног насекомых, сочленяющийся с голенью.
3.19 линька (в энтомологии): Периодическая смена наружных покровов тела насекомого.
3.20 личинка (в энтомологии): Постэмбриональная стадия индивидуального развития насекомого.
3.21 личиночная шкурка [экзувий] (в энтомологии): Шкурка насекомого, целиком сбрасываемая при линьке.
3.22 нимфа (в энтомологии): Преимагинальная стадия индивидуального развития насекомых с неполным превращением.
3.23 модельное дерево: Дерево, которое выбирают в качестве типичного образца, характеризующего деревья в насаждениях.
Примечание - Выборка модельного дерева заключается в отборе одного или нескольких деревьев, имеющих средние таксационные показатели (диаметр, высота, форма ствола и кроны).
3.24 пигидий (в энтомологии, применительно к щитовкам семейства Diaspididae): Задняя часть брюшка насекомого, состоящая из нескольких слитых вместе склеротизированных сегментов.
Примечание - На вентральной поверхности пигидия расположено вагинальное отверстие в виде щели, на дорсальной - анальное, округлой формы. На обеих поверхностях пигидия имеются железы. По краю пигидия, в его задней части расположены дольки и гребешки.
3.25 склерит (в энтомологии): Твердый элемент наружных покровов тела насекомого.
3.26 скутеллум [щитик] (в энтомологии): Задняя часть дорсальной части среднегруди насекомого, которая представляет собой хитиновую пластинку.
3.27 скутум [щит] (в энтомологии): Основная часть дорсальной части среднегруди насекомого, которая представляет собой хитиновую пластинку.
3.28 тазик (в энтомологии): Первый из члеников ног насекомых, расположенный между грудью и вертлугом.
3.29 усики [антенны, сяжки] (в энтомологии): Парные многочленистые подвижные придатки головы насекомого, являющиеся органами обоняния и осязания.
3.30 цилиндрические железы (в энтомологии, применительно к щитовкам семейства Diaspididae): Длинные и узкие железы, длина которых превосходит ширину более чем в пять раз, очень редко в четыре или меньше раз.
Примечание - Устьица цилиндрических желез расположены рядами, группами или беспорядочно на дорсальной, реже на вентральной поверхности пигидия. Они отличаются от краевых и дорсальных желез тем, что имеют один хитиновый ободок, тогда как первые имеют два хитиновых ободка. При наличии цилиндрических желез краевые и дорсальные чаще отсутствуют.
3.31 циркумгенитальные железы (в энтомологии, применительно к щитовкам семейства Diaspididae): Небольшие дисковидные пятиячеистые железы, расположенные группами вокруг вагинальной щели у многих видов щитовок.
3.32 штамб (в ботанике): Часть ствола дерева от корневой шейки до первой скелетной ветви нижнего яруса кроны.
3.33 щиток (в энтомологии, применительно к щитовкам семейства Diaspididae): Единое образование, продукт деятельности желез кутикулы, производящих особое затвердевающее вещество.
Примечание - Цвет щитка у щитовок может быть разным, он бывает светло- или темноокрашенным, всегда является маскирующим.
3.34 яйцо (в энтомологии): Эмбриональная стадия индивидуального развития насекомого.
4 Методы выявления тутовой щитовки
4.1 Визуальный метод
4.1.1 Сущность метода
Сущность метода выявления колоний тутовой щитовки заключается в визуальном обследовании с помощью лупы коры ветвей и ствола саженцев, а также черенков.
4.1.2 Аппаратура
Для выявления тутовой щитовки визуальным методом используют следующую аппаратуру:
- лупы по ГОСТ 25706, ручные с увеличением не менее чем в 10 раз и налобные бинокулярные с увеличением не менее чем в 2,5 раза;
- стереомикроскоп с увеличением не менее чем в 50 раз с фотокамерой.
Допускается применение другой аппаратуры по техническим характеристикам не хуже вышеуказанных.
4.1.3 Проведение обследования
4.1.3.1 Визуальному досмотру подлежит каждое десятое модельное дерево каждого пятого ряда насаждений, либо проводят сплошное обследование деревьев каждого квартала сада по диагоналям.
4.1.3.2 Досмотр саженца начинают с корневой шейки, далее переходя на надземные части. Осматривать кору необходимо очень внимательно, так как под ее отмершими кусочками и в мелких трещинах могут находиться единичные особи щитовок.
Переходя к осмотру веток саженца, внимательно осматривают места разветвлений. Постепенно приближаясь к концу ветки, осматривают всю кору, ответвления тонких веток, концы побегов, почки. Особое внимание обращают на пазухи под почками, где также можно встретить самок и личинок щитовок. Если саженец привитый, то особенно тщательно просматривают место прививки.
4.1.3.3 Визуальный досмотр черенков осуществляют с помощью налобной или ручной лупы, либо под стереомикроскопом. Во время визуального досмотра под стереомикроскопом черенок держат горизонтально. Досмотр начинают с нижнего, более толстого конца, постепенно перемещая черенок вдоль горизонтальной оси по спиральной линии. Досмотр черенков, покрытых парафином, проводят, предварительно удалив слой парафина.
4.1.3.4 В случае обнаружения щитовок проводят отбор проб и образцов по 5.4.2.1 и 5.4.2.2 для последующей идентификации.
4.1.3.5 После завершения обследования составляют акт, который подписывает представитель хозяйства и обследователь.
4.2 Метод выявления (обследования) с помощью феромонных ловушек
4.2.1 Сущность метода
Сущность метода выявления тутовой щитовки с помощью феромонных ловушек заключается в привлечении самцов тутовой щитовки с целью их лова путем вывешивания ловушек с препаратом полового феромона самки тутовой щитовки, который проводят в летний период.
4.2.2 Материалы
Для выявления тутовой щитовки с помощью феромонных ловушек используют следующие материалы:
- диспенсер;
- клей энтомологический или вазелин;
- ловушки феромонные (далее - ловушки), представляющие собой сложенные пополам пластины из жесткого ламинированного с двух сторон картона с отверстием для крепления на кронах деревьев;
- феромон синтетический половой самок тутовой щитовки (феромонная композиция).
Допускается применение других материалов по техническим характеристикам не хуже вышеуказанных.
4.2.3 Подготовка к обследованию
4.2.3.1 Перед началом выявления готовят план обследуемого массива с указанием мест размещения и номеров ловушек.
4.2.3.2 Для подготовки ловушек с их внутренней стороны наносят энтомологический клей или вазелин. В центр ловушки помещают диспенсер с нанесенной на него феромонной композицией, который используют в течение 60 сут до потери аттрактивности в природных условиях, после чего диспенсер заменяют на новый.
4.2.4 Проведение обследования
4.2.4.1 Ловушки вывешивают по периферии крон деревьев, избегая крайних рядов, на высоте от 1,5 до 2,0 м от поверхности почвы перед началом лета самцов тутовой щитовки (в соответствии с фенологическими особенностями в различных климатических зонах) из расчета одна ловушка:
- на 2 га в плодоносящих садах;
- 5 га в молодых садах;
- 1 га в питомниках (для определения более точного места очага вредителя).
4.2.4.2 Ловушки проверяют через 10-15 дней после начала лета самцов. При обнаружении самцов тутовой щитовки ловушки снимают, упаковывают в картонную коробку, снабжают этикеткой с указанием места и времени работы ловушки.
4.2.4.3 При обнаружении в ловушках самцов тутовой щитовки проводят контрольное обследование насаждений визуальным методом по 4.1 для выявления колоний самок тутовой щитовки и отбора проб и образцов по 5.4.2.1 и 5.4.2.2 для последующей идентификации.
4.2.4.4 После завершения обследования составляют акт, который подписывает представитель хозяйства и обследователь.
5 Методы идентификации тутовой щитовки
5.1 Сущность методов
Сущность методов идентификации заключается в диагностическом определении таксономических признаков исследуемого образца насекомого на всех стадиях развития и сравнении их с таксономическими признаками тутовой щитовки, определяющих ее видовую принадлежность.
5.2 Общие требования
5.2.1 Требования безопасности
При выполнении исследований необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
Все исследования проводят в перчатках и лабораторных халатах.
Помещение, в котором проводят исследования, должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021. Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
При работе с электроустановками электробезопасность должна соответствовать требованиям ГОСТ 12.1.019. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Утилизацию зараженного растительного материала проводят автоклавированием в течение 20 мин при температуре 121°С.
5.2.2 Требования к лаборатории
Общие требования к лаборатории - по ГОСТ ISO/IES 17025.
5.2.3 Требования к персоналу
Персонал, участвующий в исследовании, должен владеть морфологическим и морфометрическим методами идентификации тутовой щитовки и быть обучен технике обращения с лабораторным оборудованием.
5.3 Средства измерений, аппаратура, реактивы, посуда и материалы
5.3.1 Средства измерений
Для идентификации тутовой щитовки применяют следующие средства измерения:
- весы по ГОСТ OIML R 76-1 высокого класса точности с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,01 г;
- окуляр-микрометр (в комплекте с микроскопом биологическим прямым с увеличением не менее чем в 1000 раз).
5.3.2 Аппаратура
Для идентификации тутовой щитовки применяют следующую аппаратуру:
- баню водяную, позволяющую поддерживать температуру до 100°С;
- горелку спиртовую по ГОСТ 25336;
- микроскоп биологический прямой с увеличением не менее чем в 1000 раз с фотокамерой;
- стереомикроскоп с увеличением не менее чем в 50 раз с фотокамерой;
- столик нагревательный для сушки микропрепаратов с температурой нагрева до 60°С.
5.3.3 Реактивы
Для идентификации тутовой щитовки применяют следующие реактивы:
- бальзам канадский.
Примечание - Допускается использовать в качестве среды для приготовления постоянных микропрепаратов вместо канадского бальзама его синтетические аналоги;
- воду дистиллированную по ГОСТ 6709;
- глицерин по ГОСТ 6259;
- гуммиарабик;
- калия гидроокись по ГОСТ 24363;
- кислоту молочную пищевую по ГОСТ 490;
- кислоту соляную по ГОСТ 3118;
- кислоту уксусную по ГОСТ 61;
- масло бергамотовое по ГОСТ ISO 3520;
- масло гвоздичное;
- спирт этиловый ректификованный технический по ГОСТ 18300;
- фуксин кислый;
- фуксин основной;
- хлоралгидрат.
5.3.4 Посуда и материалы
Для идентификации тутовой щитовки применяют следующие посуду и материалы:
- колбы мерные по ГОСТ 1770, вместимостью 500 см;
- пробирки пластиковые с крышкой вместимостью 15 см;
- тигли фарфоровые диаметром 25 мм по ГОСТ 9147;
- чашки Петри диаметром 40 мм по ГОСТ 25336;
- булавки энтомологические;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
- вату медицинскую гигроскопическую по ГОСТ 5556;
- держатель для пробирок;
- иглы препаровальные;
- конверты бумажные;
- коробки для микропрепаратов;
- коробки энтомологические;
- нож;
- пакеты из полимеров этилена, герметично закрывающиеся;
- перчатки одноразовые для лабораторных исследований;
- планшет картонный размерами 3520 см;
- скальпель медицинский по ГОСТ 21240;
- стекло покровное для микропрепаратов по ГОСТ 6672;
- стекло предметное для микропрепаратов по ГОСТ 9284;
- стекло предметное с углублением;
- халаты лабораторные.
5.3.5 Допускается применение других средств измерений и посуды по метрологическим характеристикам, а также аппаратуры, реактивов и материалов по техническим характеристикам не хуже вышеуказанных.
5.4 Подготовка к идентификации
5.4.1 Приготовление растворов
5.4.1.1 Приготовление жидкости Хойера для временных микропрепаратов
В плотно закрывающуюся колбу вместимостью 500 см наливают 50 см
дистиллированной воды, добавляют 30 г гуммиарабика и оставляют до его полного растворения. Затем в колбу добавляют 200 г хлоралгидрата и 20 см
глицерина и снова оставляют до полного растворения всех ингредиентов.
Срок хранения жидкости Хойера в темном месте в посуде из темного стекла при температуре от 15°С до 25°С - не более 12 мес.
5.4.1.2 Приготовление окрашивающих жидкостей для постоянных микропрепаратов
Приготовление раствора основного фуксина
В колбе вместимостью 500 см смешивают 1 г основного фуксина и 100 см
этилового спирта.
Приготовление раствора кислого фуксина.
В колбе вместимостью 500 см смешивают 0,5 г кислого фуксина, 25 см
10%-ного раствора соляной кислоты и 300 см
дистиллированной воды.
Срок хранения готовых окрашивающих жидкостей в темном месте в посуде из темного стекла при температуре от 15°С до 25°С - не более 12 мес.
5.4.2 Отбор и хранение проб и образцов
5.4.2.1 Отбор и хранение проб посадочного материала
Отбор проб осуществляют по ГОСТ 12430 со следующими дополнениями.
Для идентификации тутовой щитовки с каждого дерева, заражение которого выявлено в соответствии с разделом 4 (см. рисунок Б.1, приложение Б), отбирают пробы, состоящие из двух-трех веток длиной 10 см с колониями щитовок, нескольких плодов (от двух до трех) с симптомами повреждения, и двух-трех листьев с колониями щитовок (в летний период).
Если колонии щитовок имеются только на штамбе или скелетных ветвях (см. рисунок Б.2, приложение Б), то аккуратно снимают скальпелем или ножом тонкий слой коры с колониями площадью 3-4 см с трех сторон дерева.
Пробы помещают в герметично закрывающиеся пакеты, в которые вкладывают этикетку с указанием места отбора пробы, наименования растения-хозяина, части растения (листья, ветки, ствол, плоды и т.д.), даты и фамилии специалиста, отобравшего пробу.
Пробы, собранные с зараженных деревьев обследуемого участка, направляют для последующей идентификации.
Примечание - Расположение заселенных тутовой щитовкой деревьев наносят на схему сада для принятия решения о проведении соответствующих фитосанитарных мероприятий по локализации и ликвидации очага заражения.
После отбора проб составляют акт, который подписывает представитель хозяйства и специалист, отобравший пробу.
Для хранения проб растительного материала его высушивают с помощью пресса, изготовленного из фильтровальной бумаги. Прессование необходимо в тех случаях, когда отбирают пробы коры, кожицу плодов, листья. Если в качестве проб берут ветки с колониями щитовок, то прессование не используют.
Высушенный прессованием растительный материал раскладывают на выложенную слоями вату, прикладывают этикетку с указанием места отбора пробы, наименования растения-хозяина, даты отбора, фамилии специалиста, отбиравшего пробы.
5.4.2.2 Сбор и хранение образцов насекомых
Подвижных личинок первого возраста тутовой щитовки собирают, держа лист фильтровальной бумаги под растением и слегка постукивая по нему. Затем собранные личинки помещают и хранят в пластиковых пробирках с этиловым спиртом концентрацией 70%.
Самцов тутовой щитовки собирают во время их лета (см. 4.2) и направляют для последующей идентификации по самцам в соответствии с 5.5.4.
Хранят самцов на клеевой поверхности ловушек.
Самок тутовой щитовки собирают вместе с кусочками растений (ветки, листья, плоды, кожица плодов), на которых они питаются, помещают в герметично закрывающиеся пакеты и направляют для последующей идентификации по самкам в соответствии с 5.5.5.
Мертвых самок тутовой щитовки хранят, как правило, в сухом виде в бумажных конвертах или на выложенной слоями вате в энтомологических коробках в защищенном от света месте.
Примечание - Пакеты из полимерных материалов не подходят для хранения образцов насекомых, так как возникает опасность запотевания и образования плесени, что делает их непригодными для идентификации.
5.4.3 Приготовление микропрепаратов
5.4.3.1 Общие положения
Для предварительной идентификации и создания справочных коллекций постоянные микропрепараты делают из взрослых самцов тутовой щитовки.
Для точной идентификации и создания справочных коллекций временные и постоянные микропрепараты делают из взрослых самок тутовой щитовки.
Для изготовления микропрепаратов берут самок, не пораженных мицелием плесневых грибов.
В случае, если самка живая и ее тело наполнено яйцами, то для удаления яиц тело прокалывают тонкой энтомологической булавкой в головном конце и легким прессованием энтомологической булавкой середины брюшка, выдавливают через прокол большую часть внутренностей - яйца, жировое тело.
Тело самок щитовок помещают в микропрепарат в неразрезанном виде.
5.4.3.2 Приготовление временных микропрепаратов
Временные микропрепараты делают из живых и мертвых насекомых для проведения срочного энтомологического исследования.
Примечание - Временные микропрепараты позволяют за короткий период времени выявить диагностические признаки пигидия самки и идентифицировать тутовую щитовку. Временные микропрепараты не используют для создания справочных коллекций, так как они не подлежат длительному хранению (со временем в них происходят химические изменения, например, кристаллизация, образование воздушных пузырьков).
Пробу растительного материала с колониями щитовок, отобранную по 5.4.2.1, просматривают под стереомикроскопом. Затем энтомологической булавкой или препаровальной иглой приподнимают щитки и отбирают от трех до пяти штук наиболее крупных самок.
Живых насекомых (при надавливании выделяется тканевая жидкость) с помощью энтомологической булавки или препаровальной иглы переносят в 70%-ный раствор этилового спирта на 10 мин, затем помещают в фарфоровый тигель с концентрированной молочной кислотой и нагревают на водяной бане до просветления тканей или нагревают в молочной кислоте на предметном стекле над спиртовой горелкой в течение 2-3 мин.
Вместо этилового спирта и молочной кислоты можно использовать жидкость Хойера, в которую помещают живых насекомых на предметном стекле, предварительно проткнув насекомое в головном конце тонкой энтомологической булавкой, затем накрывают покровным стеклом и нагревают над спиртовой горелкой до просветления тканей в течение 2-3 мин.
Примечание - Протыкая насекомое энтомологической булавкой, необходимо не допустить повреждения пигидия, на котором находятся диагностические признаки щитовок.
Мертвых насекомых (при надавливании тканевая жидкость не выделяется) помещают в фарфоровый тигель с концентрированной молочной кислотой и нагревают до просветления тканей или нагревают в молочной кислоте на предметном стекле над спиртовой горелкой в течение 2-3 мин.
После просветления тканей при использовании концентрированной молочной кислоты, удаляют ее остатки фильтровальной бумагой, а насекомых с помощью энтомологической булавки переносят на предметное стекло в жидкость Хойера, либо в глицерин.
Осветленных насекомых накрывают покровным стеклом и просматривают под микроскопом.
5.4.3.3 Приготовление постоянных микропрепаратов
Постоянные микропрепараты используют при энтомологическом исследовании и для создания справочных коллекций.
Образцы самцов тутовой щитовки, отобранные по 5.4.2.2, освобождают от энтомологического клея, с помощью энтомологической булавки или препаровальной иглы переносят в фарфоровый тигель с 5%-ным раствором гидроокиси калия и нагревают на водяной бане до 60°С в течение 1-3 мин. Затем насекомых переносят в дистиллированную воду, и далее на предметное стекло, наносят каплю канадского бальзама и плавно накрывают покровным стеклом, предварительно прикоснувшись его ребром к капле бальзама.
Под микроскопом изучают основные диагностические признаки самца тутовой щитовки, измеряя с помощью окуляр-микрометра длину тела и ширину груди, длину копулятивного аппарата (стилуса), а также длину и ширину пластинки скутума среднегруди, а также просматривают голову самца на наличие таких диагностических признаков, как четкий ячеистый рисунок на вентральной стороне головы и на втором членике усика.
Образцы самок тутовой щитовки, отобранные по 5.4.2.2, помещают под стереомикроскоп и с помощью энтомологической булавки или препаровальной иглы приподнимают щитки и отбирают от трех до пяти штук наиболее крупных самок.
Живых насекомых с помощью энтомологической булавки или препаровальной иглы переносят в чашку Петри с 70%-ным раствором этилового спирта на 10 мин, затем тонкой энтомологической булавкой под стереомикроскопом делают прокол в головной или дорсальной части тела и с помощью энтомологической булавки или препаровальной иглы переносят насекомых в фарфоровый тигель, заполненный на 1/3 10%-ным раствором гидроокиси калия.
Мертвых насекомых переносят в фарфоровый тигель, заполненный на 1/3 10%-ным раствором гидроокиси калия и делают прокол.
Тигель, зафиксированный держателем, подогревают на водяной бане при температуре 60°С в течение 5-20 мин для просветления тканей насекомого.
Затем раствор гидроокиси калия сливают в чашку Петри и легким прессованием энтомологической булавкой очищают насекомое от внутренностей, которые выходят через прокол.
С помощью энтомологической булавки или препаровальной иглы очищенных насекомых переносят в дистиллированную воду, меняя ее несколько раз, затем в 75%-ный и 96%-ный растворы этилового спирта, последовательно погружая насекомое в каждый раствор на 2-3 мин, далее - в фарфоровый тигель или предметное стекло с углублением с раствором основного или кислого фуксина на 10-60 мин.
Насекомых помещают на поверхность краски, чтобы можно было легко их найти. Для удаления излишков красителя окрашенных насекомых переносят на предметное стекло с углублением на 5-10 мин в 96%-ный раствор этилового спирта, а затем насекомых энтомологической булавкой или препаровальной иглой переносят на предметное стекло в каплю гвоздичного или бергамотового масла на 20-30 мин.
Фильтровальной бумагой, нарезанной узкими секторами, удаляют остатки гвоздичного или бергамотового масла, наносят каплю канадского бальзама и плавно накрывают покровным стеклом, предварительно прикоснувшись его ребром к капле бальзама.
5.4.3.4 Маркировка и хранение микропрепаратов
При однородном видовом составе допускается помещать несколько насекомых на одно предметное стекло.
Каждый микропрепарат снабжают этикеткой.
Готовые микропрепараты, находящиеся в строго горизонтальном положении, помещают на нагревательный столик при температуре 60°С для подсушивания. Срок подсушивания микропрепаратов на нагревательном столике составляет от 24 до 48 ч, либо их оставляют в помещении на планшетах при температуре от 18°С до 25°С в течение двух-трех недель.
После полного высушивания микропрепараты хранят в горизонтальном положении на планшетах или в вертикальном положении в коробках для микропрепаратов.
5.5 Проведение идентификации
5.5.1 Общие положения
Предварительную идентификацию тутовой щитовки проводят по всем стадиям развития насекомого морфологическим и морфометрическим методами.
Точную идентификацию, независимо от предварительной, проводят только по самкам тутовой щитовки, так как определители щитовок построены на признаках самок.
Совпадение признаков исследуемого образца насекомого с признаками тутовой щитовки (в зависимости от стадии развития), приведенными в 5.5.2-5.5.5, позволяет идентифицировать вид щитовки как тутовую.
5.5.2 Идентификация яиц
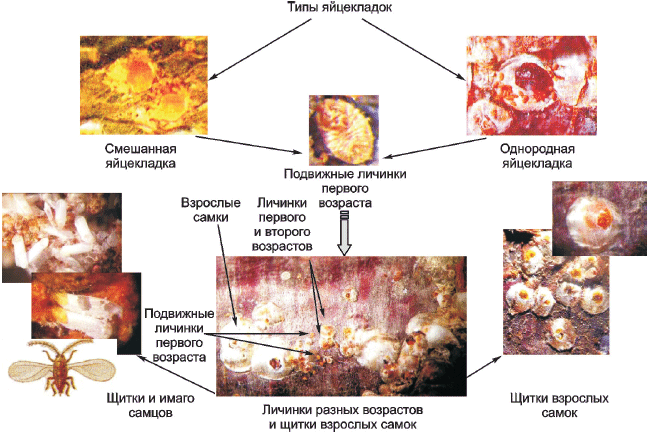
Яйца тутовой щитовки овальной формы, окраска их варьирует от белой, кремовой, бледно-желтой, ярко-желтой, желтовато-розовой до оранжевой в зависимости от их половой принадлежности и вида растения-хозяина. Яйца и подвижные личинки первого возраста проявляют половой диморфизм в отношении цвета.
5.5.3 Идентификация личинок
Только что вышедшие из яиц личинки тутовой щитовки имеют хорошо развитые ноги и усики. Цвет их в зависимости от половой принадлежности варьирует от белого до оранжевого (см. рисунок Б.3, приложение Б). После линьки они теряют глаза, ноги и усики, превращаясь в личинок старших возрастов.
Щиток нимфы самца тутовой щитовки белого цвета, удлиненный, войлокообразный, с двумя продольными желобками, с одной светлой прозрачной личиночной шкуркой, расположенной в головном конце щитка. Личиночная шкурка и восковая часть составляют мягкий нежный кокон, в котором и происходит развитие мужской особи вплоть до имаго (см. рисунок Б.4, приложение Б).
5.5.4 Идентификация самцов
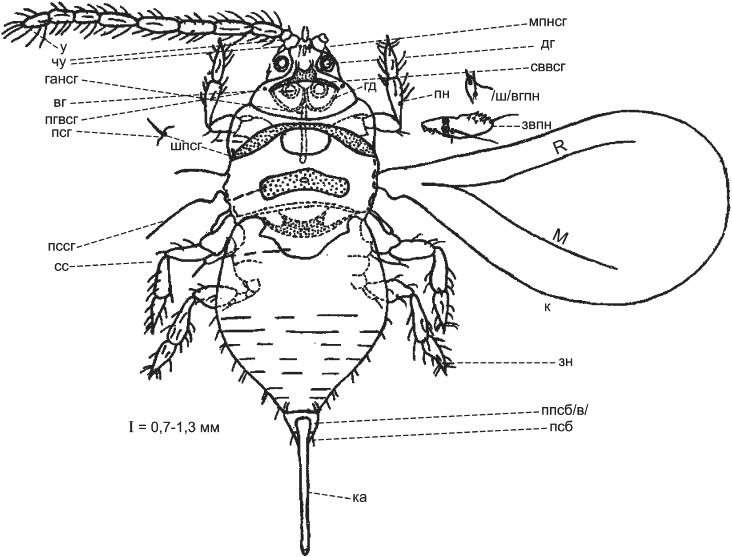
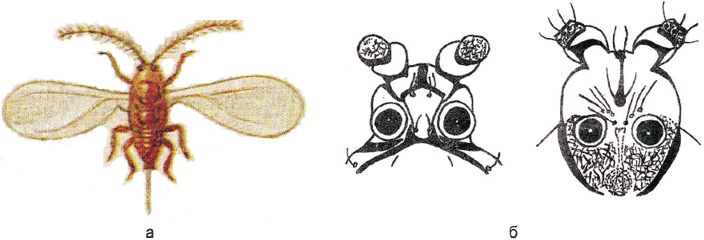
Тело взрослого самца тутовой щитовки (см. рисунок Б.5, приложение Б) длиной от 0,5 до 1,0 мм (не считая полового аппарата). Тело удлиненной формы, с одной парой крыльев, с ясной расчлененностью тела на голову, грудь и брюшко, с хорошо развитыми глазами, усиками и ногами; обычно ярко-желтого цвета. Вертлуги передних ног с зубчиками.
Голова с вентральной стороны и второй членик усика с четким ячеистым рисунком. На дорсальной стороне головы пятнообразных глазков нет (см. рисунок Б.6, приложение Б).
5.5.5 Идентификация самок
5.5.5.1 Морфологические признаки
Взрослая половозрелая самка тутовой щитовки (см. рисунок Б.7, приложение Б) имеет длину от 1,00 до 1,55 мм, бескрылая, неподвижная, глаза и ноги отсутствуют, усики редуцированы до нерасчлененного бугорка.
Форма тела широкоовальная или грушевидная. Цвет тела варьируется от желтого до оранжевого и розового (см. рисунок Б.8, приложение Б).
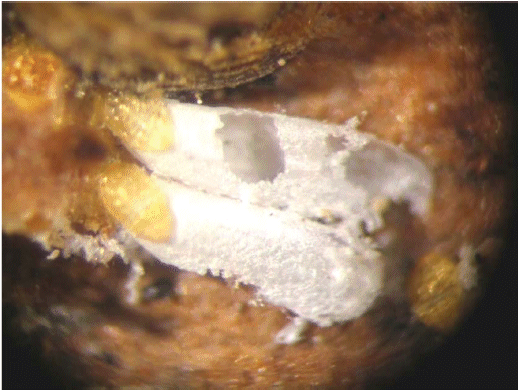
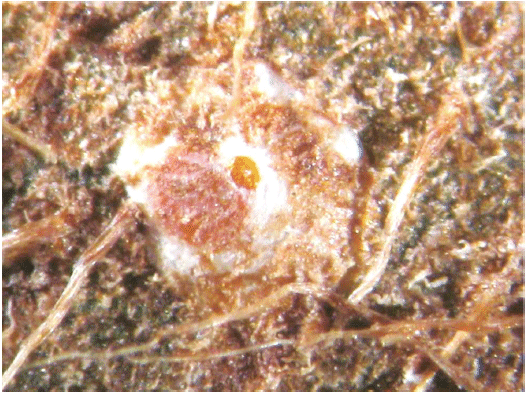
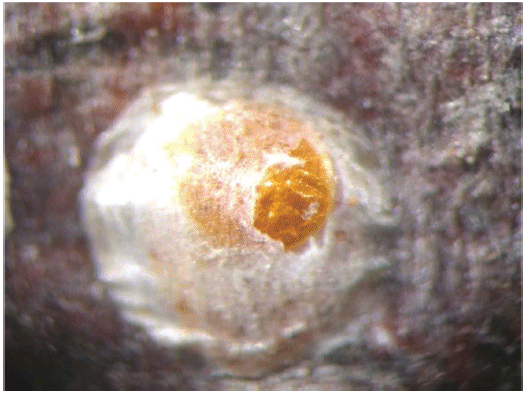
Брюшко состоит из передней четко сегментированной части и бурого или темно-желтого пигидия, образованного слитными последними сегментами брюшка. Щиток взрослой самки тутовой щитовки (см. рисунок Б.9, приложение Б) белого или сероватого цвета, круглой или овальной формы. В состав щитка входят секреторная часть и две личиночные шкурки, сброшенные во время линьки, имеющие характерный золотистый цвет, расположенные ближе к краю щитка или в его центральной части. Размер щитка от 2,0 до 2,8 мм в зависимости от растения-хозяина.
Щиток неоплодотворенной самки белый, рыхлый, ватоподобный, широко-удлиненный; тело растянуто, раздуто, часто более светлой окраски, чем у оплодотворенной.
Щиток старой или мертвой самки имеет темно-серый цвет, часто сливается с корой растения-хозяина; личиночные шкурки первого возраста часто отскакивают, остаются темно-желтые личиночные шкурки второго возраста; с внутренней стороны щиток часто перламутрово-белый. Тело сморщенное, темно-желтое или коричневое.
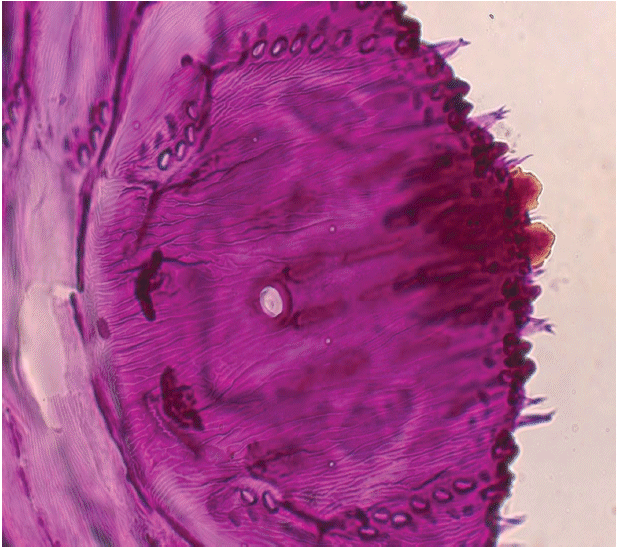
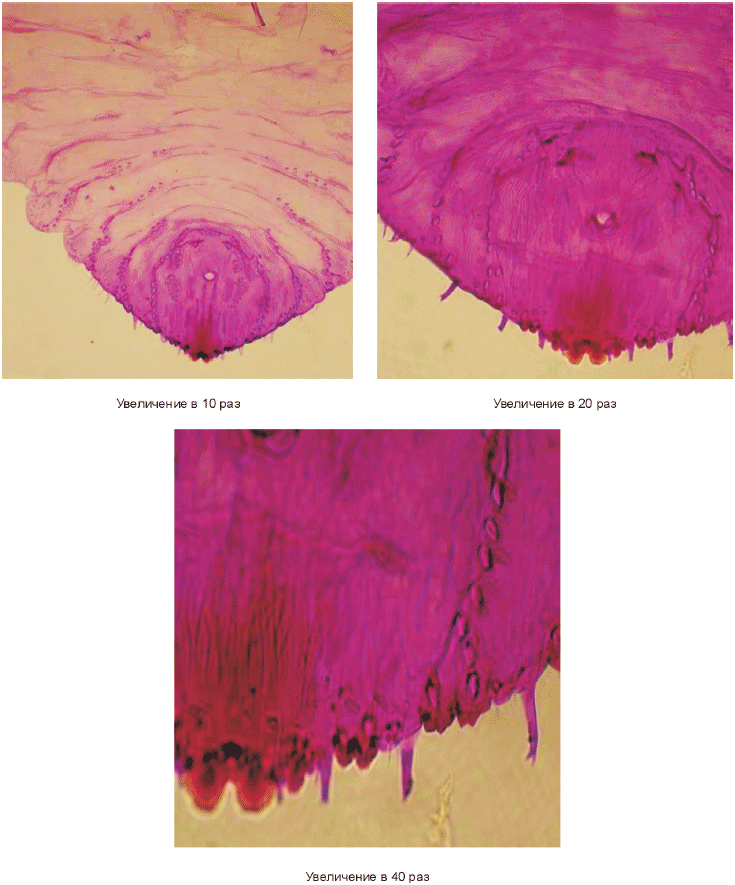
5.5.5.2 Диагностические микропризнаки пигидия самок
Пигидий самок тутовой щитовки имеет хорошо выраженные три пары долек.
Дольки первой пары L треугольные, удлиненные, параллельные, бока слабо зазубрены, почти гладкие, вершины закруглены. Дольки второй пары L
с хорошо развитой удлиненной внутренней долечкой и редуцированной наружной. Дольки третьей пары L
двулопастные.
Вторая вырезка пигидия с одним простым, а третья и четвертая вырезки с одно-, двух-, или трехветвистыми гребешками, от четвертой пары долек расположены еще один или два разветвленных на вершине гребешка. Все гребешки (кроме гребешка второй вырезки) имеют при основании от двух до трех микрожелез. Медиальные и подкраевые группы дорсальных желез развиты на втором - пятом сегментах брюшка.
Примечания
1 Определитель семейств надсемейства Coccoidea по самкам приведен в приложении В.
2 Определитель родов семейства Diaspididae по самкам приведен в приложении Г.
3 Определитель видов рода Pseudaulacaspis по микропризнакам пигидия самок приведен в приложении Д.
5.5.6 Требования к протоколу исследования
Протокол исследования должен включать в себя следующую информацию:
- латинское наименование идентифицированного вредного организма;
- дату выявления и идентификации вредного организма;
- код или шифр образца (для возможности отслеживания);
- природу зараженного материала, в том числе, по возможности, латинское наименование растения-хозяина;
- происхождение (включая географическое местонахождение, если оно известно) зараженного материала, и место его задержания или выявления вредного организма;
- описание признаков или симптомов (включая фотографии в соответствующих случаях, или указание об их отсутствии.
- методы выявления и идентификации вредного организма, а также результаты, полученные с помощью каждого метода;
- данные измерений для морфологических или морфометрических методов, рисунки или фотографии диагностических признаков (в соответствующих случаях) и, при необходимости, указание на стадии развития;
- при необходимости, состояние вредного организма (живой или мертвый) или жизнеспособность стадий его развития;
- в случае необходимости, масштабы заражения (количество особей вредного организма, зараженность растительного материала);
- наименование лаборатории и, при необходимости, фамилию лица (лиц), ответственного(ых) за исследование, и/или выполнившего исследование;
- комментарии о степени точности идентификации.
Приложение А
(справочное)
Общие сведения о тутовой щитовке
А.1 Общие сведения
Таксономическое положение: Insecta: Hemiptera: Homoptera: Sternorrhyncha: Diaspididae: Pseudaulacaspis.
Наименование: Pseudaulacaspis pentagona (Targioni-Tozzetti).
Синонимы:
Aulacaspis pentagona Targioni-Tozzetti;
Diaspis pentagona Targioni-Tozzetti;
Sasakiaspis pentagona Targioni-Tozzetti.
Общепринятые наименования:
White peach scale (англ.);
Japanese fruit scale (англ.);
West Indian peach scale (англ.);
Oleander scale (англ.);
Cochenilla du ![]() (франц.);
(франц.);
Maulbeerschildlaus (нем.);
Kuwa-kaigaramusi (яп.);
Dut kosnili (тур.).
Компьютерный код Байера: PSEAPE.
Фитосанитарный статус*:
________________
* По состоянию на начало 2015 г.
Азербайджан - А2;
Беларусь - статус карантинного объекта;
Казахстан - А1;
Молдова - А1;
Россия - А1;
Узбекистан - А1;
Чили - А1.
А.2 Биологические особенности
Изучение фенологических циклов тутовой щитовки в различных природно-климатических зонах позволило установить наличие нескольких поколений вредителя в разных экологических зонах. Во всех случаях зимуют оплодотворенные самки и самцы в стадии нимфы. Сроки весенней яйцекладки, выхода подвижных личинок первого возраста, развития личинок, самок и появление самцов варьируют и зависят от погодных условий. Метеорологические условия являются одним из главных факторов, тормозящих размножение тутовой щитовки. Сильное воздействие на выход подвижных личинок первого возраста оказывают как низкие температуры, так и сильная жара, ветры, дожди. Помимо метеорологических условий, на численность щитовки влияют энтомофаги.
В Греции тутовая щитовка имеет три поколения в год, в Соединенных Штатах Америки (далее - США) щитовка развивается в двух-четырех поколениях, в Китае щитовка в основных районах распространения имеет от двух до пяти поколений в год, в Италии тутовая щитовка имеет два-три поколения в год, во Франции - от двух до трех поколений, в Абхазии - три поколения.
В зависимости от климатических условий яйцекладка самок наблюдается в конце апреля либо в первых числах мая при температуре окружающего воздуха 14°С и длится примерно в течение двух недель.
Яйца и подвижные личинки первого возраста проявляют половой диморфизм в отношении цвета: самки первого и второго поколения откладывают яйца, которые распределяются на две группы - оранжевые и белые (дихроизм), а также различных оттенков (плеохроизм). В период яйцекладки самки откладывают яйца либо одного цвета, либо двух (однородный, либо смешанный тип яйцекладки). Подвижные личинки первого возраста, отродившиеся из окрашенных и белых яиц, сохраняют эти цвета в течение всех стадий развития.
Количество отложенных яиц колеблется в пределах от 131 до 165 - на территории бывшей Югославии, от 120 до 280 - во Франции, от 120 до 300 - в Италии, 130 - в США, от 36 до 140 - в Абхазии. Подвижные личинки первого возраста абхазской популяции встречаются в мае, в конце мая происходит линька на второй возраст и начинается половая дифференциация. Переход женских особей личинок второго возраста в самок начинается в первой и второй декаде июня.
В этот же период происходит вылет имаго самцов, который длится в течение 10 дней. Половозрелые самки второго поколения отмечены в третьей декаде июля - начале августа, в это же время отмечается лет самцов второго поколения вредителя. Молодые самки третьего поколения появляются обычно в конце сентября, в отдельные годы - в начале и середине октября. На это же время приходится и начало лета самцов.
Оплодотворенные самки уходят на зимовку.
В Греции яйцекладка весной отмечается с середины апреля, летом - в течение июля и начале августа и осенью - в сентябре и до середины октября. В США, в центральной и восточной части, где тутовая щитовка имеет три поколения, самки приступают к откладке яиц в середине апреля и продолжают ее в течение месяца. Созревание яиц длится от 12 до 14 дней у первого поколения и от семи до девяти дней у второго и третьего. Для развития первого поколения обычно необходимо от 70 до 74 дней, для второго - от 51 до 53 дней. Самки третьего поколения уходят на зимовку (см. рисунок Б. 10, приложение Б).
А.3 Повреждаемые растения
Наиболее повреждаемыми тутовой щитовкой плодовыми и декоративными культурами являются шелковица (Morus), смородина (Ribes), ежевика и малина (Rubus), виноград (Vitis), персик (Prunus persica), абрикос (Prunus armeniaca), слива (Prunus domestica), сирень (Syringa), катальпа (Catalpa), каркас западный (Celtis occidentalis), олеандр (Nerium), чубушник (Philadelphus), ясень (Fraxinus), софора (Sophora), актинидия деликатесная (киви) (Actinidia deliciosa) и другие - всего около 121 рода растений из 54 семейств.
А.4 Симптомы повреждения
Симптомами наличия тутовой щитовки являются: наличие колоний или отдельных особей щитовки на коре и листьях, обесцвечивание и/или преждевременное опадение листьев, наличие пятен на плодах, верхушечное усыхание саженцев растений-хозяев (см. рисунок Б.1, приложение Б). При сильном заселении плотные колонии способны формировать толстый слой из щитовок на стволах и ветках (см. рисунок Б.2, приложение Б).
А.5 Способы переноса и распространения
Существуют различные пути проникновения и распространения тутовой щитовки:
- первый путь - с посадочным и прививочным материалом (саженцы и черенки), включая горшечные растения. Вероятность распространения щитовки в зону фитосанитарного риска оценивается как высокая. Этот путь является основным и регулируемым;
- второй путь - с плодами. Вероятность распространения тутовой щитовки этим путем в зону фитосанитарного риска оценивается как низкая, так как с засыханием кожицы плода щитовка погибает. Импорт свежих плодов не представляет опасности завоза тутовой щитовки вследствие короткого периода жизни подвижных личинок первого возраста и их ограниченной способности к передвижению;
- третий путь - естественное распространение, которое предполагает расселение подвижных личинок первого возраста по стволу, ветвям, листьям и плодам растения-хозяина, а также по примыкающим к нему кронам соседних деревьев и перенос подвижных личинок первого возраста ветром, животными на насаждения. Это путь локального распространения щитовки, способствующий расширению уже имеющегося первичного очага;
- четвертый путь - со срезанными растениями. Вероятность распространения щитовки этим путем в зону фитосанитарного риска оценивается как низкая и средняя, так как с засыханием срезанного растения щитовка погибает, а способность к передвижению подвижных личинок первого возраста тутовой щитовки ограничена временем и наличием растения-хозяина. Но при использовании зараженных частей растения в качестве посадочного материала (черенки) и высаживания их в открытый грунт в зоне, подверженной опасности, существует опасность возникновения локального очага.
А.6 Географическое распространение
Страны происхождения тутовой щитовки - Китай, Корея и Япония.
В настоящее время тутовая щитовка распространена на всех континентах*.
________________
* По состоянию на начало 2015 г.
Европа: Болгария, Венгрия, Германия, Греция, Испания, Италия, Македония, Мальта, Нидерланды, Португалия, Сербия, Турция, Украина, Франция, Швейцария.
Азия: Азербайджан, Бангладеш, Вьетнам, Грузия, Израиль, Индия, Индонезия, Ирак, Иран, Китай, Северная Корея, Южная Корея, Малайзия, Мальдивы, Мьянма, Непал, Сирия, Тайвань, Филиппины, Шри-Ланка, Япония.
Африка: Египет, Зимбабве, Мадагаскар, Танзания, Маврикий, Реюньон, Сан-Томе, Сейшельские острова, ЮАР.
Северная и Центральная Америка: Бермудские острова, Доминиканская Республика, Гваделупа, Гаити, Гондурас, Коста-Рика, Куба, Мексика, Панама, Пуэрто-Рико, США, Тринидад, Тобаго.
Южная Америка: Аргентина, Боливия, Бразилия, Венесуэла, Колумбия, Перу, Суринам, Уругвай.
Австралия и Океания: Австралия, о.Гуам, Микронезия, Новая Каледония, о.Норфолк, Северные Марианские острова, Палау, Папуа - Новая Гвинея, Самоа, Соломоновы острова, Тонга, Фиджи, острова Уоллис и Фуртуна.
Приложение Б
(справочное)
Идентификация тутовой щитовки по морфологическим признакам
|
Рисунок Б.1 - Симптомы вредоносности тутовой щитовки: опадение листьев, нарушение процесса фотосинтеза, верхушечное усыхание, потеря жизнеспособности*
________________
* www.inra.fr.
|
Рисунок Б.2 - Образование характерных плотных колоний тутовой щитовки на растении-хозяине
|
Рисунок Б.3 - Особенности репродукции самки тутовой щитовки
|
Рисунок Б.4 - Щитки самцов тутовой щитовки с летными отверстиями
|
вг - вентральный глаз; гансг - глазной апофиз нижней стороны головы; гд - глазная дуга; дг - дорсальный глаз; звпн - зубчики вертлуга передней ноги; зн - задняя нога; к - крыло; ка - копулятивный аппарат; мпнсг - межантеннальная полоса нижней стороны головы; пгвсг - пятнообразный глазик на верхней стороне головы; пн - передняя нога; ппсб/в/ - предпоследний сегмент брюшка с волосками; псб - последний сегмент брюшка; псг - прескутум среднегруди; пссг - пластинка скутума среднегруди; сввсг - склеротизированная вилочка верхней стороны головы; сс - скутуллум среднегруди; у - усик; чу - первый и второй членики усика; шпсг - шип прескутума среднегруди; /ш/вгпн - шипик вершины голени передней ноги; M - медиальная жилка; R - радиальная жилка
Рисунок Б.5 - Общая схема строения самца семейства Diaspididae
|
а - имаго; б - схема строения дорсальной и вентральной сторон головы самца тутовой щитовки соответственно (отличительная особенность: наличие ячеистого рисунка на вентральной стороне головы и на втором членике усика)
Рисунок Б.6 - Самец тутовой щитовки
|
Рисунок Б.7 - Самка тутовой щитовки на плодах киви
|
Рисунок Б.8 - Тело самки тутовой щитовки
|
Рисунок Б.9 - Щиток самки тутовой щитовки: секреторная часть - белая, личиночные шкурки - характерного золотистого цвета
|
Рисунок Б.10 - Стадии развития тутовой щитовки
|
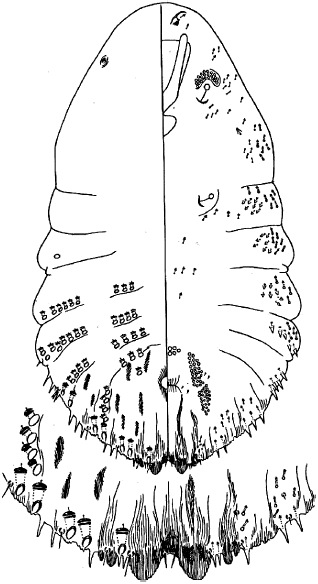
Рисунок Б.11 - Схема строения пигидия самки тутовой щитовки
|
Первая пара долек имеет треугольную форму, вторая пара долек имеет хорошо развитую внутреннюю долечку и почти редуцированную наружную, третья пара долек двулопастная. Третья и четвертая вырезки пигидия имеют ветвистые гребешки.
Рисунок Б.12 - Диагностические микропризнаки пигидия самки тутовой щитовки
|
Рисунок Б.13 - Диагностические микропризнаки пигидия самки тутовой щитовки при разных увеличениях микроскопа в проходящем свете
|
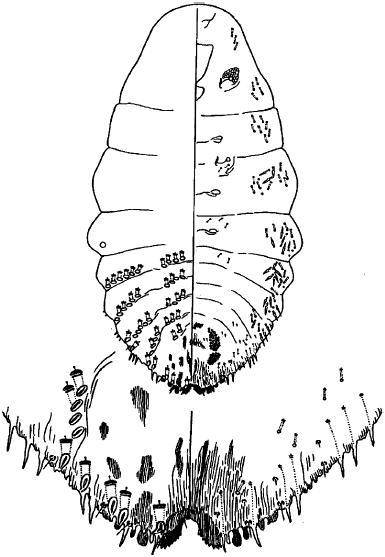
Рисунок Б.14 - Схема строения пигидия белой сливовой щитовки
|
Рисунок Б.15 - Схема строения пигидия сиреневой щитовки, заселяющей лиственные породы
|
Рисунок Б.16 - Схема строения пигидия сиреневой щитовки, заселяющей хвойные породы
Приложение В
(обязательное)
Определитель семейств надсемейства Coccoidea по самкам
1 (4) Брюшные дыхальца имеются (надсемейство Orthezioidea) | ||||||||||||
2 (3) Вся поверхность тела покрыта крупными пластинами плотного воска. Анальный аппарат | ||||||||||||
представлен анальным кольцом с многочисленными порами и шестью щетинками | Ortheziidae | |||||||||||
3 (2) Поверхность тела покрыта порошковидным воском или голая. Анальный аппарат представлен только анальным отверстием или впяченной внутрь тела анальной трубкой, внутренний конец которой | ||||||||||||
окружен порами | Margarodidae | |||||||||||
4 (1) Брюшных дыхалец нет (надсемейство Coccoidea). 5 (6) Имеется хотя бы один из следующих признаков: спинные устьица, трехячеистые железы, церарии | ||||||||||||
Pseudococcidae | ||||||||||||
6 (5) Спинных устьиц, трехячеистых желез и церариев нет. 7 (10) Имеются особые феникоккоидные восковые железы. | ||||||||||||
8 (9) Последние сегменты тела слиты в пигидий. Тело покрыто восковым щитком | Diaspididae | |||||||||||
9 (8) Пигидия и щитка нет. Тело покрыто рыхлыми восковыми нитями. Обитает только на пальмах | ||||||||||||
Phoenicococcidae | ||||||||||||
10 (7) Феникоккоидных восковых желез нет. 11 (12) Имеются 8-образные восковые железы (у Endernia Danzig, 1971 эти железы имеются у личинок, | ||||||||||||
но утрачены у взрослой самки) | Asterolecaniidae | |||||||||||
12 (11) Восковых желез 8-образной структуры нет. 13 (16) Задний конец тела раздвоен анальной щелью, а анальное отверстие закрыто анальными пластинками. 14 (15) Имеются две одинаковые, симметрично расположенные анальные пластинки. Ноги имеются. Очень редко (род Physokermes Targioni-Tozzetti, 1868) анальные пластинки и ноги отсутствуют; в этом | ||||||||||||
случае самки сильно выпуклые, почковидные, живут на ветвях | Coccidae | |||||||||||
15 (14) Анальная пластинка одна. Ног нет. Палеарктические виды живут только на злаках и осоках | ||||||||||||
Aclerdidae | ||||||||||||
16 (13) Задний конец тела не раздвоен анальной щелью; анальных пластинок нет, но иногда (у Micrococcus Leonardi, 1907) похожие симметричные структуры расположены по бокам от анального отверстия, не закрывая его. | ||||||||||||
17 (18) Вагинальная щель расположена на шестом стерните брюшка | Micrococcidae | |||||||||||
18 (17) Вагинальная щель расположена между двумя последними (седьмым и восьмым) стернитами брюшка. | ||||||||||||
19 (22) На теле расположены многочисленные дисковидные и/или цилиндрические восковые железы. | ||||||||||||
20 (21) Тело взрослой самки заключено в войлокообразный яйцевой мешок, с более или менее ясно выраженной дорсальной и вентральной сторонами, эластичное. Анальный аппарат с порами | ||||||||||||
Eriococcidae | ||||||||||||
21 (20) Тело взрослой самки голое, сильно выпуклое, шаровидное или почковидное, сильно склеротизированное. Анальный аппарат без пор. Обитает только на растениях семейства Fagaceae - | ||||||||||||
буковые | Kermesidae | |||||||||||
22 (19) Дисковидных и цилиндрических желез нет | Xenococcidae | |||||||||||
Приложение Г
(обязательное)
Определитель родов семейства Diaspididae по самкам
1 (2) Пигидий без гребешков, долек и склеротизованных зубчиков по краю. Дорсальные железы короткие, с двумя склеротизованными ободками, многочисленны на пигидии и препигидиальных сегментах брюшка. Самка не заключена в пупарий. (Подсемейство Diaspidinae. Триба Diaspidini) | |||||||||||||||||||||||||||||||||||
52. Adiscodiaspis Marchal | |||||||||||||||||||||||||||||||||||
2 (1) Пигидий с гребешками, дольками или склеротизованными зубчиками по краю, если гребешков, долек и зубчиков нет, самка заключена в пупарий. Дорсальные железы разного типа. 3 (6) Пигидий с одной непарной долькой или без долек, но со склеротизованными зубчиками по краю. Брюшко с глубокими бороздками между сегментами. Гребешков нет, или они собраны в пучок на вершине пигидия. Дорсальные железы узкие, одного типа и размера с вентральными, и те, и другие на пигидии многочисленны, расположены беспорядочно. Обитает на злаках. (Подсемейство Aspidiotinae. Триба Odonaspidini). | |||||||||||||||||||||||||||||||||||
4 (5) Вершина пигидия с пучком длинных щетинковидных гребешков | 9. Froggattiella Leonardi | ||||||||||||||||||||||||||||||||||
5 (4) Вершина пигидия без гребешков | 8. Odonaspis Leonardi | ||||||||||||||||||||||||||||||||||
6 (3) Пигидий с одной и более парами долек, иногда дольки полностью редуцированы, если средняя пара долек слита в одну, то брюшко без глубоких бороздок между сегментами. Гребешки обычно имеются, никогда не собраны в пучок на вершине пигидия. Дорсальные железы обычно крупнее вентральных, часто собраны на пигидии в поперечные или продольные ряды или полосы. Вентральные железы немногочисленны. На разных растениях. 7 (48) Дольки пигидия не раздвоены. Гребешки у самок и личинок второго возраста широкие и зазубренные, реже щетинковидные, с микрожелезой или без нее. Железы короткие или длинные, с двумя или одним склеротизованными ободками. Если имеются краевые железы (триба Parlatoriini), то их устьица параллельны заднему краю пигидия, а расположение не упорядочено. 8 (21) Дорсальные железы самки и личинки второго возраста с двумя склеротизованными ободками, короткие, длина желез превосходит ширину устьица не более чем в четыре-пять раз. Краевые железы имеются или отсутствуют. 9 (16) Самка свободная, щиток с двумя линочными шкурками, реже она заключена в пупарий и щиток с одной линочной шкуркой. Тело округлое или овальное. Усик с одной щетинкой (две у Gymnaspis). Гребешки между дольками широкие и короткие (при этом на вершине зазубренные) или узкие (щетинковидные), всегда с микрожелезой. Дорсальные железы широкие и короткие. Краевые железы обычно имеются. (Триба Parlatoriini). 10 (15) Краевые и дорсальные железы имеются. Пигидий с одной или более парами долек, как исключение дольки редуцированы или отсутствуют, тогда гребешки широкие, на вершине зазубренные. Самка свободная, реже в пупарии. | |||||||||||||||||||||||||||||||||||
11 (12) Гребешки пигидия широкие, сильно зазубренные на вершине | 1. Parlatoria Targioni | ||||||||||||||||||||||||||||||||||
12 (11) Гребешки пигидия щетинковидные или удлиненно-конусовидные, иногда отсутствуют. 13 (14) Пигидий с крупными, горизонтально расположенными парафизами. Самка без пупария | |||||||||||||||||||||||||||||||||||
2. Parlatoreopsis Lindinger | |||||||||||||||||||||||||||||||||||
14 (13) Горизонтальных парафиз нет. Самка в пупарии | 3. Cryptoparlatoreopsis Borchsenius | ||||||||||||||||||||||||||||||||||
15 (10) Краевых и дорсальных желез и долек нет. Гребешки щетинковидные или удлиненно-конусовидные, длинные, многочисленные по краю пигидия, с длинной цилиндрической | |||||||||||||||||||||||||||||||||||
железой при основании. Самка в пупарии | Gymnaspis Newstead | ||||||||||||||||||||||||||||||||||
16 (9) Самка заключена в пупарий, щиток с одной линочной шкуркой. Тело удлиненное или овальное. Усик с двумя или более щетинками. Гребешки между дольками, если имеются, длинные (длиннее долек), узкие, без микрожелез. Дорсальные железы мелкие, лишь немного крупнее вентральных. Краевых желез нет. (Триба Leucaspidini). | |||||||||||||||||||||||||||||||||||
17 (18) Вдоль края тела расположен ряд конусовидных гребешков, который начинается от ротового | |||||||||||||||||||||||||||||||||||
аппарата и доходит до середины брюшка или даже до пигидия | 5. Lopholeucaspis Balachowsky | ||||||||||||||||||||||||||||||||||
18 (17) Конусовидных гребешков вдоль края тела нет. 19 (20) Вагинальная щель короткая, вершина брюшка с вентральной стороны без глубоких складок. Пигидий с длинными, хорошо развитыми гребешками, если гребешков нет, то имеются три пары | |||||||||||||||||||||||||||||||||||
маленьких конических склеротизованных долек | 6. Leucaspis Signoret | ||||||||||||||||||||||||||||||||||
20 (19) Вагинальная щель длинная, вершина брюшка с вентральной | |||||||||||||||||||||||||||||||||||
стороны с глубокими складками. Гребешков нет, долек нет, или имеется одна пара широких, слабо | |||||||||||||||||||||||||||||||||||
склеротизованных долек | 7. Salicicola Lindinger | ||||||||||||||||||||||||||||||||||
21 (8) Дорсальные железы самки и личинки второго возраста с одним склеротизованным ободком, длинные, их длина во много раз превосходит ширину их устьица. Краевых желез нет. (Триба Aspidiotini). | |||||||||||||||||||||||||||||||||||
22 (47) Самка не заключена в пупарий, щиток самки с двумя линочными шкурками. Дорсальные железы обычно многочисленны, часто расположены не только на пигидии, но и на передних сегментах брюшка, а иногда и на груди. | |||||||||||||||||||||||||||||||||||
23 (24) Голова с переднегрудью отделены от среднегруди перетяжкой; передние, а иногда и задние дыхальца с группой дисковидных желез; дорсальная поверхность пигидия с сетчатым узором. Долек | |||||||||||||||||||||||||||||||||||
четыре пары. (Подтриба Pseudaonidiina) | 10. Pseudaonidia Cockerell | ||||||||||||||||||||||||||||||||||
24 (23) Перетяжки на груди нет, дисковидных желез возле дыхалец и сетчатого узора на пигидии нет. | |||||||||||||||||||||||||||||||||||
25 (34) Край пигидия сильно склеротизован, часто наряду с дольками имеются зубчики. Дорсальные железы узкие, нитевидные, обычно такого же диаметра, как вентральные. | |||||||||||||||||||||||||||||||||||
26 (29). Дорсальные железы пигидия такой же длины и в таком же количестве, как вентральные. (Подтриба Targioniina). | |||||||||||||||||||||||||||||||||||
27 (28) Пигидий с продольными бороздками, дорсальные железы длинные, собраны в продольные | |||||||||||||||||||||||||||||||||||
ряды вдоль этих бороздок; край пигидия обычно без зубцов | 19. Targionia Signoret | ||||||||||||||||||||||||||||||||||
28 (27) Пигидий лишен продольных бороздок, дорсальные железы вдвое короче, чем у Targionia, не образуют продольных рядов: собраны вдоль края пигидия или расположены беспорядочно; край | |||||||||||||||||||||||||||||||||||
пигидия зубчатый | 20. Rhizaspidiotus MacGillivray | ||||||||||||||||||||||||||||||||||
29 (26) Дорсальные железы по крайне мере вдвое длиннее вентральных и обычно многочисленнее их. (Подтриба Melanaspidina). | |||||||||||||||||||||||||||||||||||
30 (31) Тело самки круглое, с большим выступом на переднем крае, грудной бугорок расположен | |||||||||||||||||||||||||||||||||||
впереди передних дыхалец | 23. Mycetaspis Cockerell | ||||||||||||||||||||||||||||||||||
31 (30) Тело самки грушевидное, без выступа на переднем крае, грудной бугорок не развит или расположен на заднегруди. | |||||||||||||||||||||||||||||||||||
32 (33) Грудной бугорок не развит, пигидий широкий, образует тупой угол | 21. Melanaspis Cockerell | ||||||||||||||||||||||||||||||||||
33 (32) Грудной бугорок хорошо развит, расположен на заднегруди. Пигидий узкий, образует острый | |||||||||||||||||||||||||||||||||||
угол | 22. Acutaspis Ferris | ||||||||||||||||||||||||||||||||||
34 (25) Край пигидия обычно склеротизован слабо и лишен зубчиков, имеются только дольки. Дорсальные железы по крайней мере вдвое шире вентральных. (Подтриба Aspidiotina). | |||||||||||||||||||||||||||||||||||
35 (36) Кутикула возле передних дыхалец у палеарктических видов мелко гранулирована, боковые и передние гребешки узкие, длинные, разветвлены на вершине или зазубрены по краю, расположены | |||||||||||||||||||||||||||||||||||
на расстоянии друг от друга | 16. Chortinaspis Ferris | ||||||||||||||||||||||||||||||||||
36 (35) Кутикула возле передних дыхалец лишена грануляции. Гребешки разного строения. | |||||||||||||||||||||||||||||||||||
37 (46) Боковые и передние гребешки крупные, обычно длиннее долек, если короче, то | |||||||||||||||||||||||||||||||||||
38 (39) Край пигидия с пятью парами крупных веретенообразных удлиненных парафиз, кпереди от передней группы гребешков край пигидия сильно склеротизован и зазубрен | |||||||||||||||||||||||||||||||||||
14. Chrysomphalus Ashmead | |||||||||||||||||||||||||||||||||||
39 (38) Парафиз нет, или они мелкие, край пигидия кпереди* от передней группы гребешков не склеротизован и не зазубрен. | |||||||||||||||||||||||||||||||||||
40 (41) Передний отдел тела взрослой самки сильно склеротизован, имеет подковообразную форму, причем боковые края тела выступают за край пигидия; если тело не склеротизовано и не имеет подковообразной формы (Aonidiella orientalis), то передние гребешки отличаются от боковых: они | |||||||||||||||||||||||||||||||||||
цельные, булавовидные | 13. Aonidiella Berlese et Leonardi | ||||||||||||||||||||||||||||||||||
41 (40) Передний отдел тела взрослой самки не склеротизован и не принимает подковообразную форму; передние гребешки, если имеются, по форме сходны с боковыми, разветвленные, не булавовидные. | |||||||||||||||||||||||||||||||||||
42 (43) Анальное отверстие расположено близ вершины пигидия, оно очень крупное, его диаметр | |||||||||||||||||||||||||||||||||||
превосходит ширину | 15. Hemiberlesia Cockerell | ||||||||||||||||||||||||||||||||||
43 (42) Анальное отверстие отодвинуто от вершины пигидия (расположено в нижней 1/3 или 1/4 пигидия), его диаметр не больше диаметра | |||||||||||||||||||||||||||||||||||
44 (45) Средние дольки значительно крупнее боковых, каждая долька продолжается внутрь пигидия склеротизованными участками кутикулы, которые часто сливаются вместе. Боковые и передние | |||||||||||||||||||||||||||||||||||
гребешки длиннее долек, сильно разветвлены | 11. Aspidiotus Bouche | ||||||||||||||||||||||||||||||||||
45 (44) | |||||||||||||||||||||||||||||||||||
передние узкие, слабо разветвлены, иногда отсутствуют | 12. Dynaspidiotus Thiem et Gerneck | ||||||||||||||||||||||||||||||||||
46 (37) Боковые и передние гребешки мелкие, редуцированные, не длиннее долек, иногда гребешков нет совсем. | |||||||||||||||||||||||||||||||||||
редуцированы и | 17. Diaspidiotus Berlese, включая Quadraspidiotus MacGillivray | ||||||||||||||||||||||||||||||||||
47 (22) Самка заключена в пупарий, в состав щитка самки входит одна линочная шкурка. Дорсальные железы только на пигидии, малочисленны, их не более 12 с каждой стороны пигидия. (Подтриба | |||||||||||||||||||||||||||||||||||
Aonidiina | 18. Aonidia Targioni Tozzetti | ||||||||||||||||||||||||||||||||||
48 (7) Дольки пигидия, исключая среднюю пару, раздвоены. Гребешки щетинковидные, с микрожелезой. Дорсальные железы короткие, с двумя склеротизованными ободками. Краевые железы, как правило, имеются, их отверстия расположены перпендикулярно по отношению к заднему краю тела, часто на пигидии их расположение подчиняется формуле 1, 2, 2, 1 (Подсемейство Diaspidinae). 49 (66) Между средними дольками пигидия обычно расположены два длинных щетинковидных гребешка с микрожелезой. Дорсальные железы пигидия мелкие, значительно мельче краевых. (Триба Lepidosaphini). 50 (51) Край пигидия со склеротизованными зазубринами, среди которых выделяются четыре пары | |||||||||||||||||||||||||||||||||||
долек | 29. Cynodontaspis Takagi | ||||||||||||||||||||||||||||||||||
51 (50) Край пигидия без склеротизованных зазубрин, долек одна-две пары, или их нет совсем. 52 (61) Пигидий с двумя парами долек, иногда дольки редуцированы. | |||||||||||||||||||||||||||||||||||
53 (54) Дорсальная поверхность пигидия с узором из крупных ячеек | 27. Ischnaspis Douglas | ||||||||||||||||||||||||||||||||||
54 (53) Дорсальная поверхность пигидия без ячеистого узора. 55 (56) Между средними дольками имеется пара крупных вентральных желез, первая вырезка пигидия | |||||||||||||||||||||||||||||||||||
без гребешков | 25. Koroneaspis Bodenheimer | ||||||||||||||||||||||||||||||||||
56 (55) Между средними дольками крупных вентральных желез нет, первая вырезка пигидия обычно с парой гребешков. 57 (60) На вентральной поверхности брюшка имеются поперечные ряды шипов или шиповидных щетинок. Краевых желез пять пар, или они отсутствуют. 58 (59) Краевых желез пять пар. Дорсальные железы расположены правильными рядами. Первая | |||||||||||||||||||||||||||||||||||
вырезка пигидия с парой гребешков | 31. Acanthomytilus Borchsenius | ||||||||||||||||||||||||||||||||||
59 (58) Краевых желез нет. Дорсальные железы расположены беспорядочно. Первая вырезка пигидия | |||||||||||||||||||||||||||||||||||
с гребешками или без них | 32. Mohelnaspis Sulc | ||||||||||||||||||||||||||||||||||
60 (57) На вентральной поверхности брюшка шипов и шиповидных щетинок нет. Краевых желез шесть | |||||||||||||||||||||||||||||||||||
(редко семь) пар | 24. Lepidosaphes Shimer | ||||||||||||||||||||||||||||||||||
61 (52) Долек одна пара, или их нет совсем. 62 (65) Краевые железы имеются. Брюшко без глубоких вырезок по бокам и без склеротизованных шипов. Средние дольки без парафиз. 63 (64) Тело не сужается к головному концу, овальное или яйцевидное. Дольки широко расставлены, симметричные, без крупных вырезок, иногда очень малы или полностью редуцированы | |||||||||||||||||||||||||||||||||||
30. Mercetaspis Gomez-Menor | |||||||||||||||||||||||||||||||||||
64 (63) Тело сужается к головному концу, грушевидной формы. Дольки сближены, хорошо развиты, | |||||||||||||||||||||||||||||||||||
асимметричные, внешний край с глубокой вырезкой | 26. Ferreroaspis Kozar | ||||||||||||||||||||||||||||||||||
65 (62) Краевых желез нет. Брюшко с глубокими вырезками по бокам и склеротизованными шипами. | |||||||||||||||||||||||||||||||||||
Средние дольки с очень крупными парафизами | 28. Howardia Berlese et Leonardi | ||||||||||||||||||||||||||||||||||
66 (49) Между средними дольками пигидия длинных щетинковидных гребешков нет. Дорсальные железы пигидия крупные, по крайней мере часть дорсальных желез по размеру приближается к краевым, если дорсальные железы мелкие, то краевых желез нет. (Триба Diaspidini). | |||||||||||||||||||||||||||||||||||
67 (92) Тело самки обычно удлиненное. Средние дольки, как правило, соединены основаниями, иногда слиты в одну. Щиток самки грушевидный, как исключение круглый. Непарной краевой железы между дольками нет. (Подтриба Chionaspidina). | |||||||||||||||||||||||||||||||||||
68 (69) Тело самки заключено в пупарий. Усики расположены у переднего края тела. Дорсальных желез | |||||||||||||||||||||||||||||||||||
нет, или они единичны | 37. Fiorinia Targioni Tozzetti | ||||||||||||||||||||||||||||||||||
69 (68) Тело самки не заключено в пупарий. Усики расположены с отступом от переднего края тела. Дорсальные железы многочисленны. | |||||||||||||||||||||||||||||||||||
поперечные ряды, немногочисленны | 44. Kuwanaspis MacGillivray | ||||||||||||||||||||||||||||||||||
72 (71) Тело самки грушевидное, сильно расширенное сзади. Дорсальные железы расположены | |||||||||||||||||||||||||||||||||||
беспорядочно, многочисленны | 45. Nikkoaspis Kuwana | ||||||||||||||||||||||||||||||||||
73 (70) Пигидий без широких, сверху зазубренных гребешковидных образований. | |||||||||||||||||||||||||||||||||||
дольками сосочковидных выростов нет | 43. Unachionaspis MacGillivray | ||||||||||||||||||||||||||||||||||
76 (75) Пигидий на вершине уплощен, слегка вогнут. | |||||||||||||||||||||||||||||||||||
имеются два сосочковидных выроста | 40. Lineaspis MacGillivray | ||||||||||||||||||||||||||||||||||
77 (74) Средние дольки пигидия сближены, расстояние между их основаниями меньше ширины долек, или дольки соприкасаются; дольки крупные, широкие. 78 (89) Краевые железы имеются. 79 (80) Внутренние края средних долек параллельны, сильно сближены или соприкасаются, образуя | |||||||||||||||||||||||||||||||||||
одну непарную дольку | 34. Pinnaspis Cockerell | ||||||||||||||||||||||||||||||||||
80 (79) Внутренние края средних долек расположены под углом друг к другу, не сближены. | |||||||||||||||||||||||||||||||||||
81 (82) Между средними дольками пигидия имеются две щетинки | |||||||||||||||||||||||||||||||||||
36. Pseudaulacaspis MacGillivray | |||||||||||||||||||||||||||||||||||
82 (81) Между средними дольками пигидия щетинок нет. | |||||||||||||||||||||||||||||||||||
83 (84) Головной конец тела расширен. Голова, передне- и среднегрудь слиты и отделены от остальной части тела перетяжкой. Передняя часть, реже все тело сильно склеротизованы. Щиток самки круглый | |||||||||||||||||||||||||||||||||||
39. Aulacaspis Cockerell | |||||||||||||||||||||||||||||||||||
84 (83) Головной конец тела сужен. Граница между передне- и среднегрудью обычно хорошо заметна. Передняя часть тела, как правило, не склеротизована. Щиток самки удлиненный. | |||||||||||||||||||||||||||||||||||
85 (86) Дорсальные железы на пигидии расположены беспорядочно. Щиток самки коричневый | |||||||||||||||||||||||||||||||||||
33. Unaspis MacGillivray | |||||||||||||||||||||||||||||||||||
86 (85) Дорсальные железы на пигидии образуют отчетливые подкраевые и медиальные ряды. Щиток самки белый. | |||||||||||||||||||||||||||||||||||
87 (88) Основания средних долек соприкасаются или соединены склеротизованной перемычкой | |||||||||||||||||||||||||||||||||||
35. Chionaspis Signoret | |||||||||||||||||||||||||||||||||||
88 (87) Основания средних долек не соприкасаются и не соединены склеротизованной перемычкой | |||||||||||||||||||||||||||||||||||
38. Duplachionaspis MacGillivray | |||||||||||||||||||||||||||||||||||
89 (78) Краевых желез нет. | |||||||||||||||||||||||||||||||||||
90 (91) Внутренние края средних долек соприкасаются, дольки слиты в одну непарную, щетинок между | |||||||||||||||||||||||||||||||||||
ними нет. | 41. Contigaspis MacGillivray | ||||||||||||||||||||||||||||||||||
91 (90) Средние дольки обычно раздвинуты, иногда сближены, но между ними всегда имеется | |||||||||||||||||||||||||||||||||||
пара щетинок | 42. Neochionaspis Borchsenius | ||||||||||||||||||||||||||||||||||
92 (67) Тело самки почти круглое, суженное к пигидию. Средние дольки пигидия не соединены основаниями. Щиток самки круглый или овальный. (Подтриба Diaspidina). | |||||||||||||||||||||||||||||||||||
93 (100) Между средними дольками пигидия имеется пара гребешков. | |||||||||||||||||||||||||||||||||||
94 (97) Гребешки между средними дольками пигидия хорошо развиты, такой же длины, как дольки. | |||||||||||||||||||||||||||||||||||
95 (96) Циркумгенитальные железы имеются | 50. Pseudoparlatoria Cockerell | ||||||||||||||||||||||||||||||||||
96 (95) Циркумгенитальных желез нет | 49. Furchadaspis MacGillivray | ||||||||||||||||||||||||||||||||||
97 (94) Гребешки между средними дольками пигидия короткие, значительно короче долек. | |||||||||||||||||||||||||||||||||||
98 (99) Пигидий с сетчатым узором. Конусовидные гребешки многочисленны | |||||||||||||||||||||||||||||||||||
51. Takahashiaspis Takagi | |||||||||||||||||||||||||||||||||||
99 (98) Пигидий без сетчатого узора. Конусовидных гребешков нет | 47. Carulaspis MacGillivray | ||||||||||||||||||||||||||||||||||
100 (93) Между средними дольками гребешков нет. | |||||||||||||||||||||||||||||||||||
101 (102) | |||||||||||||||||||||||||||||||||||
параллельными боковыми краями | 46. Diaspis Costa | ||||||||||||||||||||||||||||||||||
102 (101) | 48. Epidiaspis Cockerell | ||||||||||||||||||||||||||||||||||
Приложение Д
(обязательное)
Определитель видов рода Pseudaulacaspis по микропризнакам пигидия самок
1 (4) Тело самки широкоовальное, почти круглое. Средние дольки пигидия не сильно зазубрены, почти гладкие, сближены. | ||||||||
2 (3) Третья и четвертая вырезки пигидия с одно-, двух- или трехветвистым на вершине гребешком | ||||||||
1. Pseudaulacaspis pentagona (Targioni-Tozzetti) (см. | ||||||||
рисунки Б.11, Б.12 и Б.13, приложение Б). | ||||||||
3 (2) Третья или четвертая вырезки пигидия с двумя гребешками, большинство гребешков пигидия с | ||||||||
щетинковидной вершиной | 2. Pseudaulacaspis prunicola (Maskell) | |||||||
(см. рисунок Б.14, приложение Б). | ||||||||
4 (1) Тело самки удлиненное. Средние дольки пигидия сильно зазубрены, широко раздвинуты. | ||||||||
отсутствуют | 3. Pseudaulacaspis cockerelli (Cooley) (см. рисунки Б.15 и Б.16, приложение Б). | |||||||
УДК 632.7:006.354 | МКС 01.040.65 |
Ключевые слова: тутовая щитовка, методы выявления, феромонные ловушки, морфологическая идентификация, микропрепарат, посадочный материал, прививочный материал, плодовые культуры, декоративные культуры | |
Редакция документа с учетом
изменений и дополнений подготовлена